서론
실험방법
용해가스오일 제조
CCE(Constant Composition Expansion) 실험
계면장력 소멸실험
결과 및 토의
계면장력 소멸실험 결과
용해가스에 따른 영향
온도의 영향
용해 가스와 온도의 영향 분석
결론
서론
CO2-EOR(오일회수증진) 기술은 1차, 2차 생산을 통해 생산저감 유전을 대상으로 고압의 CO2 가스를 주입하여 오일생산량을 증대시키는 기술 중 하나이다(Jha, 1986). CO2-EOR 설계를 위한 필수요소로서 오일과 CO2의 혼화압력이 있으며, CO2 주입압력에 따라서 혼화(miscible)공법, 비혼화(immiscible)공법으로 분류한다(Gu et al., 2013). 혼화압력측정을 위한 다양한 실험방법이 개발되었으며 저비용으로 빠르고 정확하게 측정하는 방법에 대해 많은 연구가 수행되고 있다(Gao et al., 2010; Zhang et al., 2018).
최소혼화압력(Minimum Miscible Pressure, MMP)은 다중접촉혼화압력(Multi contact miscible Pressure, MCMP)과 초기접촉혼화압력(First Contact Miscible Pressure, FCMP)으로 나누어진다. MCMP는 기체상과 오일상이 성분교환에 의해서 물리적 성질이 동일해지는 과정에서 형성되며, FCMP는 충분히 높은 압력에서 처음 기체상과 오일상의 모든 접촉부분이 하나의 상으로 변하는 초기압력이다(Farzad and Amani, 2012). 오일필드에서 일반적으로 MCMP보다 MMP로 사용하므로 이 연구에서는 MCMP 대신 MMP로 사용하였다.
혼화압력 측정방법은 슬림튜브와 RBA(Rise-Bubble Apparatus)방법이 일반적으로 사용되며(Elsharkawy et al., 1992) 슬림튜브 방법은 실제조건에서 다상유체의 유동모사가 가능하지만 시간과 비용이 많이 소모되는 단점이 있다(Gu et al., 2013). RBA 방법(Christiansen and Haines, 1987)은 혼화상태 형성과정에서 기화공정만을 모사하고 응축공정을 확인하지 못한 단점이 있으며 위의 단점을 개선한 측정방법은 계면장력소멸방법(Vanishing Interfacial Tension method)이라 불리는 실험방법이다(Rao, 1997; Sequeira et al., 2008). 그러나 직선 커브구간이 명확하게 나타나지 않을 경우도 있음에 따라 실험 관측의 면밀한 분석이 필요한 한계가 있다.
선대칭방울형상분석(Axisymmetric drop shape analysis, ADSA)을 통해 오일상과 기체상 사이의 계면장력(Interfacial Tension, IFT)을 측정할 수 있으며(Abdurrahman, 2016), 혼화상태에 도달했을 때 두상 사이의 계면장력이 소멸되는 개념을 이용하여 혼화상태를 분석하고 혼화압력을 측정할 수 있다(Rao, 1997).
무용해가스오일(Dead oil)에 용해가스를 혼합하여 용해가스오일(Live oil)을 제작하는 방법은 실험을 수행하기 위한 고압조건에서도 가스누출이 발생하지 않도록 실험장비 활용이 필수적이며, 실험조건에 맞는 용해가스 주입량을 조절하여 혼합하는 과정에도 어려움이 있기 떄문에 기존의 혼화압력측정 연구는 대부분 무용해가스오일(Dead oil)을 이용했다(Cao and Gu, 2012; Kim, 2015). 본 연구에서는 용해가스오일을 이용한 실험을 진행하였으며 용해가스 및 온도가 혼화압력인 MMP와 FCMP에 미치는 영향을 비교분석하였다.
실험방법
용해가스오일 제조
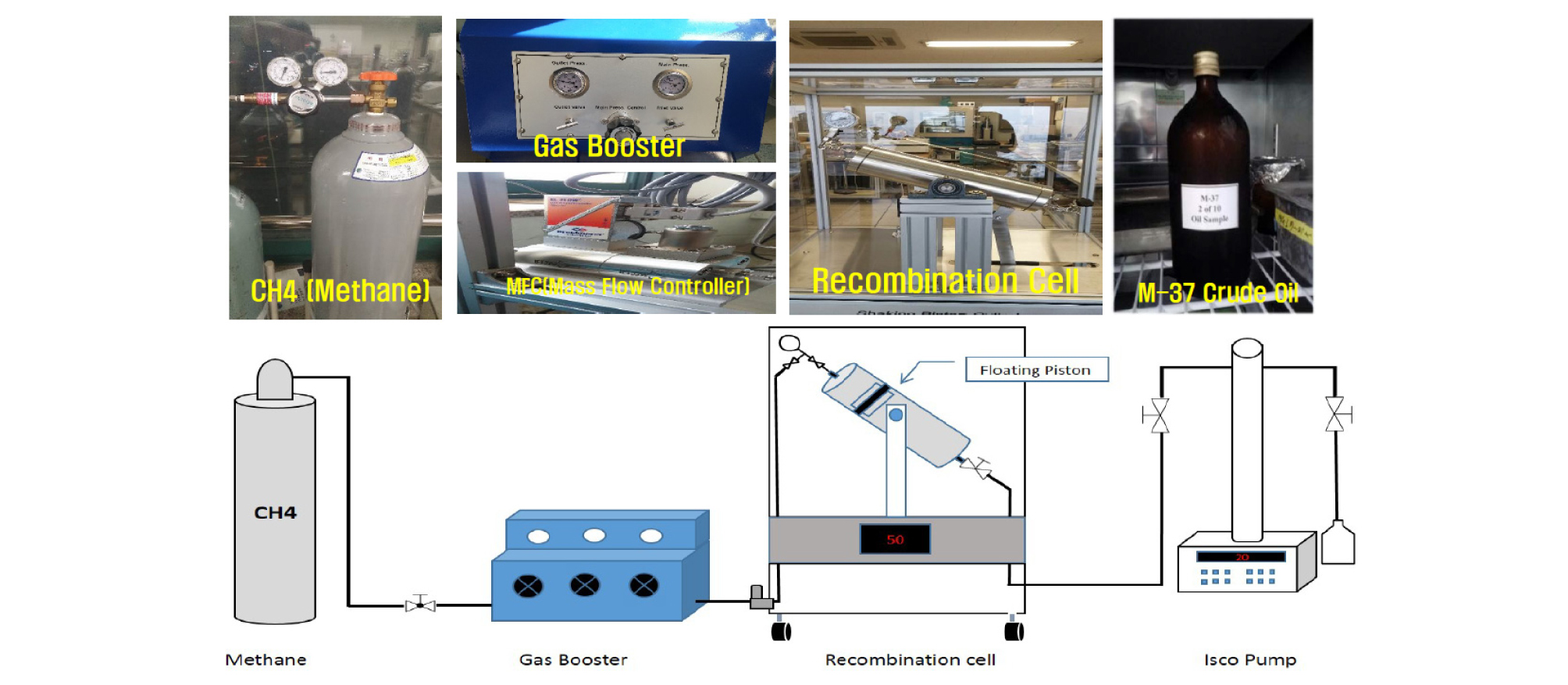
저류층 내부의 원유를 모사하기 위해 오일과 메탄을 혼합하여 용해가스오일을 제조하였다. 실험에서 사용된 오일은 인도네시아의 수마트라 유전(X)의 오일로 헵탄 플러스가 69.65 mol%, 메탄이 18.5 mol%, 에탄이 1.79 mol%으로 구성된 41.38 ºAPI인 경질유가 사용되었으며 원유의 용해가스 중 메탄의 성분이 약 60% 이상으로 구성되어 있어 용해가스오일을 제조할 때 메탄을 이용하여 실험을 수행하였다. 자체 제작한 용해가스오일 제작장치를 이용하여 고압피스톤 셀 내부에서 용해가스오일이 제조되었다(Fig. 1). 용해가스오일 제작장치는 피스톤 셀, 가스부스터, 질량유량제어기(Mass Flow Controller, MFC)로 구성되어 있다. 피스톤 셀은 외부관찰이 가능한 고온고압 사파이어 셀로 용해가스오일을 주입하기 위한 피스톤이 있으며 오일과 가스의 혼합을 위한 교반장치가 있다. 가스부스터는 메탄가스 실린더 내 압력이 피스톤 셀로 가스를 주입하기에 충분하지 않기 때문에 주입압력을 높이기 위해 사용된다. 질량유량제어기를 이용하여 주입되는 가스의 양을 조절함으로써 용해가스오일의 GOR(Gas oil Ratio)을 조절하였다.
용해가스오일 제작은 우선 피스톤 셀 내부에 정량의 무용해가스오일(Dead oil)을 넣고 저류층 원유자료(Table 1)의 GOR 값을 270 SCF/STB의 비율로 메탄가스를 주입하였다. 피스톤 셀의 온도와 압력을 저류층 조건(1,200 psi, 68°C)에 맞추며 단상을 만들기 위해 오일과 메탄가스를 2~3일 동안 교반장치를 이용하여 혼합시켰다. 이를 통해 제조된 오일을 사용하여 실험을 수행하였다.
Table 1. Crude oil and reservoir properties of real oil field in Sumatra oil field X
CCE(Constant Composition Expansion) 실험
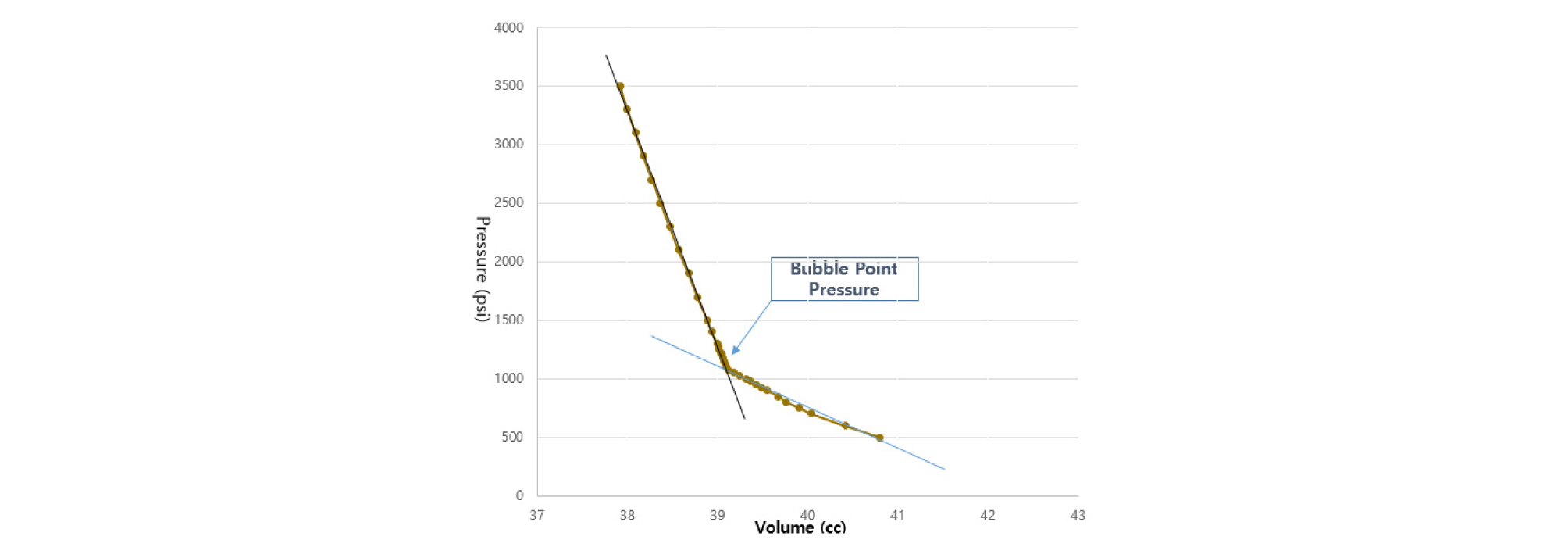
제작된 용해가스오일이 실제 저류층 원유와 유사성 및 상관성검증을 위한 예비실험으로 PVT셀을 이용한 CCE실험을 수행하여 기포점압력을 측정함으로써 제작된 용해가스오일과 저류층 원유자료를 비교분석하였다(Fig. 2). 압력이 Pb에 도달하면 기포가 나타나고, 이는 압력이 감소함에 따라 점차적으로 더 증가하였다(Fig. 3). 이 시점에서는 기체의 높은 압축성으로 인해 오일에서 용해가스가 급격히 방출되기 때문에 셀내부의 부피가 급격히 증가하게 된다(Fig. 4). 이를 이용하여 Pb을 측정하였으며 결과의 신뢰성을 높이기 위해 2회에 걸쳐 반복 측정하였다.
실험결과 온도 68.8°C일 때 Pb값은 1,075 psi로 측정되었으며(Fig. 4), 이 결과는 공인기관인 LEMIGAS의 PVT 결과 값(1,116 psi)과 약 3.8% 차이로 제작한 용해가스오일이 저류층 원유와 유사함을 확인하였다.
계면장력 소멸실험
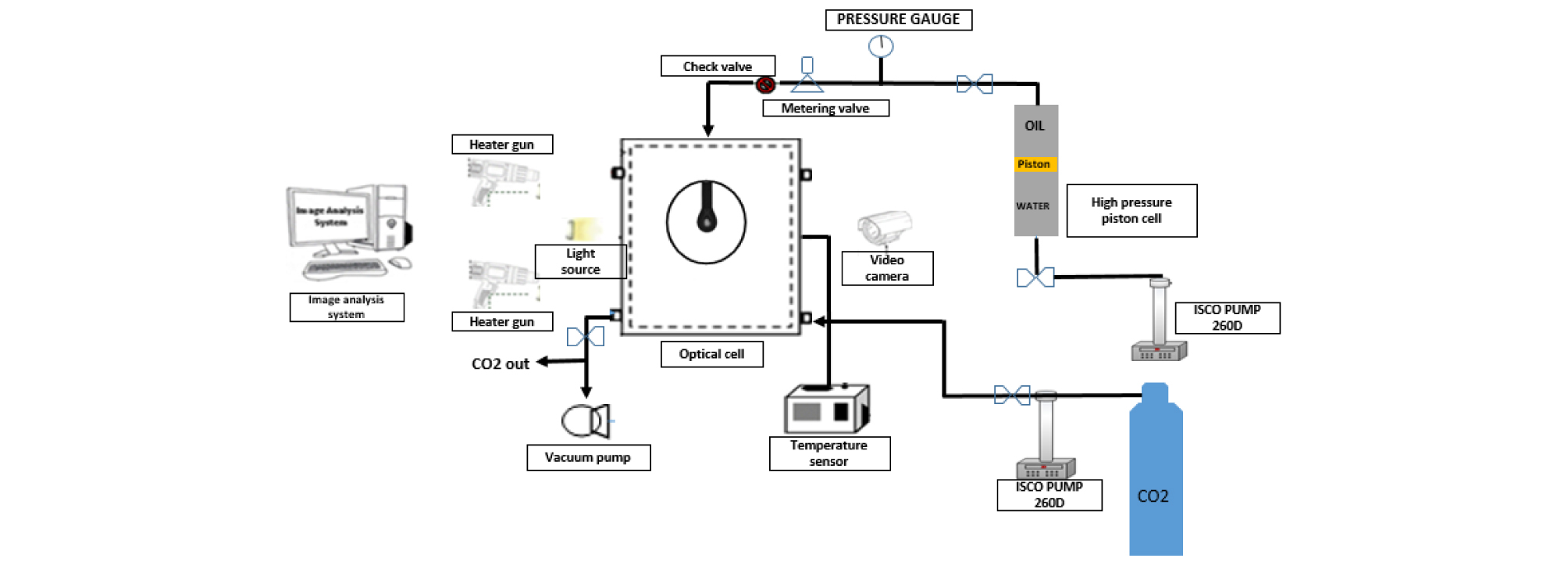
용해가스 및 온도가 혼화상태에 미치는 영향을 확인하기 위해 계면장력 소멸실험을 수행하였다. 두 상의 계면장력을 측정하는 Goniometer장비에 외부관찰이 가능한 사파이어셀을 결합하여 실험시스템을 구축하였다(Fig. 5). 사파이어셀 내부는 CO2 가스를 주입함으로써 압력을 조절하며, 온도는 열선총(Heat gun)을 설치하여 온도(40°C, 60°C, 66°C)를 조절하였다. 셀내부의 압력과 온도는 평형기간(20-30분)동안 유지한 뒤, 연결된 피스톤 셀로부터 오일이 사파이어셀 내부바늘 끝으로 이동하게 된다. 이때 계량밸브를 조절하여 바늘끝에 오일방울이 40초에서 60초 동안 안정된 상태를 유지한 뒤, Goniometer를 이용하여 오일방울의 접촉각을 측정하여 계면장력을 계산한다. 계면장력 값의 오차를 줄이기 위해 3회의 반복측정을 시행하였으며, 압력증가에 따라서 감소하는 계면장력 값이 다른 두 직선경사선을 각각 외삽법(extrapolation)을 이용하여 혼화압력을 측정하였다(Nobakht et al., 2008).
결과 및 토의
계면장력 소멸실험 결과
압력증가에 따라 변화하는 계면장력 값을 선형외삽법을 이용하여 오일/CO2 시스템의 혼화상태를 분석하였다. 셀 내부의 압력이 증가됨에 따라 오일상으로 CO2가스가 침투용해되고 오일상에서 기체상으로 탄화수소성분의 기화가 발생하게 된다. 이 물리적 현상에 의해 계면장력의 값이 지속적으로 감소하며(Zick, 1986), 오일상과 기체상의 물질이동 상호작용은 두 상의 분자간 힘이 균형을 이룰 때까지 지속된다(Danesh, 1998).
본 연구는 외삽법을 이용하여 첫 번째 기울기에서 MMP를 얻었으며 두 번째 기울기에서 FCMP를 측정하였다(Rao et al., 2003). 첫 번째 기울기의 감소는 오일상으로 CO2용해와 오일과 CO2의 경계면에 머무는 경질탄화수소 성분추출에서 비롯되며, 두 번째 기울기는 잔여 중질탄화수소에 의한 오일성분조성 변화에 따라 형성된다(Dong et al., 2001). 이를 바탕으로 본 연구는 용해가스와 온도가 용해가스오일/CO2 혼화상태에 미치는 영향을 분석하였다.
용해가스에 따른 영향
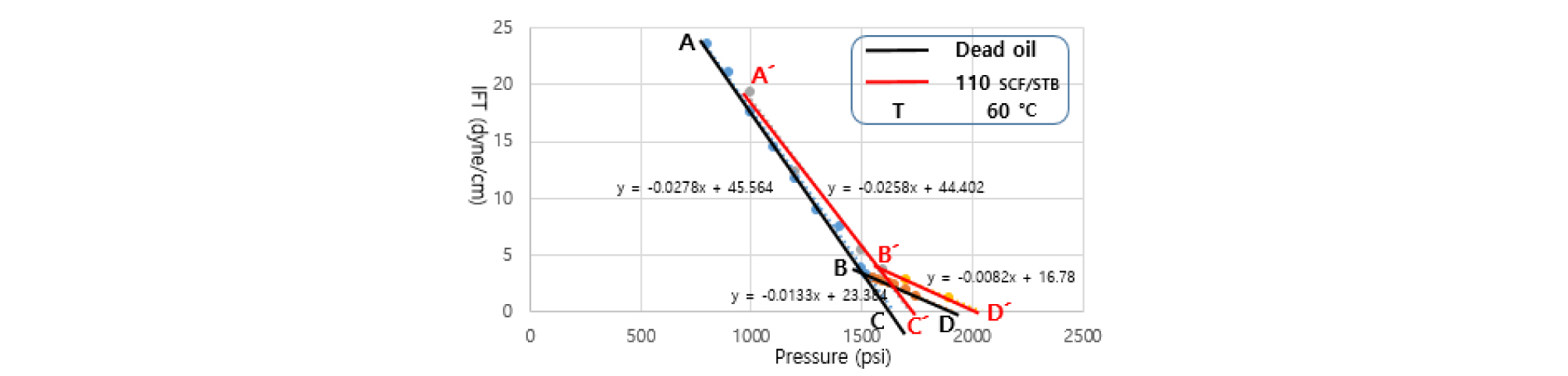
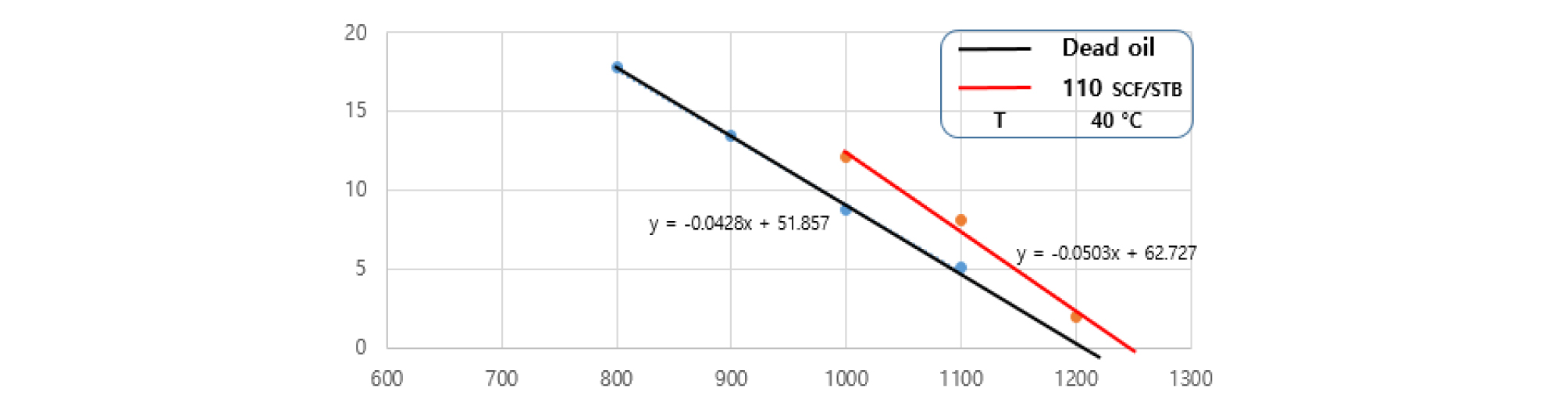
용해가스오일(110, 270 SCF/STB), 무용해가스오일/CO2 두 시스템의 비교를 통해 용해가스가 혼화상태에 미치는 영향을 분석하였다. 무용해가스오일/CO2 시스템의 경우 초기압력의 계면장력 값인 A지점에서부터 압력이 증가함에 따라 계면장력이 점차적으로 감소한다(Fig. 6). B지점을 기점으로 오일조성의 변화로 인해 기울기가 변화되며 계면장력이 완만한 감소추세를 보여준다. B지점은 Near MMP(준 최소혼화압력)를 나타내며 첫 번째 기울기를 외삽법을 이용해서 C지점인 MMP를 측정하였다.
첫 번째 기울기는 용해가스오일이 CO2와 접촉하면서 CO2 용해 및 오일 내의 경질탄화수소 성분이 CO2 상으로 추출되어 계면장력이 감소하는 과정을 그래프를 통해 나타낸 것이다. B지점 이후부터인 두 번째 기울기는 경질탄화수소 성분추출 후, 잔여 중질탄화수소 성분이 CO2 상으로 추출과정을 보여주는 것이며 이를 외삽법을 이용하여 완전한 혼화상태인 FCMP(D지점)값을 구하였다.
용해가스오일/CO2 시스템에 경우 메탄가스가 무용해가스오일에 용해되어있기 때문에, 오일로의 CO2 용해는 쉽게 일어나지 않는다. 이것이 용해가스오일에서의 CO2의 용해도가 무용해가스오일의 경우보다 더 낮은 이유이다. 그러므로 용해가스오일–CO2의 계면장력은 무용해가스오일/CO2 시스템보다 더 크게 나타난다.
60°C에서의 용해가스오일/CO2 시스템에서 측정된 MMP(1,721 psi, C)와 FCMP(2,046 psi, D)는 무용해가스오일/CO2 시스템의 경우(1,639 psi(C/), 1,915 psi(D/) 보다 크게 나타났다. Table 2에서 GOR 110 SCF/STB의 첫 번째 기울기(-0.023)는 무용해가스오일의 기울기(-0.028)와 비교하여 약간의 감소형태를 보였으며 용해가스의 양을 110 SCF/STB로 증가시켰을 때 FCMP 값은 크게 증가하지 않았다(Table 3).
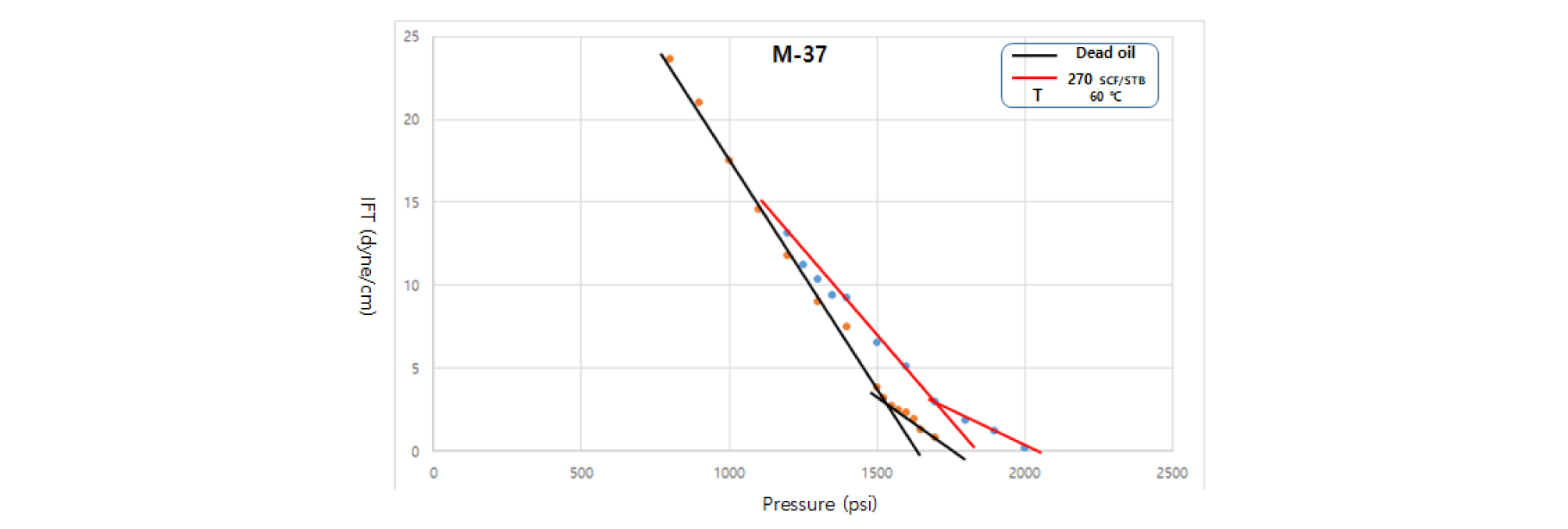
GOR 270 SCF/STB의 경우 첫 번째 기울기(-0.019)가 무용해가스오일의 기울기(-0.028)와 비교하여 크게 감소했다(Fig. 7). 오일 내의 많은 양의 용해가스는 결과적으로 CO2의 오일에 대한 용해도를 감소시키고 MMP에 도달하기 위해서는 높은 압력을 필요로 한다는 것을 보여준다. 용해가스양의 증가에 따른 FCMP 값은 작은 폭으로 증가함을 알 수 있다(Table 4).
Table 2. Measured slopes at each condition
Table 3. Result of miscibility condition at 60°C, Dead oil vs GOR 110 SCF/STB
| T = 60°C | M-37 (Dead oil) | M-37 (110 SCF/STB) | △P |
| MMP (psi) | 1,639 | 1,721 | 82 |
| FCMP (psi) | 1,915 | 2,046 | 131 |
| Difference | 49 | ||
Table 4. Result of miscibility condition at 60°C, Dead oil vs GOR 270 SCF/STB
| T = 60°C | M-37 (Dead oil) | M-37 (270 SCF/STB) | △P |
| MMP (psi) | 1,639 | 1,853 | 214 |
| FCMP (psi) | 1,915 | 2,013 | 98 |
| Difference | 116 | ||
온도의 영향
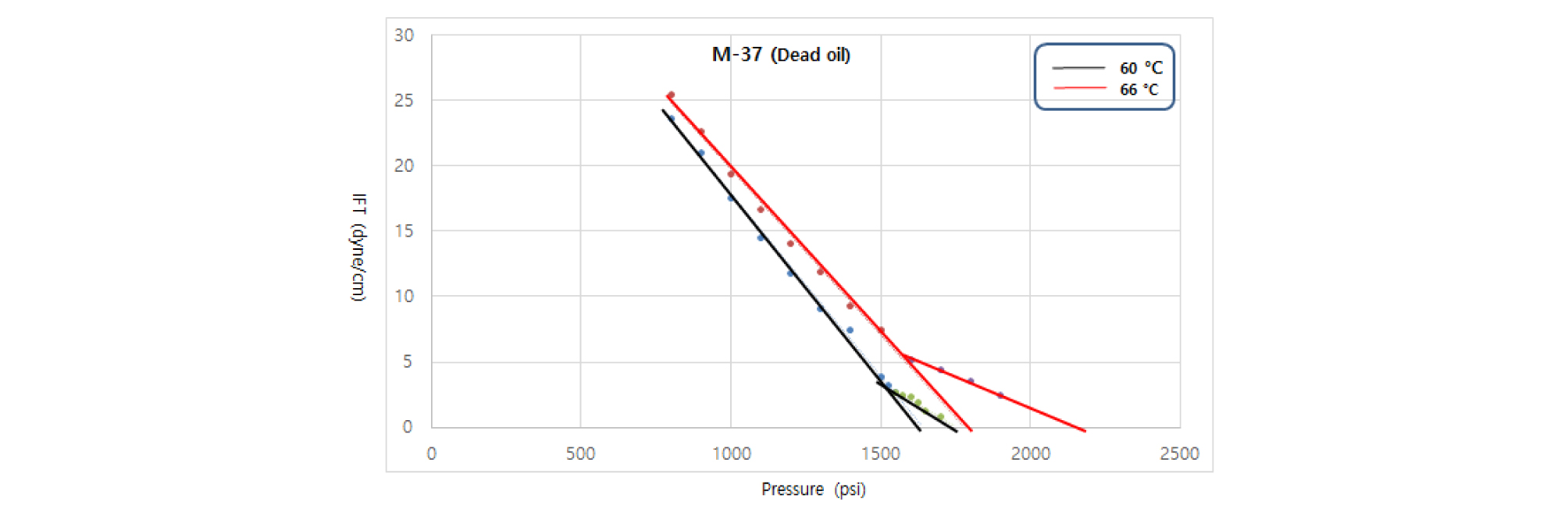
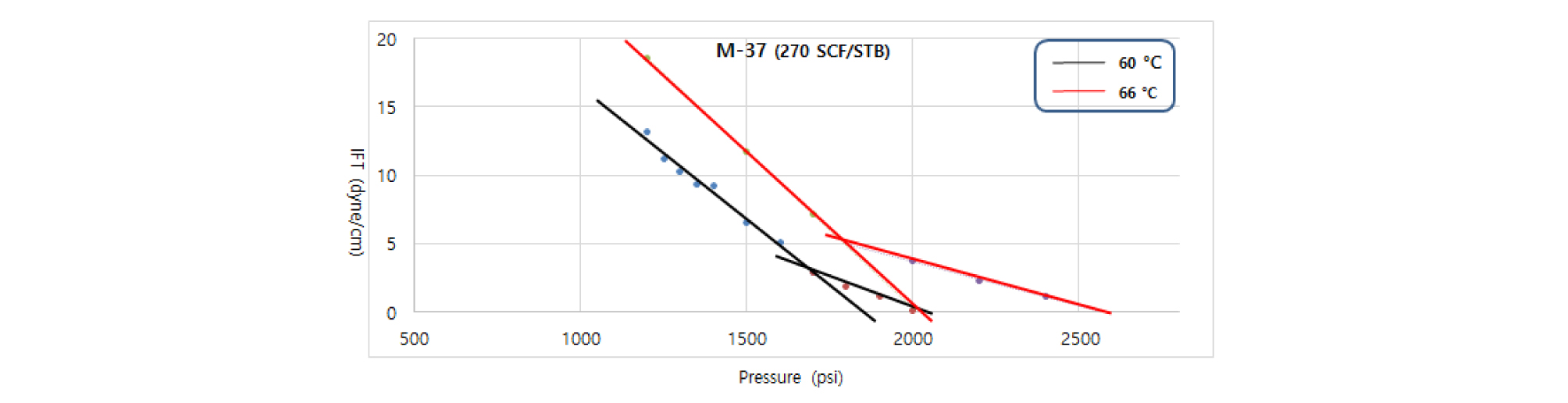
온도가 증가하면 무용해가스오일과 용해가스오일 (110, 270 SCF/STB)/CO2 두 시스템 모두 혼화압력이 증가한다(Figs. 8, 9, 10). 혼화상태에 대한 온도의 영향은 용해가스오일 내에 용해가스의 양에 상관없이 두 번째 기울기의 완만한 감소와 함께 FCMP가 급격히 증가한다는 점에서 용해가스에 의한 영향과는 다른 양상을 보인다. Figs. 10과 11은 FCMP 값의 급격한 증가양상을 보여주고 있으며, 66°C 온도조건에서는 60°C 조건보다 높은 온도의 영향으로 CO2의 용해도를 더 낮추기 때문에 압력증가에 따라 계면장력 값은 천천히 감소하게 된다.
CO2 용해도가 더 낮은 조건에서는 오일 상과 CO2 상 사이의 밀도차이가 더 커지기 때문에 혼화상태에 도달하기 위해서는 보다 높은 압력이 필요하다. 온도향상에 따른 FCMP의 증가는 무용해가스오일과 용해가스오일/CO2 두 시스템 모두 MMP의 증가보다도 훨씬 큰 폭으로 나타난다(Tables 5, 6). Fig. 8에서 무용해가스오일/CO2 시스템인 경우, 60°C일 때 두 번째 기울기(-0.013)는 66°C(-0.009)일 때와 비교하여 온도를 증가시켰을 때 기울기가 다소 큰 폭으로 감소하는 형태를 보인다(Table 4). 40°C에서는 기울기 변화 없이 하나의 선형으로 나타냄을 관찰하였으며, 이는 상대적으로 낮은 온도조건에서는 높은 온도조건에서에 비해 CO2 용해도가 크고 오일 상과 CO2 상 사이의 원활한 물질상호작용이 일어남으로써 두 번째 기울기의 발생 없이 혼화상태로 원만하게 변화하기 때문으로 분석하였다.
Table 5. Comparison of Miscibility condition at Dead oil, 60°C vs 66°C
| 0 SCF/STB (Dead oil) | 60°C | 66°C | △P |
| MMP (psi) | 1,639 | 1,780 | 141 |
| FCMP (psi) | 1,758 | 2,186 | 428 |
| Difference | 287 | ||
Table 6. Comparison of Miscibility condition at 270 SCF/STB, 60°C vs 66°C
| 270 SCF/STB | 60°C | 66°C | △P |
| MMP (psi) | 1,853 | 2,011 | 153 |
| FCMP (psi) | 2,013 | 2,698 | 685 |
| Difference | 527 | ||
용해 가스와 온도의 영향 분석
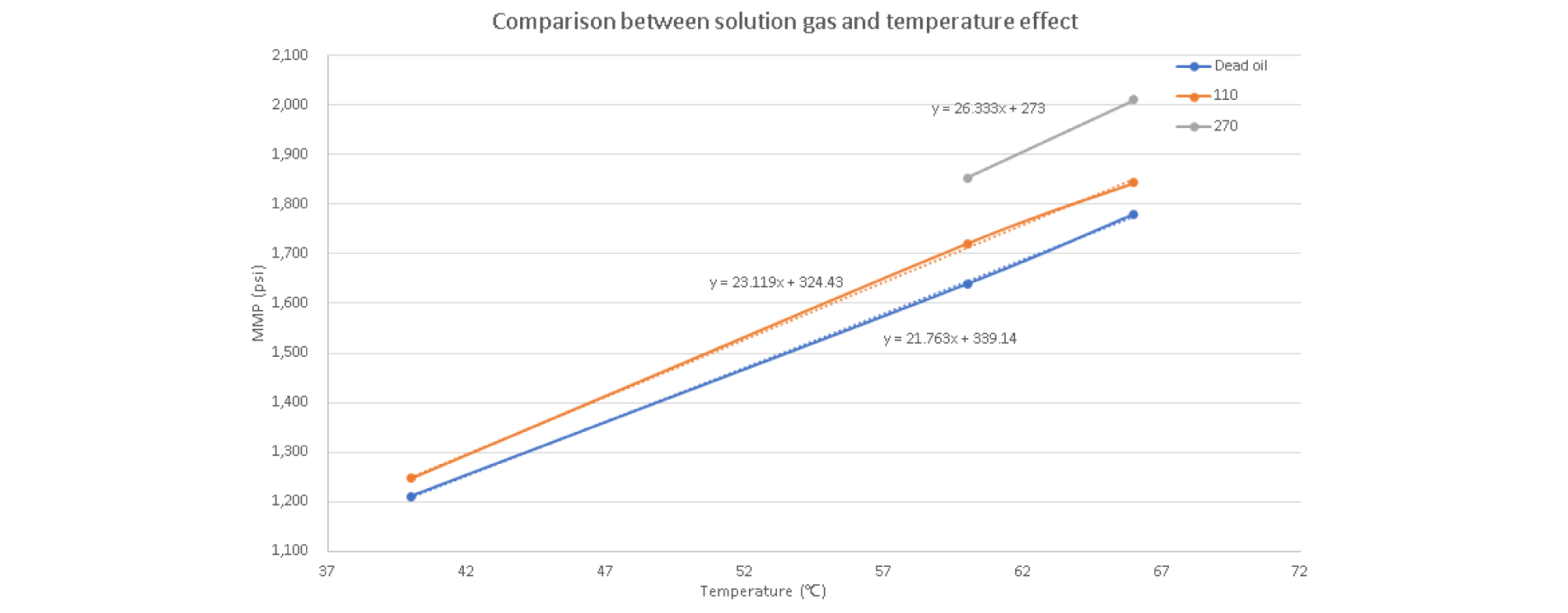
실험결과 각각의 온도조건(40°C, 60°C, 66°C)에 따른 무용해가스오일과 용해가스오일(110, 270 SCF/STB)/CO2 두 시스템 사이의 MMP 변화를 측정하여 표(Table 7)와 그래프로 나타내었다. 각각의 조건에서 기울기를 확인해 보면 오일의 용해가스비가 커질수록 동일한 온도조건에서 더 많은 MMP 상승을 보여주고 있다.
온도가 40°C에서 60°C로 높아짐에 따라 무용해가스오일과 용해가스오일(110 SCF/STB)/CO2 두 시스템 모두 MMP가 큰 폭으로 증가하게 된다. 상대적으로 낮은 온도차이인 60°C와 66°C 사이의 MMP는 낮은 폭으로 증가하며, GOR 증가에 따른 MMP 향상 비율은 온도가 40°C일 경우 60°C 및 66°C일 때 보다 더 낮음을 알 수 있다.
인도네시아 X유전의 평균 저류층 온도인 60°C기준으로 온도가 1°C 상승할 때 MMP는 무용해가스오일은 21.73 psi(1.32%), 용해가스 110 SCF/STB은 23.12 psi(1.35%), 용해가스 270 SCF/STB은 26.33 psi(1.42%) 증가됨을 확인하였다(Fig. 11).
Table 7. Miscibility condition results
| GOR (SCF/STB) | Dead oil | 110 | 270 | |||
| Temperature (°C) | MMP (psi) | FCMP (psi) | MMP (psi) | FCMP (psi) | MMP (psi) | FCMP (psi) |
| 40 | 1,211 | - | 1,247 | - | - | - |
| 60 | 1,639 | 1,915 | 1,721 | 2,046 | 1,853 | 2,013 |
| 66 | 1,780 | 2,186 | 1,843 | 2,207 | 2,011 | 2,698 |
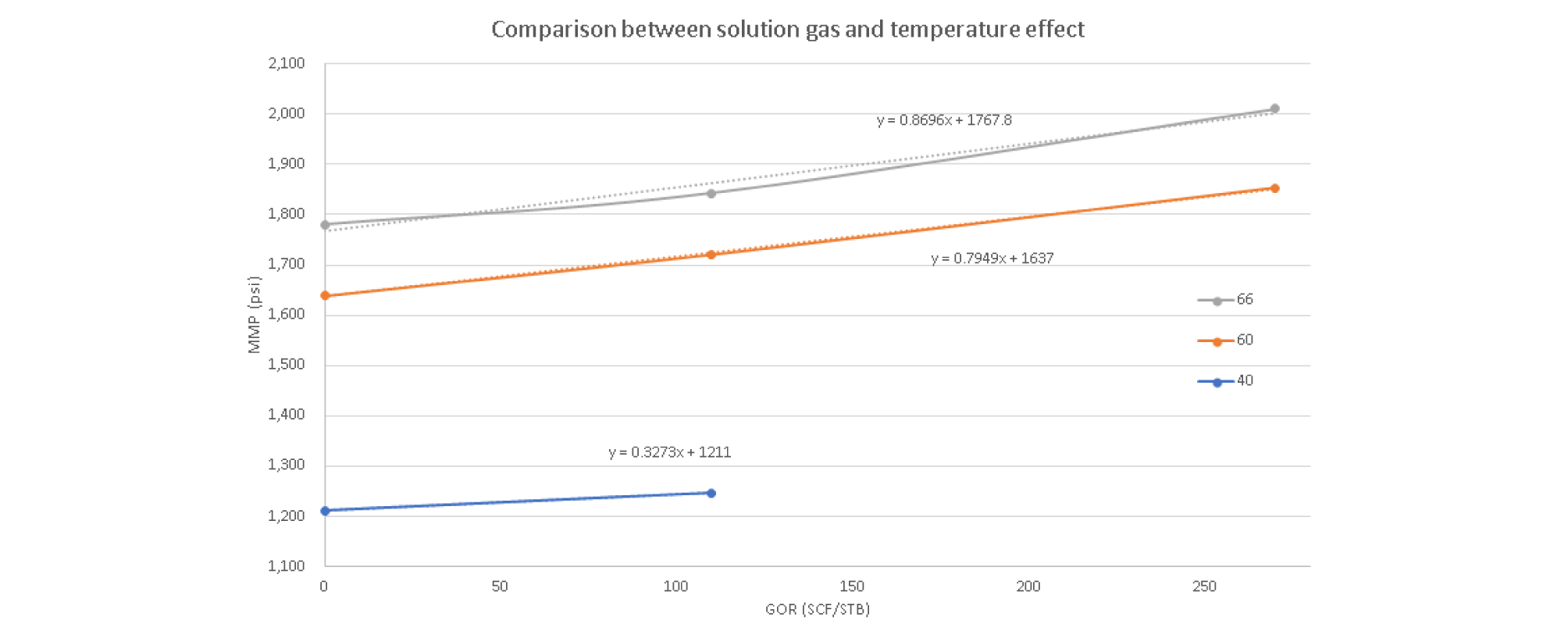
MMP에 대한 용해가스의 영향을 분석하면 오일에 용해가스가 10 SCF/STB이 추가될 경우 40°C에서는 3.273 psi(0.26%), 60°C에서는 7.949 psi(0.46%), 66°C에서는 8.696 psi(0.47%) 증가됨을 확인하였다(Fig. 12). 이는 온도의 영향과 용해가스의 영향이 복합적으로 작용함으로써 오일/CO2의 혼화상태로 가기위한 물질상호교환이 어려워짐으로써 MMP의 상승량이 더 높은 것으로 추측된다.
결론
오일과 CO2의 혼화상태에 용해가스와 온도가 미치는 영향을 조사하기 위해 실험을 수행하였다. 용해가스오일 제작을 위해 실험실에서 구축한 용해가스오일 제작장치를 이용하였으며, 용해가스오일과 원유의 유사성을 확인하기 위해 PVT Cell을 이용한 CCE test를 수행하였다. 용해가스오일의 Pb은 1,075 psi로 공인기관인 LEMIGAS에서 측정한 원유의 Pb은 1,116 psi로 두 오일의 유사성을 확인하였다.
계면장력 소멸방법을 이용하여 용해가스오일/CO2의 계면장력이 온도 및 용해가스의 함유량에 따라 변화하는 양상을 확인하였다. 사파이어 셀 내부 압력이 증가함에 따라 계면장력이 감소되며, 이 기울기는 2개의 다른 선형기울기를 보여주었다. 2개의 다른 기울기 변화를 철저히 분석하여 MCMP와 FCMP의 차별성을 그래프에서 관찰분석하였다. 이는 우선 경질탄화수소 성분이 우선 반응이 일어나 빠르게 계면장력이 감소하였으며, 이후 잔여 중질탄화수소 성분의 반응으로 인해 2개의 다른 기울기가 발생하였다.
오일 내에 메탄가스가 용해되면 CO2의 오일에 대한 용해도가 감소하므로 용해가스오일/CO2 시스템의 MMP 및 FCMP는 무용해가스오일/CO2 시스템의 경우보다 높게 측정되었다. 오일 내 용해가스의 양이 증가에 따라 혼화압력(MMP 및 FCMP) 증가가 발생하였지만 적은 영향을 미친다.
온도가 증가함에 따라 오일에 대한 CO2의 용해도는 감소하고 혼화상태에 도달하기 위해 더 높은 압력이 필요하였으며, 온도가 증가함에 따라 FCMP의 증가는 MMP의 증가보다 훨씬 더 큰 폭으로 발생하였다.
실험 결과, 온도의 영향과 용해가스의 영향을 동시에 분석하여 높은 온도조건에서 용해가스의 양의 증가할수록 혼화압력 상승량이 높다는 것을 확인하였으며, 온도가 1°C 상승할 때 MMP는 무용해가스오일은 21.73 psi(1.32%), 용해가스 110 SCF/STB은 23.12 psi(1.35%), 용해가스 270 SCF/STB은 26.33 psi(1.42%) 증가됨을 확인하였다. 그리고 오일에 용해가스가 10 SCF/STB이 추가될 경우 40°C에서는 3.273 psi(0.26%), 60°C에서는 7.949 psi(0.46%), 66°C에서는 8.696 psi(0.47%) 증가됨을 확인하였다.
본 논문의 목적은 CO2 혼화/비혼화 주입공법을 이용한 오일회수증진의 필수적인 혼화압력 측정을 효율적으로 수행하기 위한 연구이며, 정확한 혼화압력 측정으로부터 CO2-EOR 공법의 설계결과가 유도된다. 측정된 MMP압력을 이용하여 실제 현장 CO2 주입 오일 회수증진 공법 설계를 수행하고 향후 집행의 가이드라인을 제공함으로써 성공적인 오일회수증진에 기여할 수 있다.