서 론
연구방법
와룡산업 SAPS조 현장 조사
컬럼 실험 재료
현장 컬럼 실험
시료채취 및 수질 분석
연구결과
기 설치된 와룡산업 SAPS조의 수질 평가
석회석 첨가에 따른 컬럼별 수질 비교
SAPS조의 버섯퇴비에서 Al 및 Fe 거동 모델
결 론
서 론
전세계적으로 오염부하가 작은 광산배수는 보통 자연정화방식으로 처리하고 있다. 광산배수가 순 알칼리수면 산화 침전조와 호기성 소택지 공정으로 처리할 수 있다. 그러나 순 산성수이면 산화 침전조 앞에 알칼리 공급조(SAPS: Successive Alkalinity Producing System)조를 설치하여 먼저 산도를 제거하고 산화 침전조와 호기성 소택지를 배치한다(Younger et al., 2002: Skousen and Ziemkiewicz, 2005). SAPS조는 깊이가 3 m 전후인 저수조 형태로 하부부터 상부로 가면서 석회석 층, 유기물 층, 수층으로 구분된다. SAPS조를 구성하는 유기물 층은 흔히 버섯퇴비를 사용하며 통상적으로 폐상퇴비라고 부르기도 한다. 버섯퇴비는 황산염환원균(SRB)의 서식처로 유기 탄소 공급원의 기능을 한다(Cheong et al., 2010). 또한 퇴비층은 용존 산소(DO)를 감소시키고 환원환경을 조성하여 하부의 석회석이 산화철 등 물질로부터 피복되는 것을 억제해 준다. 퇴비층에서는 수질에 따라 때때로 황산염 환원작용이 발생하여 철 황화물이 침전할 수 있고 석회석 층에서는 알칼리도를 공급하는 역할을 한다(Ziemkiewicz et al., 2003). SAPS조 방류수는 2가철이 존재하므로 후단에 산화 침전조를 설치하여 철 수산화물로 침전시켜 제거한다.
국내의 경우 약 30개소 이상에서 자연정화시설이 시공되어 운영되고 있다. 정화시설의 운전 기간이 길어지면서 일부 SAPS조의 정화 효율이 저하되고 SAPS조 경계 둑 위로 월수 현상이 발생되고 있다. AMD를 처리하는 강원도 정동진의 와룡산업이 대표적인 사례이다(MIRECO, 2007). SAPS조의 기능 저하를 이해하기 위한 수단으로 현장의 유입수를 차단하고 내부를 굴착해서 확인하는 방법이 있으나 비용이 많이 들고 기질물질들이 섞이기 때문에 쉬운 작업이 아니다.
Watzlaf(1997)와 Rose(2004)는 SAPS조 기능을 저하시키는 요인을 광산배수의 Al 혹은 Fe3+가 기질물질 주변에 침전하는 것이라 지적했다. 또한 Rose and Dietz(2002)는 SAPS조의 알칼리도가 7~686 mg/L CaCO3로 다양하다는 점을 들면서 SAPS조의 중화기능이 동일하지 않음을 보고했다. 또한 알칼리 발생이 우수했던 SAPS조들은 유기물 층에 석회석을 첨가했다는 공통점을 확인했다. 그러나 유기물 대비 석회석의 충전량, 석회석의 입도 등에 대한 세부적인 정보는 제시하지 않았다. SAPS조에 사용되는 유기물은 보통 퇴비류, 우분 등 농업 부산물을 사용한다. Rose(2004)가 연구한 SAPS조 기질물질은 미국에서 가용하는 재료이므로 국내의 유기물과 다르다. 따라서 국내에서 사용중인 버섯퇴비에 대한 중화성능과 석회석 혼용시 수질 변화에 대한 평가가 필요할 것이다.
본 연구에서는 월수현상이 발생하는 강원도 강릉의 와룡산업 SAPS조의 수질 특성을 평가하였다. 그 문제의 원인을 파악하기 위해서 강원도 금진항 인근의 와룡 7갱 부근에서 컬럼 실험을 수행하여 우리나라에서 일반적으로 사용하는 SAPS조의 기질물질에 석회석을 첨가했을 때 그 기능을 평가하였다.
연구방법
와룡산업 SAPS조 현장 조사
현장 컬럼 실험에 앞서 강원도 강릉시 소재의 와룡산업 SAPS조를 대상으로 수질 분석을 실시했다. SAPS조의 유입수와 방류수에 대해서 pH와 Eh를 측정하고 실내에서 양이온 및 음이온 시료를 분석해서 수질 특성을 평가했다. 와룡산업 현장은 실험할 공간이 부족해서 유사한 광산배수 수질을 갖는 인접한 와룡 7갱에서 수행되었다.
컬럼 실험 재료
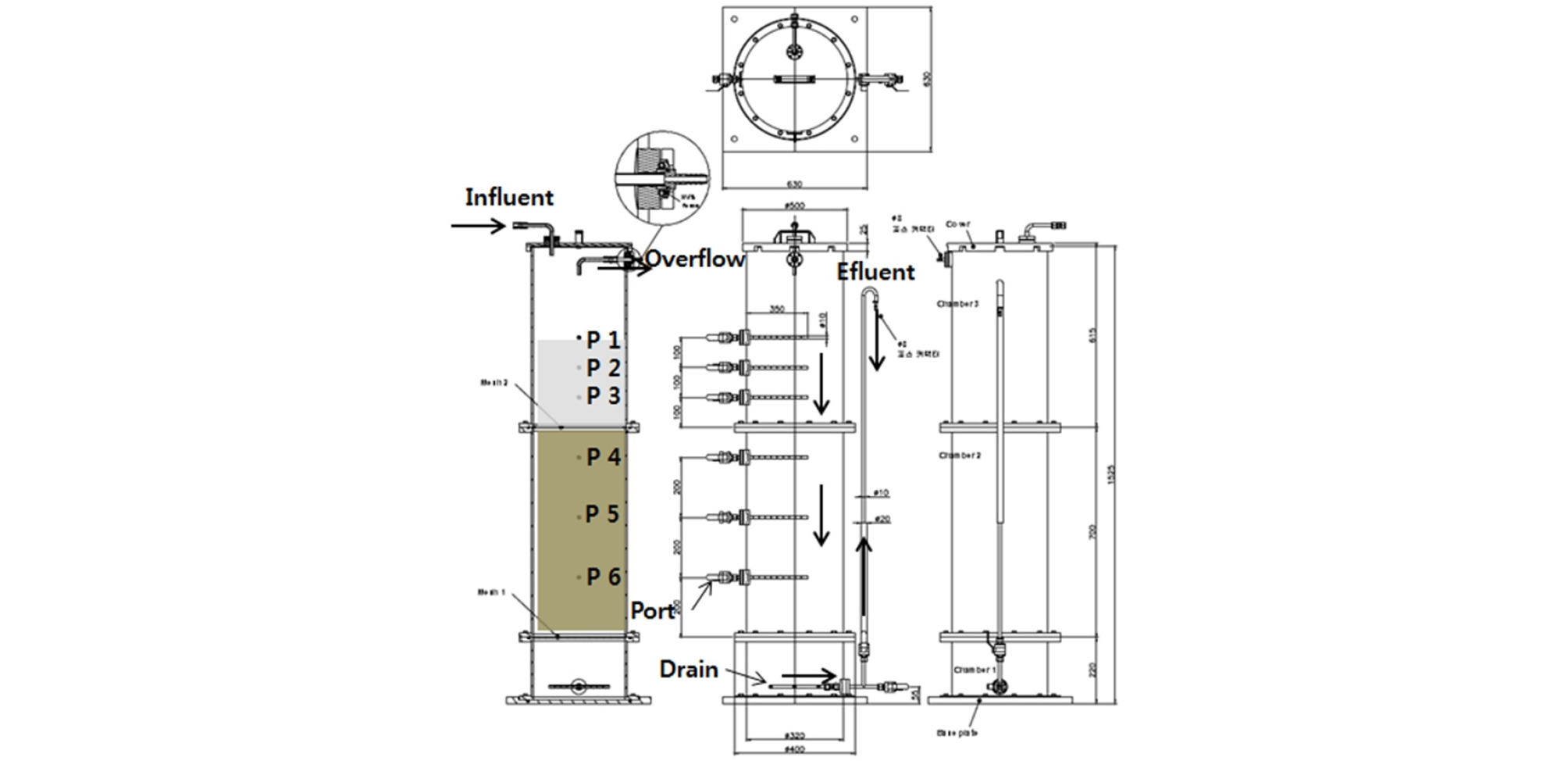
충청남도 부여의 양송이 재배 농가에서 버섯퇴비를 구하였다. 버섯퇴비에는 흙이 혼재하여 실험 과정에서 투수성을 감소시킬 우려가 예상되어 이를 털어내고 유기물만을 선별해서 실험에 사용했다. 자갈 크기 석회석은 3~5 cm 크기로 컬럼 하단부에 적치하는데 사용하였고 모래 크기 석회석(1~2.36 mm)은 퇴비의 혼합용으로 사용했다. 석회석은 단양 지역 석회석 광산에서 구입해 사용했다. 버섯퇴비 및 자갈 석회석을 용량을 알고 있는 용기에 넣고 물을 채워 공극률(3회 평균)을 구했으며 각각 66% 및 50%를 나타냈다.
현장 컬럼 실험
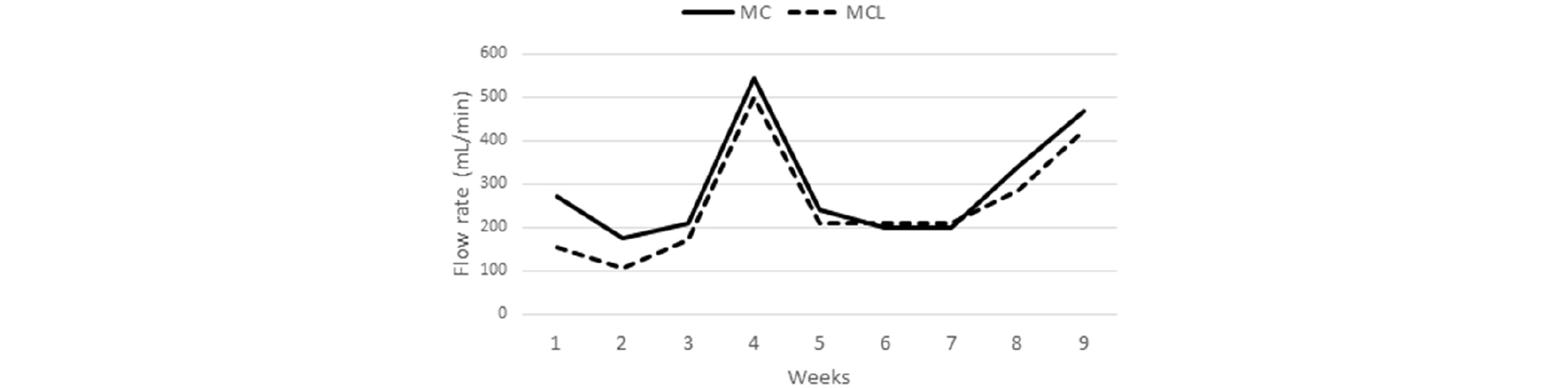
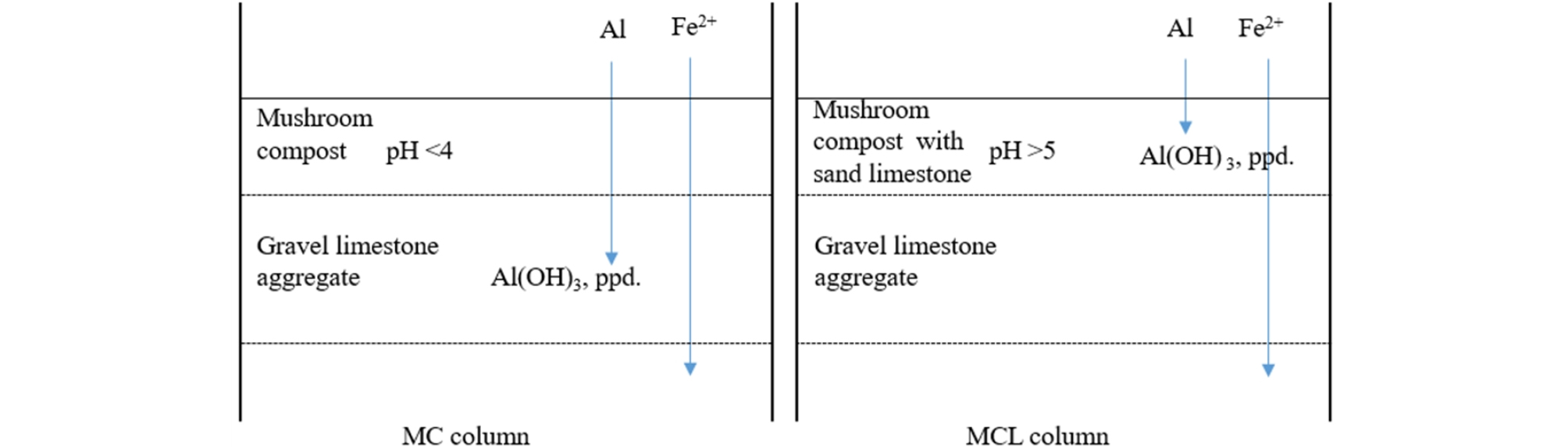
본 연구는 강원도 강릉시에 소재한 와룡 7갱의 광산배수를 대상으로 수행하였다. 예비 연구로서 현장의 AMD 500 mL를 비이커에 넣고 100 rpm의 속도로 교반하면서 1N NaOH의 중화제를 주입하였다. 각 pH에서 물을 채수하고 Fe, Al 및 Mn 등을 분석하여 pH 변화에 따른 농도 추세를 확인하였다. 와룡 7갱 부근 하천에 컬럼 실험 장치를 설치했다. MC 및 MCL 컬럼 2종류를 준비했고 아크릴 재질이었다. SAPS조를 모사한 것으로 단면적이 0.07 m2, 높이가 1.5 m 규모였다(Fig. 1). 컬럼 하단에 두께 0.7 m의 자갈 석회석층을 먼저 채운 후 그 위에 두께 0.3 m의 버섯퇴비층을 구성했다. MC 컬럼에는 버섯퇴비만을 넣고 MCL 컬럼에는 모래 석회석과 버섯퇴비를 중량비(1:1)로 혼합해서 충전했다. 퇴비층과 석회석층 내에 시료 채취구를 설치했다. 버섯퇴비층 위로 0.3 m 지점에 배출구를 형성해서 일정 수위를 유지했다. MC 및 MCL 컬럼에 동일한 유입수가 유입되도록 유량 관리를 했으나 차이가 발생했다(Fig. 2). 매 방문 전 후 유량(대략 1주일)을 평균해서 유량으로 했다. MC 및 MCL 컬럼의 수력 부하(= flow/area)는 각각 6.01 및 5.20 m/d 이었다. MC 및 MCL 컬럼에서 명목 체류시간은 각각 2.3 및 2.6 시간이었다.
시료채취 및 수질 분석
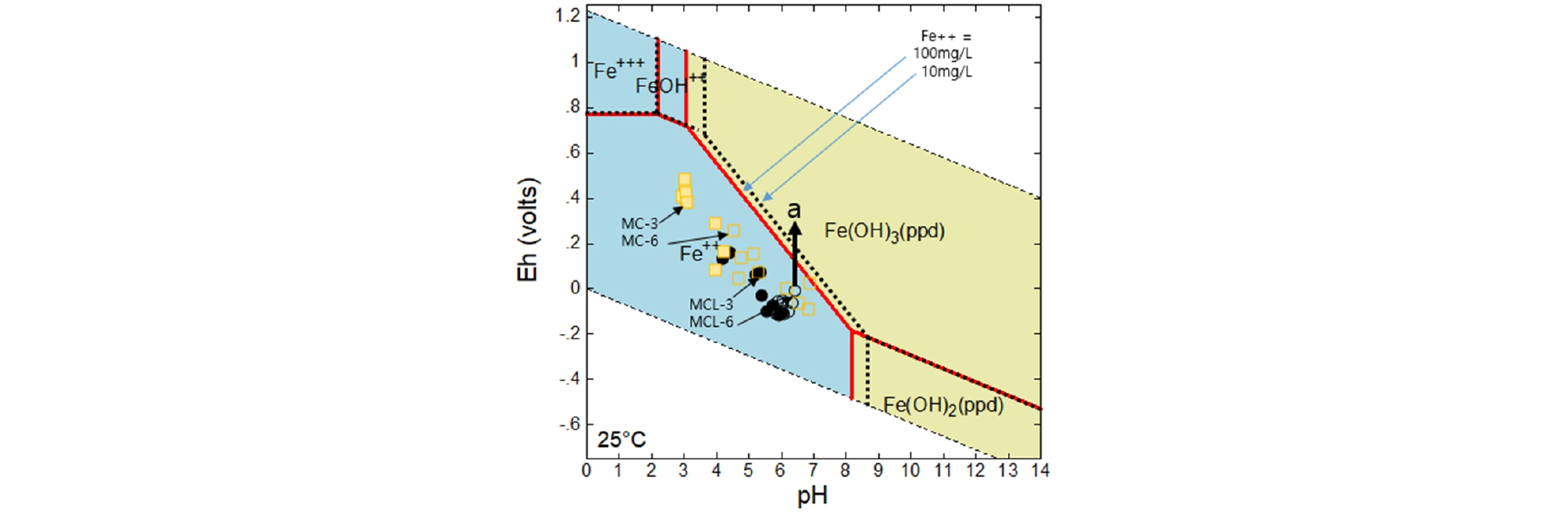
pH, Eh 및 DO는 현장에서 휴대용 수질측정 장비(HQ40d, HACH, USA)로 측정하였다. 알칼리도는 적정키트(digital titrator model AL-DT, HACH, USA)로 측정하였다. 양이온 시료는 현장에서 0.45 µm 필터로 여과하고 농질산을 첨가하여 ICP-AES(Ultima 2C, Horiba-Yuvon, USA)로 분석하였다. 음이온 시료는 동일 방식으로 여과하고 Ion chromatography(881 compact IC Pro, Metrohm, Swiss)으로 분석하였다. 2가철은 DR 5000(HACH, USA)로 분석하였다. The Geochemist’s WorkbenchⓇ (미국)의 Act2 모듈을 이용해서 pH-Eh diagram에서 2가철의 용존 분포를 도출했다. 와룡 7갱의 용존 철의 농도를 고려해서 10 및 100 mg/L에서 용존 2가철과 철산화물의 안정 영역을 도출해서 컬럼 실험 결과 해석에 활용했다. 설정 온도는 25°C조건이었다.
연구결과
기 설치된 와룡산업 SAPS조의 수질 평가
SAPS조의 기능은 알칼리를 발생하여 pH를 증가시키고 Eh를 낮추는 기능을 한다. 알칼리 발생은 SRB에 의하기도 하지만 석회석의 용출과 관계하므로 Ca 성분이 증가한다. SAPS조에서 기대하는 pH 는 6~7 정도이다. 따라서 pH가 증가함으로서 Fe, Al이 제거되나 Mn은 제거되지 않는다. 와룡광산 SAPS조 유입수의 pH 및 Eh는 각각 3.83과 307mV이었고 방류수는 각각 3.25, 330 mV로 큰 변화는 없었다(Table 1). 수질 지표로 볼 때 SAPS조가 제 기능을 못하는 것으로 나타났다. Fe 성분을 제거하였으나 Al과 Mn은 그대로 유출되었다. Fe3+ 및 Fe2+ 는 약 50% 정도가 제거되었는데 철 성분이 제거되면서 pH가 낮아졌다. 망간을 제외한 철, 알루미늄의 침전에 따른 H+가 발생하거나 OH-가 소모되어 pH가 상승하지 못한 것으로 생각되었다. 비록 pH 증가 현상은 없어도 Ca 성분은 33.6 mg/L 증가하여 석회석이 용해되고 있었다(Table 1). 방류수와 유입수의 Ca 농도 차([Ca2+]eff. – [Ca2+]inf)를 밀리 몰(mM) 농도로 환산하고 현장 유량(332 m3/d) 을 곱하면 하루에 28 kg 석회석이 용출되는 것으로 계산되었다(식 1과 2). 이상의 결과로부터 와룡 SAPS조에서 석회석이 소량 용해되고 있으나 pH를 증가시키지 못해 SAPS조의 기능을 제대로 못하고 있음을 알 수 있었다.
| $$\triangle\;\mathrm{Ca}^{2+}(\mathrm{mM})\;=\;{\lbrack\mathrm{Ca}^{2+}\rbrack}_{\mathrm{eff}.}\;–\;{\lbrack\mathrm{Ca}^{2+}\rbrack}_{\inf.}\;=\;0.838$$ | (1) |
| $$84\mathrm g/\mathrm m^3\;\times\;332\mathrm m^3/\mathrm d\;(\mathrm{유량})\;\fallingdotseq\;28\mathrm{kg}/\mathrm d\;$$ | (2) |
Table 1.
Water quality of the influent and effluent of SAPS in Waryong mine (in mg/L, except pH and Eh in mV)
| pH | Eh | DO | Fe3+ | Fe2+ | Al | Mn | Ca | SO42- | |
| Influent | 3.83 | 307 | 1.73 | 33 | 84 | 59.4 | 4.99 | 21.6 | 765 |
| Effluent | 3.25 | 330 | 1.99 | 18 | 37 | 58 | 5.16 | 55.2 | 785 |
석회석 첨가에 따른 컬럼별 수질 비교
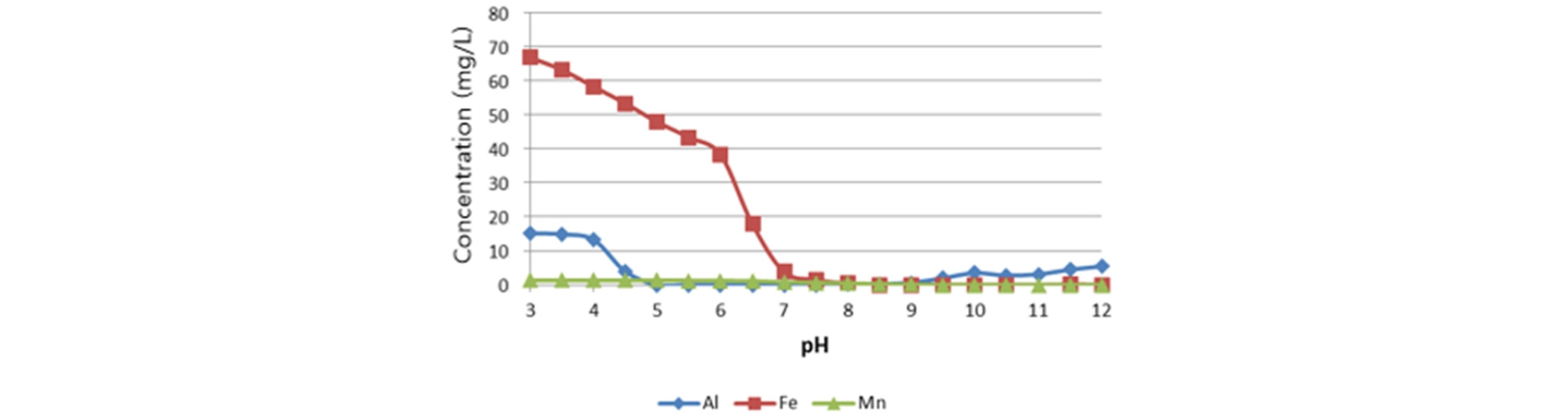
와룡 7갱 컬럼 실험에 앞서 pH 변화에 따른 Fe, Al 및 Mn 성분의 농도 변화를 파악했다(Fig. 3). Al 성분은 pH 5 이전에 대부분 제거되었고 9 이후 재 용출되었다. Fe 성분은 pH 3부터 pH 6 까지 일정하게 감소하다가 그 후부터 급격하게 감소했다. 이들 금속 성분은 수화작용으로 수소이온이 방출되어 알칼리도를 낮춘다(Hallberg and Johnson, 2005)(식 3~7). 한편 Mn의 경우 Fig. 2에서 농도 변화가 구분이 잘 되지 않았으나 pH 8 이후부터 제거되었다. Mn은 무생물, 생물학적으로 빠르게 산화가 되지 않는 성분으로 pH가 7~8 이상에서 제거된다. SAPS조에서 쉽게 제거되지 않는다(Hallberg and Johnson, 2005; Zipper and Skousen, 2010).
| $$Al^{3+}\;+\;3{\mathrm H}_2\mathrm O\;\leftrightarrow\;\mathrm{Al}{(\mathrm{OH})}_3\;+\;3\mathrm H^+$$ | (3) |
| $$\mathrm{Fe}^{3+}\;+\;3{\mathrm H}_2\mathrm O\;\leftrightarrow\;\mathrm{Fe}{(\mathrm{OH})}_3\;+\;3\mathrm H^+$$ | (4) |
| $$\mathrm{Fe}^{2+}\;+\;2{\mathrm H}_2\mathrm O\;\leftrightarrow\;\mathrm{Fe}{(\mathrm{OH})}_2\;+\;2\mathrm H^+$$ | (5) |
| $$4\mathrm{Fe}^{2+}\;+\;10{\mathrm H}_2\mathrm O\;+\;{\mathrm O}_2\;\leftrightarrow\;4\mathrm{Fe}{(\mathrm{OH})}_3\;+\;8\mathrm H^+$$ | (6) |
| $$4\mathrm{Mn}^{2+}\;+\;4{\mathrm H}_2\mathrm O\;+\;2{\mathrm O}_2\;\leftrightarrow\;4{\mathrm{MnO}}_2\;+\;8\mathrm H^+$$ | (7) |
현장 컬럼 실험 결과를 Table 2에 수록했다. MC 컬럼의 유량은 평균 294mL/min 이었다(Fig. 3). 9주 동안 퇴비층의 평균 pH는 3.37이었고 석회석층(MC-6)에서의 pH는 5.64였다. 컬럼 상부부터 철 슬러지가 확인되어 수체에서 바로 철이 감소하는 것을 알 수 있다. Ca 농도는 퇴비 층과 석회석 층을 통과하면서 12.37 → 23.25 → 72.56 mg/L 으로 증가하여 석회석이 용해되었음을 알 수 있었다. 9회 측정한 알칼리도 측정값에 따르면 최대값인 150 mg/L CaCO3을 제외하면 나머지 측정값들이 10 mg/L CaCO3 이하로 낮았다.
Table 2.
Mean water parameter measurements and chemical analysis results (n=9) (units: mg/L, except pH, Eh in mV and Alkalinity)
퇴비층의 주요 역할은 광산배수중의 용존 산소를 소모하고 3가철을 2가철로 환원하는 것이다(Rose, 2007). DO는 퇴비층에서 낮아졌고 Eh는 퇴비층에서(MC-3) 석회석층(MC-6)으로 통과하면서 낮아져 퇴비층은 수질을 좀 더 환원환경으로 변화시켰다. Fig. 4에서 볼 수 있듯이 MC-3에서 보다 MC-6 시료들이 pH 값이 크고 Eh 값은 작아졌다. 그러나 2가철은 계속 용존할 수 있는 산화환원환경에 놓여있었다. 한편 총 Fe 농도는 77.13 → 56.31 → 49.11 mg/L로 변했고 그 중 3가철이 퇴비층과 석회석층에서 침전했다(Fig. 5). Al의 농도는 원수, 퇴비층, 석회석층을 통과하면서 15.96 → 13.44 → 4.70 mg/L로 변하였고 석회석층에서 주로 제거되었다. 석회석층에 알루미늄 침전물이 집중적으로 누적되면서 석회석의 공극을 폐쇄하고 용해를 억제하는 요인으로 작용했다.
MCL 컬럼 퇴비층 및 석회석층의 평균 pH는 각각 5.9와 6.58로 MC 컬럼의 pH 보다 높았다. 동일한 수질의 물이 유입되었으나 MCL 컬럼의 중화성능은 우수했다(Table 2, Fig. 4). Ca 농도는 원수, 퇴비층, 석회석층에서 12.37 →121.58 → 132.15 mg/L로 증가했고 퇴비층에서부터 pH가 증가했다. DO농도는 퇴비 및 석회석 층에서 2 mg/L 수준을 유지했다. Eh는 AMD → 퇴비층 → 석회석층을 거치면서 380.54 → 5.56 → -68.94 mV로 변했다(Table 2). MCL 컬럼의 수환경이 알칼리-환원 환경으로 변해 SAPS조에서 기대하는 수질을 나타냈다. MCL 컬럼에서 Fe 농도가 77.13→ 38.74 → 36.06 mg/L로 변했다. 버섯퇴비층에 3가철이 주로 제거되어 농도 변화가 발생했고 석회석층에서는 주로 2가철이 주로 존재함으로써 pH 용해도에 따라서 그 농도가 좌우되었다(Fig. 4). 중성의 광산배수가 산화환경에 노출되면 쉽게 철을 제거할 수 있다. 컬럼의 방류수를 폭기 등이 갖춰진 침전조 환경에 노출시키면 철 성분의 제거를 기대할 수 있다(Oh, et al., 2014). 컬럼 MCL-6의 수질은 MC-6보다 중성에 가깝고 낮은 Eh 값을 보였다. MC-6의 물이 방류되면 Eh 값은 Fig. 4의 화살표 방향(a)으로 진행함으로서 철은 용존 철 대신 철수산화물로 존재할 것이다. Al 성분은 MC 컬럼과 달리 퇴비층에서 대부분 제거되었다. 버섯퇴비층이 Al이 침전되는 pH 구간으로 변했다. Al 성분이 퇴비층에서 침전되어 MCL의 석회석층 공간과 표면이 깨끗하게 유지되었다(Fig. 5). 석회석이 혼합된 퇴비층에서 3가철 수산화물, 알루미늄 침전물 그리고 철 황화물이 순차적으로 침전하고 2년 동안 막힘 현상도 없었다는 결과를 보고하고 있다(Rose, 2004). Mn, SO4 및 Mg 성분은 MC 컬럼과 같이 그대로 방류되었다.
SAPS조의 버섯퇴비에서 Al 및 Fe 거동 모델
SAPS조에서 유기 기질층 및 석회석층의 pH에 따른 용존 알루미늄과 용존 철의 거동을 모델화하였다(Fig. 6). 실험에 사용된 버섯퇴비는 pH를 중화하는 능력이 없었다. 따라서 광산배수의 Al 성분이 버섯퇴비층을 통과하면서 석회석 층에서 침전하였다. 시간이 경과함에 따라 석회석 층과 층 사이가 알루미늄 침전물로 채워지면서 석회석의 용해작용이 방해되어 중화기능을 상실하였다. 버섯퇴비에 모래 석회석을 첨가하면 Al 성분의 침전이 퇴비층에서 발생하였다. 일종의 Al 여과기 역할을 한 것이다. 따라서 석회석층의 공간이 보존되어 석회석의 용해가 지속적으로 이루어질 수 있다. SAPS조의 성능을 장기간 유지하는 모델이다. 한편 운전기간이 길어지면 MCL 모델도 퇴비층의 투수성 저하로 SAPS조 성능이 저하될 것으로 예상된다. 따라서 AMD를 SAPS 공정으로 처리할 경우 Al 성분이 적은 산성수를 대상으로 하는 것이 적절하다고 사료된다.