서 론
지하환경에서 안정하게 존재하던 황화광물이 광산활동에 의해 산화환경에 노출되어 발생하는 산성광산배수(Acid Mine Drainage, AMD)는 낮은 pH, 높은 철, 알루미늄 및 황산염이온을 갖는 특징을 보인다. AMD는 주변 암석의 이차적인 용해 또는 광종에 따른 특성에 의해 다양한 중금속을 함유하기도 한다. 낮은 pH와 높은 금속농도를 갖는 AMD는 수질악화 및 생태계에 악영향을 미칠 수 있다. 따라서 AMD의 처리를 위해 다양한 기술이 개발되어 적용되고 있다. 국내 AMD에 관한 연구는 연속알칼리공급조(Successive Alkalinity Producing Systems, SAPS)를 중심으로 하는 자연정화시설의 효율 향상을 위한 연구(Ann et al., 2011; Ji et al., 2012; Park et al., 2018), AMD 내 용존 철 제거속도를 향상시키기 위한 방법에 대한 연구(Oh et al., 2014), AMD로부터 금속들을 선택적으로 회수하기 위한 연구(Bok et al., 2017), 회수된 금속의 활용 방안에 관한 연구(Ji et al., 2016), 물리화학적 방법과 Semi-Active 방법에 관한 중화공정의 효율적인 공정 설계 연구(Cheong et al., 2016)나 침전된 슬러지의 탈수공정(Kim et al., 2016)에 관한 연구 등이 진행되었다. 국내 폐광산 AMD 처리 시설은 46개소의 자연정화시설과 8개소의 물리화학처리시설이 운영 중에 있다. 물리화학처리시설 중 2개소는 전기분해에 의한 처리방식을 중심으로 공정이 운영되고 있다. 최근 건설되는 AMD 처리시설은 자연정화 방법과 물리화학 방법의 장점을 혼합한 Semi-Active 시설로 건설되고 있다. 국내 전기분해를 이용한 AMD 처리시설은 강원도 정선군 소재 나전탄광과 함백탄광(자미갱)에서 운영 중에 있는데, 나전탄광 시설의 경우 2003년, 함백탄광(자미갱)의 경우 2007년 부터 가동되고 있다. 나전탄광 처리시설은 5,650 m3/일의 용량으로, 함백탄광(자미갱) 처리시설은 7,200 m3/일의 용량으로 물을 전기분해하여 생성된 수산화기에 의해 용존 금속을 침전시켜 처리하고 있다. 각 시설에서 처리된 최종 방류수는 방류수 수질기준에 적합하게 처리되어 방류되고 있으나, 미량의 철분으로 인한 방류구 주변 하천 바닥의 적색 피복현상으로 인해 사여과조를 설치하여 운영하고 있다. 2017년 나전탄광 처리시설의 사여과조의 여과사를 교체하였고, 함백탄광(방제갱) 처리시설의 사여과조는 교체 없이 계속 운영 중에 있다. 사여과조에서 발생된 폐여과사에는 육안 상으로, 망간으로 코팅되어 있는 망간산화물 피복모래(manganese oxide-coated sand, MCS)가 형성된 것을 확인할 수 있다. 이러한 폐여과사 표면의 망간 피복현상은 다른 형태의 수처리시설에서도 발생되고 있으며, 표면특성을 이용하여 흡착제로 활용하기도 한다(Yu et al., 2007; Kan et al., 2013).
일부 AMD 중 용존 망간의 농도가 높게 나타나는 경우가 있다. 망간은 인간과 동물에게 필수원소이나 0.1 mg/L를 초과하는 경우에는 음용수에서 좋지 않은 맛을 유발하고 세탁물에 얼룩이 생기게 할 수 있다(Patil et al., 2016). 고농도의 망간에 노출되어 망간중독이 되면 파킨슨병과 유사한 신경증상 및 정신병적 증상을 발생시킬 수 있다(Kim, 2009). 자연정화시설에서의 망간처리 효율은 철, 알루미늄에 비해 낮은 효율을 보인다(Ryu et al., 2014). 전기분해에 의해서도 망간은 처리효율이 나쁘게 나타난다(Sung et al., 2014). pH를 조절하여 처리하는 경우 pH 8 이상에서 부터 망간의 침전이 가능하고 pH 10 이상이 되어야 80% 이상의 제거가 가능하다(An et al., 2010; Seo et al., 2014). 이러한 경우 pH를 방류수 기준에 맞도록 다시 낮추어야 하는 추가 공정이 필요하게 된다. 이러한 이유로 기존의 처리시설에서 제거가 거의 되지 않는 것으로 조사된 바 있다(MIRECO, 2008).
침전에 의한 용존 망간의 제거는 pH 10이상이 되어야 가능하고 실제 처리 후 망간이 잔존하는 문제가 발생할 수 있어 보다 pH 가 낮은 6~9 범위에서 망간산화물을 활용한 망간 흡착 제어 방안이 유효하다고 판단된다(Tobiason et al., 2016). 망간산화물에 의한 망간 흡착 선행 연구들이 있지만 자연적으로 생성되었을 것으로 추정되는 MCS 에 관한 연구는 수행되지 않았고 망간산화물이 생성되었다면 망간 흡착이 가능할 것으로 판단된다. 따라서, MCS의 표면에 코팅된 망간산화물은 용존 망간의 흡착이 가능하여 일부 처리시설에서 처리되지 않은 망간의 제거에 활용할 수 있을 것으로 기대된다.
본 연구에서는 AMD 전기분해 처리시설의 사여과조에서 생성된 MCS를 이용하여 폐수 중의 용존 망간을 제거하기 위한 기초연구를 수행하였다.
연구방법
망간산화물피복모래(MCS)
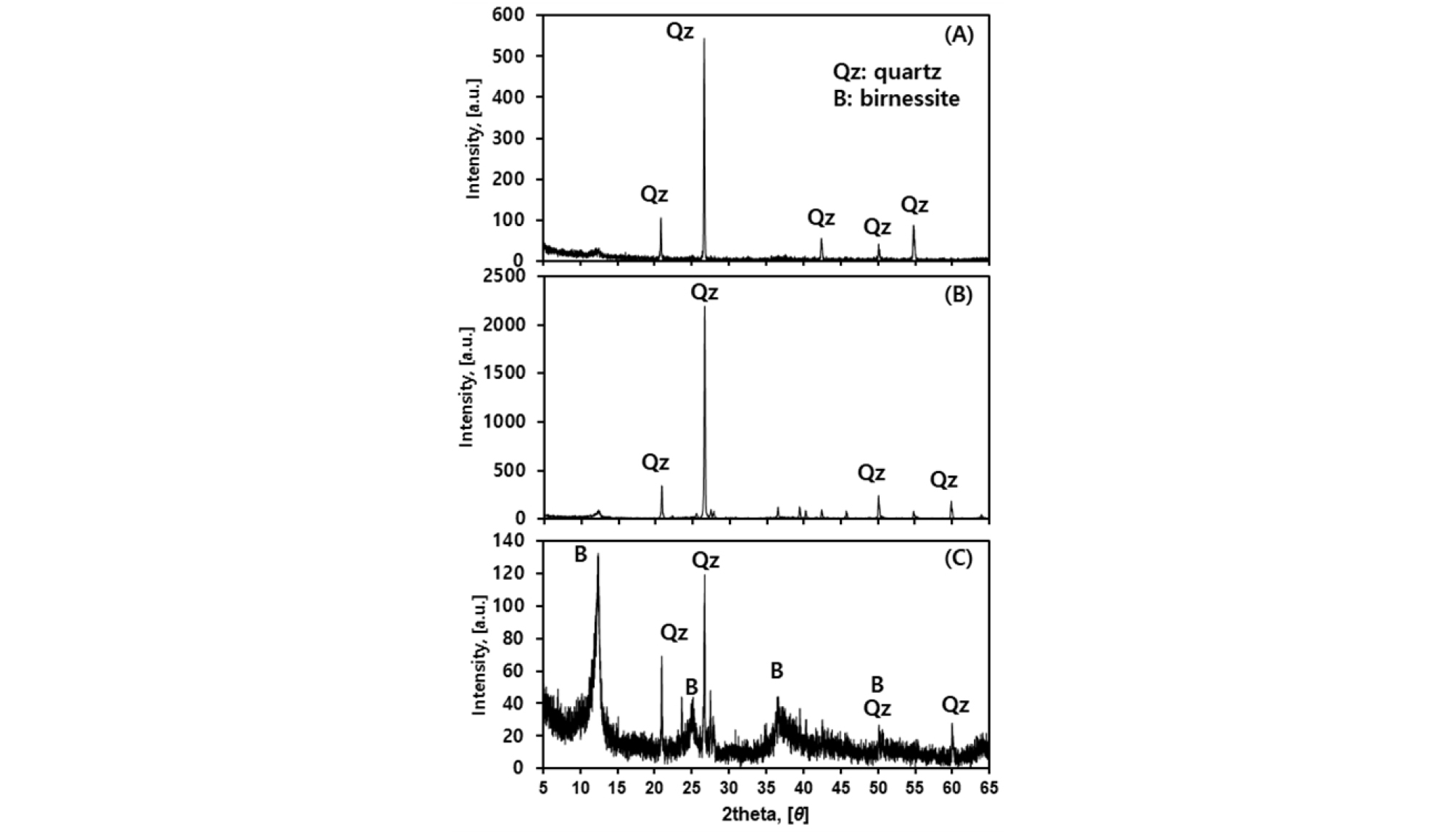
본 연구에서 사용된 MCS는 강원도 정선군 소재 함백탄광(방제갱) 처리시설 내 사여과조의 여과사(2018년 8월 채취)이다. MCS는 증류수로 수차례 세척한 후 건조로(FO- 600M, JIEO TECH, 한국)를 사용하여 70°C 조건에서 24 시간 건조 후 사용하였다. MCS의 광물학적 특성을 보기 위해 한국지질자원연구원의 X-선회절분석기(X-ray diffraction (XRD), X’pert MPD, Philips, Amsterdam, The Netherlands)를 이용하여 분석하였다. XRD 분석은 건조한 MCS와 이를 분쇄한 것, 그리고 표면의 피복 부분만을 분리한 것 등 총 세 가지로 구분하여 진행하였다. 분석 2θ의 범위는 3~65° (step size(2θ) 0.01° 간격, 0.25 s/step, scan speed 0.04s)로 하였고 Cu-Kα 주사선을 이용하였다.
흡착 실험
회분식 실험을 위해 MnSO4·5H2O(동화화학주식회사, 대한민국) 2.41 g을 탈이온수 (De-ionized Water) 1 L에 녹여서 550 mg/L (10 mM)의 망간용액을 제조하여 사용하였다.
MCS를 이용하여 용존 망간 제거 실험을 진행하였으며, 세 가지의 실험으로 구분하여 진행하였다. 첫 번째는 초기 pH에 따른 흡착 효율 실험, 두 번째는 반응시간에 따른 흡착 효율 실험, 세 번째는 용액 내 망간 농도에 따른 흡착 효율 실험이다. pH에 의한 흡착효율을 보기 위해서는 50 mL 튜브에 L/S ratio 100(30 mL : 0.3 g)으로 pH 3~9로 조정 (HNO3 및 HCl 이용)된 용액과 MCS를 넣고 1,440 min 동안 end-over-end shaker을 이용하여 30 rpm의 속도로 상온에서 교반하였다. 이 때, 용존 망간의 농도는 55 mg/L로 하였다. 반응시간의 영향을 보기 위한 흡착실험은 용존 망간 농도를 55 mg/L로 하여 50 mL 튜브에 L/S ratio 100(30 mL : 0.3 g)으로 MCS와 함께 넣고 end-over-end shaker을 이용하여 30 rpm의 속도로 상온에서 교반하며, 일정 시간별 (10, 20, 30, 60, 120, 360, 720, 1,440 min)로 시료를 회수하였다. 초기 망간의 농도에 따른 영향을 보기 위해서는 50 mL 튜브에 농도별 (5.5, 18.3, 55.0, 110.0, 165.0, 220.0 mg/L)로 조정한 용액과 MCS를 고액비(Liquid-to-solid-ratio, L/S) 100 (0.3 g, 30 mL)으로 넣고 1,440 min 동안 end-over-end shaker을 이용하여 30 rpm의 속도로 상온에서 교반하였다. 각각의 실험조건에 대해서는 Table 1에 정리하였다.
Table 1.
Set-up of adsorption experiments using various parameters including initial solution pH, reaction time, and Mn concentration
2)MCS – manganese-oxide coated sand
분석 방법
각각의 시료는 채수 즉시 pH를 측정(HQ40d, HACH, 미국)하고, 0.45 µm 공극의 주사기 필터를 이용하여 여과 후 여과액에 포함된 금속의 농도를 유도결합 플라즈마 질량분석기(Inductively coupled plasma mass spectroscopy(ICP-MS), Agilent 7800, Agilent Technologies, 미국)로 측정하였다. 모든 실험은 결과의 재현성을 확보하기 위해 2회 반복 수행하여 얻은 결과의 평균치를 계산하여 나타내었다.
반응시간별 흡착제(MCS)에 흡착된 망간의 양(qt)은 식 (1)를 이용하여 계산하였다.
| $$q_t=\frac{(C_0-C_t)V}W$$ | (1) |
여기서, qt는 시간 t에서 흡착제에 흡착된 망간의 양(mg/g), C0와 Ct는 시료의 용존 망간의 초기농도 및 시간 t에서의 농도(mg/L), V는 용액 부피(L)이고 W는 흡착제의 건조 질량(g)이다.
본 연구에서는 흡착제의 평형흡착량(qe)은 24시간이 경과한 후의 조건으로 적용하여 식 (2)에 의해 계산하였다.
| $$q_e=\frac{(C_0-C_e)V}W$$ | (2) |
여기서, qe는 24시간 반응 후 흡착제에 흡착된 망간의 양(mg/g), C0와 Ce는 시료의 용존 망간의 초기농도 및 24시간에서의 농도(mg/L), V는 용액 부피(L)이고 W는 흡착제의 건조 질량(g)이다.
용존 망간 제거율은 식 (3)에 의해 계산하였다.
| $$RE=\frac{(C_0-C_e)V}{C_0}\times100$$ | (3) |
여기서, RE은 용존 망간 제거율(removal efficiency, %), C0와 Ce는 시료의 용존 망간의 초기농도 및 24시간에서의 농도(mg/L)이다.
흡착제의 망간 흡착의 동력학적 특성을 규명하기 위해 Lagergren에 의해 제안된 유사 1차(pseudo-first-order) 속도모델 식 (4)와 유사 2차(pseudo-second-order) 속도모델식 (5)을 사용하였다.
| $$\log(q_e-q_t)=\log q_t-\frac{k_{ad}}{2.303}\times t$$ | (4) |
| $$\frac t{q_t}=\frac1{k_2q_e^2}+(\frac1{q_e})\times t$$ | (5) |
여기서, kad(L/min)와 k2(g/mg・min)는 각각 1차 및 2차 흡착반응의 속도상수이다.
흡착공정의 등온흡착 특성을 규명하기 위해 Langmuir 모델 식 (6) 및 Freundlich 모델 식 (7)을 사용하였다.
| $$\frac{C_e}{q_e}=\frac1{q_mb}+\frac{C_e}{q_m}$$ | (6) |
| $$\log q_e=\log K_F+\frac1n\log C_e$$ | (7) |
여기서, Ce는 평형상태에서 용존 망간 농도(mg/L), qe는 평형상태에서 흡착제에 흡착된 망간의 양(mg/g)이다. qm와 b는 각각 흡착제의 단위질량당 망간의 최대 흡착용량(mg/g)과 흡착의 친화도(L/mg)를 나타내는 Langmuir 상수이며 KF와 n은 각각 흡착용량[(mg/g) ‧ (L/mg)1/n]과 흡착강도를 나타내는 Freundlich 상수이다.
결과 및 고찰
MCS 광물학적 특성
MCS의 XRD 분석 결과 폐여과사에 피복된 MCS는 Na-birnessite(Na0.55Mn2O4·1.5H2O)인 것으로 나타났다(Fig. 1). 여과사 전체를 찍은 피크(peak)값에서 석영이 주로 나타나는 것은 XRD 분석에서 X-ray 선이 피복층을 통과하여 분석되기 때문으로 보인다(Fig. 1(a) and (b)). 피복만을 분쇄한 결과에서는 Na-birnessite의 피크가 주로 나타나고 있다(Fig. 1(c)).
흡착 특성
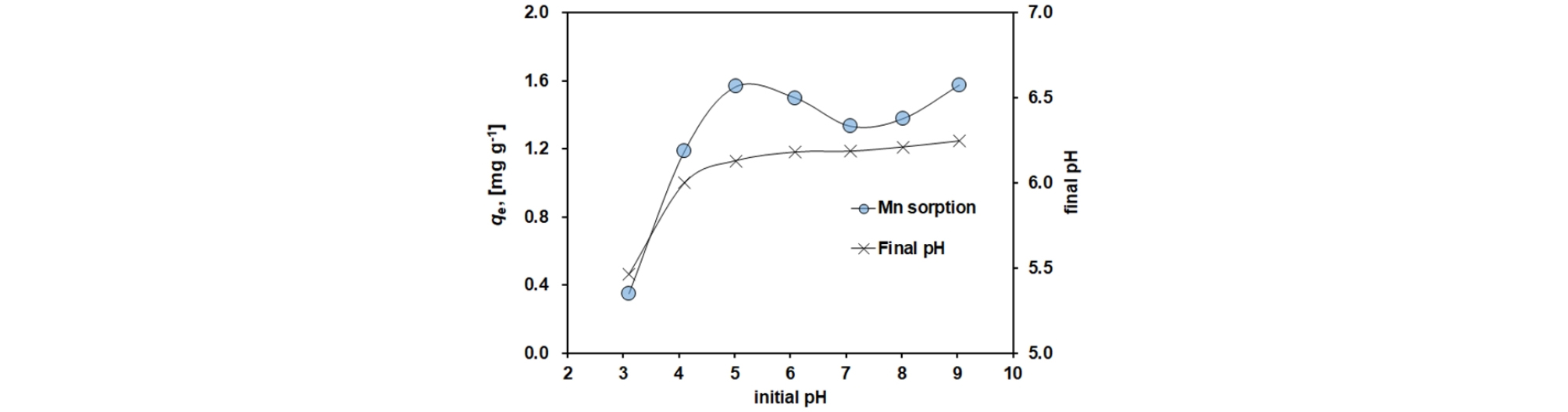
반응 용액의 초기 pH에 따른 흡착 실험 결과를 Fig. 2에 나타내었다. 초기 pH가 3인 경우를 제외하고 초기 pH와 관계없이 6부근(6.19 ± 0.04)에서 수렴되었다. 이러한 결과는 중화처리 공법과 함께 이용될 경우 추가적인 pH 조절의 문제를 해소할 수 있을 것으로 기대된다. 흡착량은 초기 pH 5 이상에서 1.47 ± 0.11 mg/g 정도의 양을 보였다. 흡착효율은 26.3 ± 0.2 %의 용존 망간 제거율을 보였다. pH 4 이하의 낮은 pH에서는 망간의 흡착효율이 저조한 것으로 보인다. Tobiason et al.(2016)에 의하면 pH 6~9에서 망간산화물에 의한 망간의 흡착이 원활한 것으로 보고되었다. 낮은 pH 조건에서 망간 흡착이 낮은 것은 산성 조건에서 증가하는 수소 이온이 망간이 흡착 가능한 동일한 사이트에 경쟁 이온 역할을 했기 때문으로 판단된다. 또한, pH 6 수렴 현상은 birnessite가 산성 조건에서는 수산화 이온들(OH-)을 내보내고, 알칼리조건에서는 흡수/흡착에 기인한 것으로 판단된다.
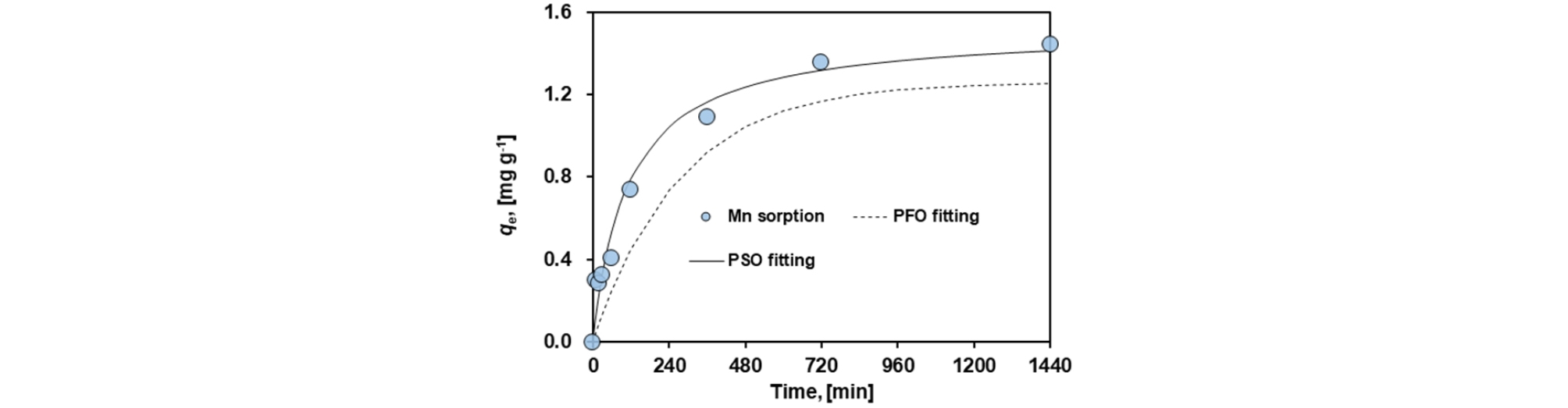
Fig. 3은 시간에 따른 MCS에 의한 망간의 흡착량을 보여준다. 24시간 경과 후 MCS에 의한 용존 망간 제거율은 55 mg/L의 초기 농도 대비 약 25 %의 제거율을 보였다. 망간의 흡착은 반응 초기에 급격하게 증가한 후 계속해서 서서히 증가하는 경향을 보인다. 이는 6시간 정도에서 평형을 이루었던 기존 연구에 비해 느린 반응으로 보여 진다(Kan et al., 2013). 또한 2가의 용존 망간이 흡착된 후 4가로 산화되어 새로운 흡착자리를 만들어 망간 흡착반응이 종료되지 않고 지속적으로 흡착이 일어났을 가능성도 생각할 수 있다(Yu et al., 2007). 이러한 반응 특성은 망간사를 이용한 용존 망간의 제거에 있어서 차아염소산(HOCl) 등을 이용하여 산화시키는 방법을 통해 망간사의 흡착 효능을 재생시키는 방법으로 이용될 수 있다(Joseph et al., 2018).
Lagergren에 의해 제안된 흡착모델에 의해 계산된 흡착속도는 유사 1차 속도식의 경우 qe는 1.26 mg/g, k1은 0.0037 min-1로 계산되었고, 유사 2차 속도식의 경우 qe는 1.55 mg/g, k2는 0.0057 g/(mg ‧ min)로 계산되었다(Table 2). 이는 유사한 흡착제를 사용한 Kan et al.(2013)의 실험 결과와 비교했을 때, 반응속도가 매우 느린 것으로 확인되었다. 반응속도 모델은 상관계수값을 비교한 결과(Pseudo-first order: R2 = 0.9927, Pseudo-second order: R2 =0.9941), 유사 2차 속도식에 더 잘 맞는 경향을 보여 화학적 흡착(chemical sorption)이 일어난 것으로 추정된다.
Table 2.
Pseudo first- and second-order kinetic model parameters for the adsorption of Mn2+ onto MCS and other adsorbents
2)MOCS : synthesized manganese oxide coated sand, Initial Mn conc. = 10 mg/L. (Kan et al., 2013)
3)MIOCS : manganese and iron oxide coated sand in water treatment plant in Taiwan, Initial Mn conc. = 10 mg/L. (Kan et al., 2013)
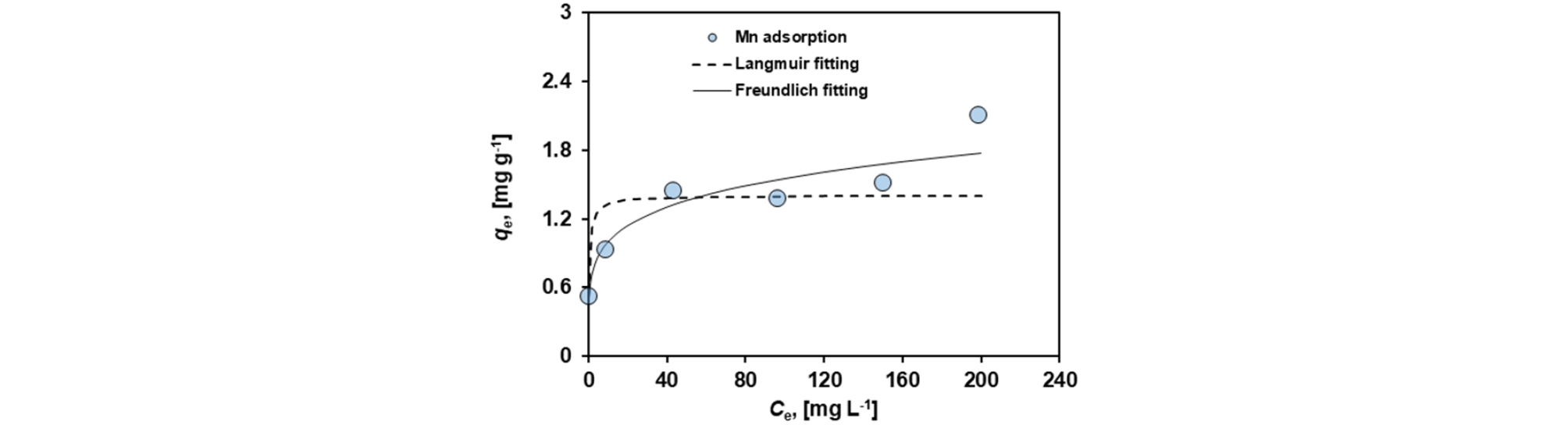
Fig. 4는 초기 용존 망간의 농도에 따른 MCS의 흡착 특성을 보여주고 있다. Freundlich와 Langmuir 등온흡착식을 적용하여 MCS의 망간 흡착성능을 계산한 결과를 Table 3에 나타내었다. Langmuir 등온흡착식에 의해 계산된 MCS에 대한 망간의 최대 흡착량은 1.402 mg/g, 결합세기는 2.01 L/mg이었다. Freundlich 등온흡착식을 이용한 MCS에 대한 망간의 흡착능력(KF)은 0.645, 흡착강도(n)는 5.225로 계산되었다. 또한, Freundlich 등온흡착 모델에 더 잘 맞는 경향을 보여 다층 흡착(multilayer sorption)이 일어난 것으로 판단된다. 두 모델 모두 Kan et al.(2013)의 실험 결과와 비교했을 때, 매우 우수한 흡착 능력을 보여주고 있다.
Table 3.
Adsorption isotherm parameters for the Mn2+ onto MCS and other adsorbents
| Langmuir | Freundlich | ||||||
| qm (mg/g) | b (L/mg) | R2 | KF[(mg/g)‧(L/mg)1/n] | n | R2 | ||
| MCS1) | 1.402 | 2.0099 | 0.881 | 0.6446 | 5.225 | 0.945 | |
| MOCS2) | 0.830 | 0.084 | 0.992 | 0.0746 | 1.400 | 0.973 | |
| MIOCS3) | 0.884 | 1.656 | 0.959 | 0.4817 | 2.75 | 0.964 | |
2)MOCS : synthesized manganese oxide coated sand (Kan et al., 2013)
3)MIOCS : manganese and iron oxide coated sand in water treatment plant in Taiwan (Kan et al., 2013)
흡착동역학 모델로 볼 때는 반응 속도가 상대적으로 느린 반면, 등온흡착 모델에 의한 MCS에 대한 망간의 흡착은 매우 우수한 것으로 나타났다. 이는 고농도에서 과포화상태로 인한 침전이 영향을 준 것으로 판단할 수도 있겠으나, 앞서 언급한대로 흡착된 망간의 산화에 의해 생성된 새로운 흡착자리에 의해 지속적으로 망간의 흡착이 진행되어 평형에 이르는 시간은 길어지고(흡착 평형에 도달하지 않고 계속 진행), 흡착량은 증가하는 것으로 볼 수 있다.
결 론
본 연구에서는 강원도 정선군 소재 광산배수 처리시설에서 발생된 폐여과사에 피복된 망간산화물의 특성을 활용하여 폐여과사의 재활용 방안을 찾기 위한 기초연구를 수행하였다.
폐여과사는 표면에 망간산화물이 주로 코팅되어있는 망간산화물 피복모래(manganese, manganese oxide-coated sand, MCS)로 구성되어 있다.
본 연구를 통해 확인한 연구 결과는 다음과 같다.
1) MCS의 표면에 피복된 망간산화물은 XRD 분석결과 Na-birnessite인 것으로 나타났다.
2) pH에 따른 흡착량은 pH 5 이상에서 1.47 ± 0.11 mg/g 정도의 일정한 흡착량을 보였다.
3) MCS에 의한 망간의 흡착속도는 유사 1차 속도식의 경우 k1이 0.0037 min-1, 유사 2차 속도식의 경우 k2가 0.0057 g/(mg·min)로 반응속도가 매우 느린 것으로 나타났다.
4) 등온흡착식을 이용한 MCS에 대한 망간의 흡착능력은 Langmuir 모델에서 최대 흡착량 1.402 mg/g, 결합세기는 2.01 L/mg, Freundlich 모델에서 KF은 0.645, 흡착강도(n)는 5.225로 나타났다.
본 연구의 결과를 토대로 볼 때, 폐여과사를 주로 구성하는 MCS는 폐수중에 존재하는 용존 망간의 제거에 우수한 능력을 갖는 것으로 보인다. 이는 광산배수 처리시설에서 발생되는 폐여과사를 폐기물로 처분하기보다 주변 광산의 광산배수 처리에 있어서 중화처리나 자연정화시설에서 처리하기 어려운 용존 망간의 처리에 활용하는 것이 가능할 것으로 판단된다.