서 론
석유화학 산업의 발달에 따라 공정의 반응속도를 조절하기 위한 촉매의 사용이 지속적으로 증가하고 있다. 일반적으로 촉매로 사용되고 있는 금속원소들로는 니켈(Ni), 백금(Pt), 팔라듐(Pd), 로듐(Rh), 아연(Zn), 은(Ag), 티타늄(Ti), 코발트(Co), 몰리브덴(Mo), 바나듐(V) 등이 있으며, 이들 금속원소들은 단독으로 담체에 담지 되거나 혹은 여러 금속원소들을 함께 담지 시켜 촉매로 사용된다(Choi, 2010).
금속촉매 중에서 팔라듐은 수소화 분해, 이성질화 그리고 수소화 처리등과 같은 석유화학공정에서 촉매로 널리 사용되고 있다(Choi, 2010). 또한 석유 화학 산업에서 사용되는 은은 Ag/α-Al2O3 촉매의 활성 성분으로 메탄올에서 포름알데히드를 제조하고 에틸렌 옥사이드에서 에틸렌을 생성하고 알데히드와 암모니아에서 니트릴을 합성하는 데 사용되고 있다(Sun et al., 2014).
이러한 촉매들은 사용기간이 길어짐에 따라 점차 성능이 저하될 뿐만 아니라 반복사용에 따라 고온에서 탄화수소, 수소, 일산화탄소 등이 흡착되어 촉매로서의 기능을 발휘하지 못하게 되어 폐기된다(Chen et al., 2019). 성능과 가능의 저하에 따라 버려지는 폐촉매에는 촉매의 제조 시 활성물질이 첨가된 금속성분들이 대부분 잔존해 있다. 따라서 수소첨가 크래킹 공정에서 배출되는 Pd/Ag 폐촉매에는 고가의 팔라듐과 은이 상당량 함유되어 있으며, 매력적인 2차 자원이라 아니할 수 없다. 특히 팔라듐의 경우 천연광물 자원에 비하여 상당히 고품위의 자원으로서, 귀금속 관련 산업소재원료를 거의 전량 수입에 의존하는 우리나라에서는 자원 확보 측면에서 폐촉매로부터 이러한 귀금속들을 효율적으로 회수하여 재활용하는 기술이 반드시 필요하다(Lee, 2010).
폐촉매에 함유되어 있는 팔라듐과 은을 회수하는 방법은 건식제련과 습식제련으로 대별된다. 대규모 처리에 적합한 건식제련법은 합금의 형태로 추출된 귀금속의 정제를 위하여 용해공정을 거쳐야 하는 반면 습식제련법은 소규모 처리에 적합하고 공정의 유연성이 뛰어나다는 장점이 있다. 따라서 폐촉매의 발생량이 많지 않은 우리나라에서는 습식제련법으로 폐촉매로부터 팔라듐과 은을 추출하여 산업원료화하는 것이 더 효율적이라고 할 수 있다(Lee et al., 2010).
습식제련법으로 폐촉매에 함유되어 있는 금속을 회수하는 경우 직접 침출하는 방법과 폐촉매의 담체를 용해하여 금속을 농축한 다음 침출하는 방법으로 대별된다(Ding et al., 2019). 팔라듐을 침출하기 위한 습식공정에는 왕수(Aqua regia)를 사용하여 팔라듐을 용해하는 방법(Aberasturi et al., 2011), 산화제의 존재 하에 염산을 이용하여 팔라듐을 용해하는 방법, 황산(Sulfuric acid) 또는 수산화나트륨으로 Al2O3 담체를 용해하여 팔라듐을 농축한 뒤 왕수로 용해하는 방법 등이 있다(Jeong et al., 1997). 직접 침출의 경우 서로 다른 침출제를 사용하여 각각 침출하거나 동일한 침출제를 사용하여 동시에 침출할 수 있다(Ding et al., 2019). 일반적으로 환원전위가 매우 높은 팔라듐은 강염산으로 침출하는데 이 때 질산(HNO3), 차아염소산나트륨(NaOCl), 염화알루미늄(AlCl3) 그리고 과산화수소수(H2O2) 등과 같은 강력한 산화제를 첨가한다(Harjanto et al., 2006). 그러나 은의 경우 염산용액에서 난용성염인 염화은 (AgCl)을 형성하기 때문에 침출제로 시안화물(Cyanide), 티오요소(Thiourea), 티오황산(Thiosulfate)등 다양한 물질이 사용되어 왔지만 일반적으로 질산(Nitric acid)만이 침출제로 사용된다(Dong et al., 2018). 최근들에 환경규제의 강화에 따라 청정침출공정을 위한 친환경 침출제들의 적용에 대한 연구(Mylarappa et al., 2016)들이 보고되고 있으나 아직 상용공정에서 종래의 염산과 질산을 대체할 수 있는 침출제가 없는 실정이다.
본 연구에서는 산에 의한 팔라듐과 은의 동시 침출에 대한 연구가 보고된바 없는 점에 착안하여 석유화학공정에서 발생하는 폐촉매로부터 팔라듐과 은의 질산 및 염산 침출 거동을 조사하고 팔라듐과 은을 동시에 침출할 수 있는 가능성을 살펴보았다. 특히 염산을 침출제로 사용하였을 때은이 염화은으로 침전되지 않고 팔라듐과 함께 침출되는 침출공정을 개발하고자 하였다. 아울러 질산과 염산의 농도, 침출온도와 시간, 광액농도 등 침출조건들이 팔라듐과 은의 침출거동에 미치는 영향을 조사하고 침출반응을 규명 하고자 하였다.
실험방법
실험재료
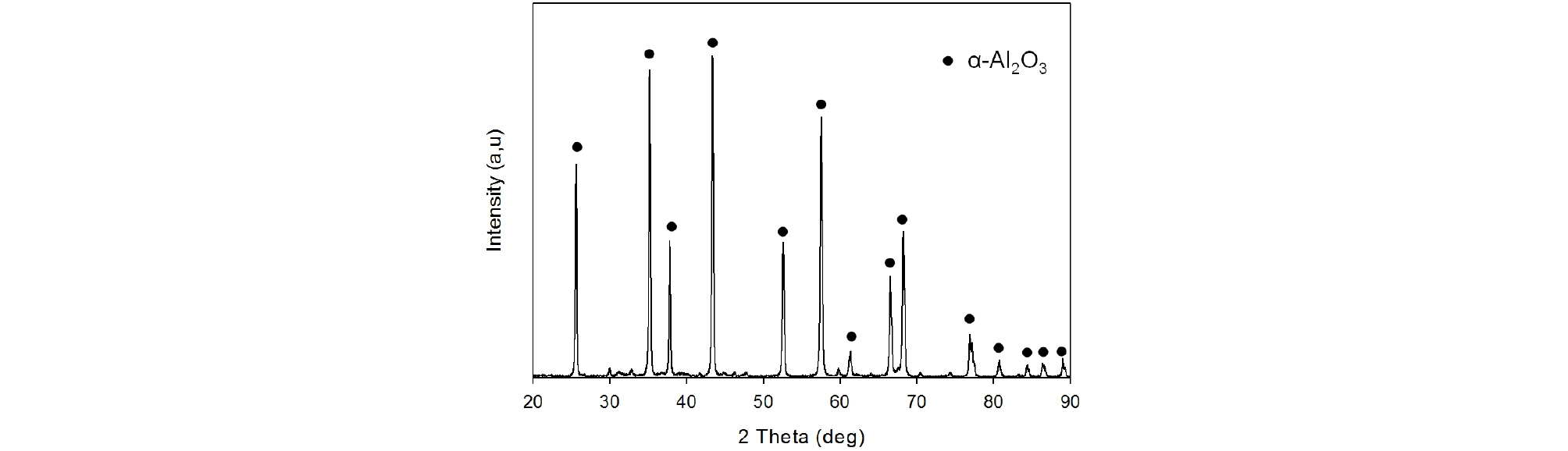
본 연구에서는 국내 석유화학 플랜트의 수소첨가 분해공정에서 발생된 석유화학 폐촉매를 시료로 사용하였다. 원통형 폐촉매(지름 4 mm)는 로울 크러셔(Roll Crusher, The McFarlane-Eggers Machinery Company)를 사용하여 –2 mm로 파쇄한 뒤 진동체질기(Sieve Shaker, RX-29-16, RO-TAP)로 분급(+1,000, ‑1,000/+850, –850/+500, 500/ +212, –212/+150, –150/+75, ‑75 µm)하여 사용하였다. Table 1에서 보는 바와 같이 본 연구 사용한 석유화학 폐 촉매의 주성분은 알루미나(Al2O3)로서 함량은 99.08wt% 이며, α-Al2O3(Fig. 1)로 존재하였다. 그리고 팔라듐과 은이 각각 200 ppm, 80 ppm이 함유되어 있다. 침출실험을 위하여 질산(Nitric acid, 순도 60%, 대정화금(주)), 염산(Hydrochloric acid, 순도 35%, 대정화금(주)), 과산화수소(Hydrogen peroxide, 순도 30%, 대정화금(주))를 사용하였으며, 기타 모든 실험에 1급 시약을 사용하였다.
Table 1. Chemical composition of spent catalyst used in the study
| Methods | ICP-OES | XRF | |||||||||
| Element | *Ag | *Pd | Al2O3 | SiO2 | Fe2O3 | Na2O | TiO2 | CaO | P2O5 | ||
| Composition (wt%) | 87.0 ppm | 200 ppm | 99.08 | 0.15 | 0.04 | 0.04 | 0.04 | 0.02 | 0.02 | ||
실험방법
폐촉매의 침출실험을 위하여 350 mL의 자켓형 원통 pyrex 반응조를 항온조에 연결하여 사용하였다. 침출제로는 질산과 염산을 사용하였으며, 산화제로 과산화수소를 사용하였다. 침출실험의 조건은 산농도 0.5~8.0 M, 반응온도 25~90°C, 반응시간 5~60분, 광액농도 50~200 g/L, 교반속도 350 rpm 이었다. 침출실험은 먼저 농도가 조절된 질산용액 또는 염산용액을 반응조에 주입하고 가열하여 미리 설정한 침출온도에 도달하면 일정량의 폐촉매를 장입하고 교반하면서 실시하였다. 이 때 침출용액의 온도조절은 항온조로부터 일정한 온도의 물을 반응조 자켓으로 순환시켜 행하였다. 설정한 반응시간에 도달하면 교반을 멈추고 고액분리 후 침출액 시료를 채취하여 팔라듐과 은 그리고 알루미늄의 분석을 수행하였다. 팔라듐, 은, 알루미늄의 침출율(%)은 식 (1)을 이용하여 계산하였다.
| $$\%\mathrm{Leachning}\;\mathrm{efficiency}=\frac{(m_{\in ial}-m_{\in final})}{m_{\in ial}}\times100\%$$ | (1) |
여기서 mInitial은 침출 전 폐촉매에 함유된 금속의 양이고 mFinal은 침출용액에 함유된 금속양이다. 침출된 팔라듐과 은의 농도는 ICP-OES를 사용하여 측정하였다.
폐촉매와 침출용액의 성분분석을 위하여 X-선 현광분석기(XRF, X-Ray Fluorescence Spectrometer, Shimadzu, Japan)과 유도결합플라즈마분광분석기(ICP-OES, Inductively Coupled Plasma- Optical Emission Spectroscopy, iCAP 6000 SERIES BPS-805-Z, Thermo Fisher SCIENTIFIC)를 사용하였다. 그리고 X-선 회절기(X-ray diffraction, D/MAX-2200/PC, Rigaku, Japan)를 이용하여 폐촉매의 상 분석을 수행하였다.
실험결과 및 고찰
질산에 의한 팔라듐과 은의 침출
석유화학 폐촉매로부터 팔라듐과 은을 동시에 침출하기 위하여 질산을 침출제로 선정하였다. 질산에 의한 팔라듐과 은의 침출반응식은 다음과 같이 나타낼 수 있다(Dong et al., 2018).
| $$\mathrm{Ag}+2{\mathrm{HNO}}_3(\mathrm{aq})\;\rightarrow\;{\mathrm{AgNO}}_3(\mathrm{aq})+{\mathrm{NO}}_2(\mathrm g)+{\mathrm H}_2\mathrm O(\mathrm{aq})\;$$ | (2) |
| $$\mathrm{Pd}+4{\mathrm{HNO}}_3(\mathrm{aq})\;\rightarrow\;\mathrm{Pd}{({\mathrm{NO}}_3)}_2(\mathrm{aq})+2{\mathrm{NO}}_2(\mathrm g)+2{\mathrm H}_2\mathrm O(\mathrm l)$$ | (3) |
질산농도의 영향
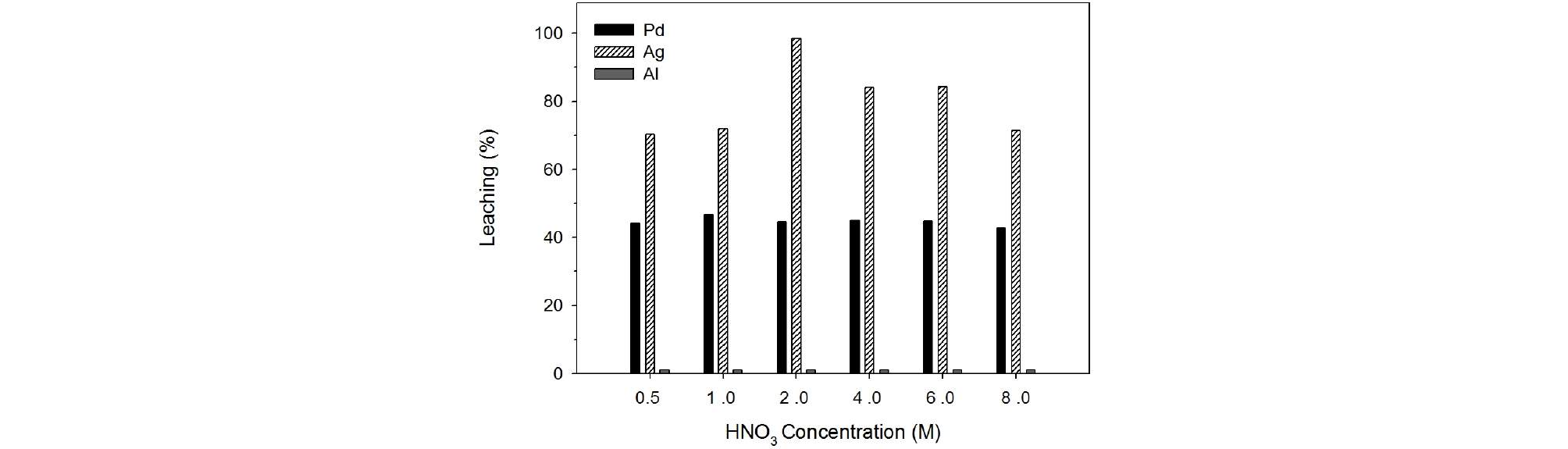
석유화학 폐촉매로부터 귀금속인 팔라듐과 은을 회수하기 위하여 질산용액에 의한 침출실험을 수행하였다. 질산 농도를 0.5 M~8.0 M으로 변화시키면서 침출온도 90°C, 침출시간 60분, 광액농도 100 g/L, 교반속도 350 rpm에서 폐촉매로부터 팔라듐과 은을 침출하였으며 그 결과를 Fig. 2에 나타내었다. 침출시험에 사용된 폐촉매의 입자크기는 –500/+212 µm이었다. Fig. 2에서 보는 바와 같이 질산농도가 0.5 M에서 8.0 M으로 증가함에도 불구하고 팔라듐의 침출율은 43~47%로 거의 변화가 없었다. 반면에 은의 침출율은 팔라듐 보다 월등히 높았으며 질산농도의 영향을 많이 받음을 나타내었다. 질산농도가 1.0 M에서 2.0 M로 증가됨에 따라 은의 침출율은 72%에서 98%로 급격히 증가하였다. 그러나 질산농도가 4.0 M, 8.0 M으로 더 증가하였을 때 은의 침출율은 각각 84%, 71%로 오히려 감소하였다. 특정농도 이상일 경우 침출율이 감소하는 경향을 보이는 연구결과(Ozmetin et al., 2000)가 보고된 바 있으며, 침출 용액 분석과 화학반응의 변화와 같은 추가 연구가 필요하다고 사료된다. 또한 알루미늄의 경우 XRD에서 확인한 것과 같이 Al2O3 형태로써 침출율은 1% 이하로 질산에 녹지않는 것으로 판단되어진다.
입자크기의 영향
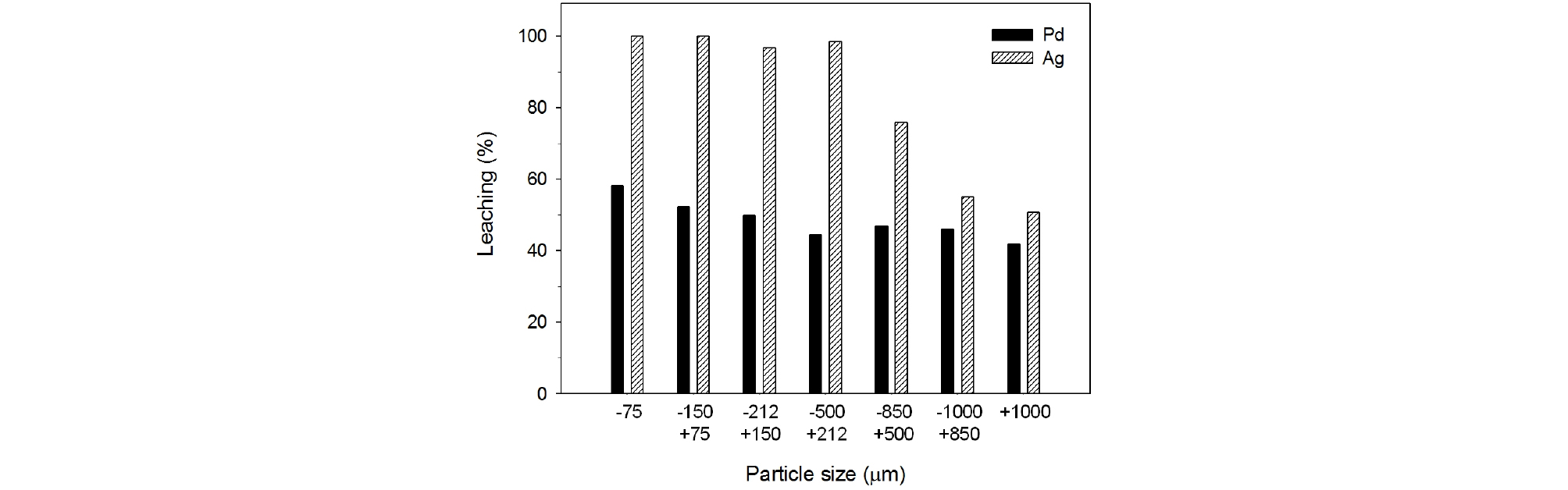
폐촉매의 입자크기가 팔라듐과 은의 질산침출에 미치는 영향을 조사하였다. 침출실험조건은 질산농도 2.0 M, 침출 온도 90°C, 침출시간 60분, 광액농도 100 g/L, 교반속도 350 rpm이었다. Fig. 3에서 보는 바와 같이 폐촉매의 입자 크기가 +212/–1,000 µm일 때 팔라듐의 침출율은 45~47% 로서 거의 변화가 없었지만 입자크기가 212 µm 이하로 작아짐에 따라 침출율은 서서히 증가하였으며 –75 µm의 폐촉매로부터 58%의 팔라듐이 침출되었다. 한편 은의 경우 폐촉매의 입자크기가 작아짐에 따라 침출율이 상당히 증가함을 나타내었으며, 500 µm 이하의 입자크기를 갖는 폐촉매로부터 거의 대부분 침출되었다.
침출온도의 영향
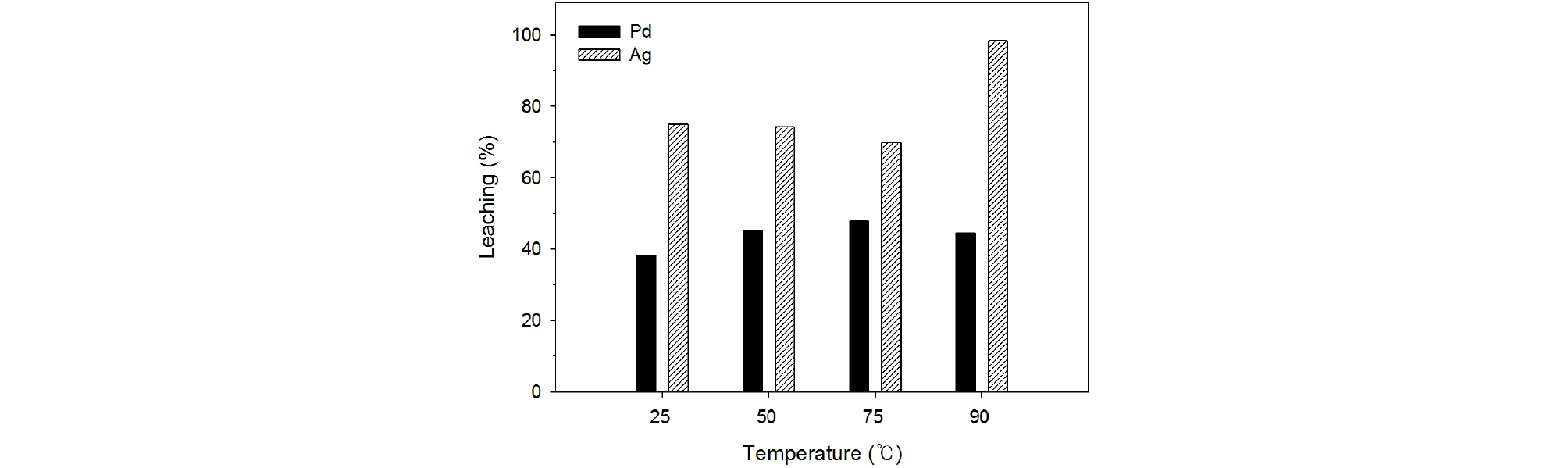
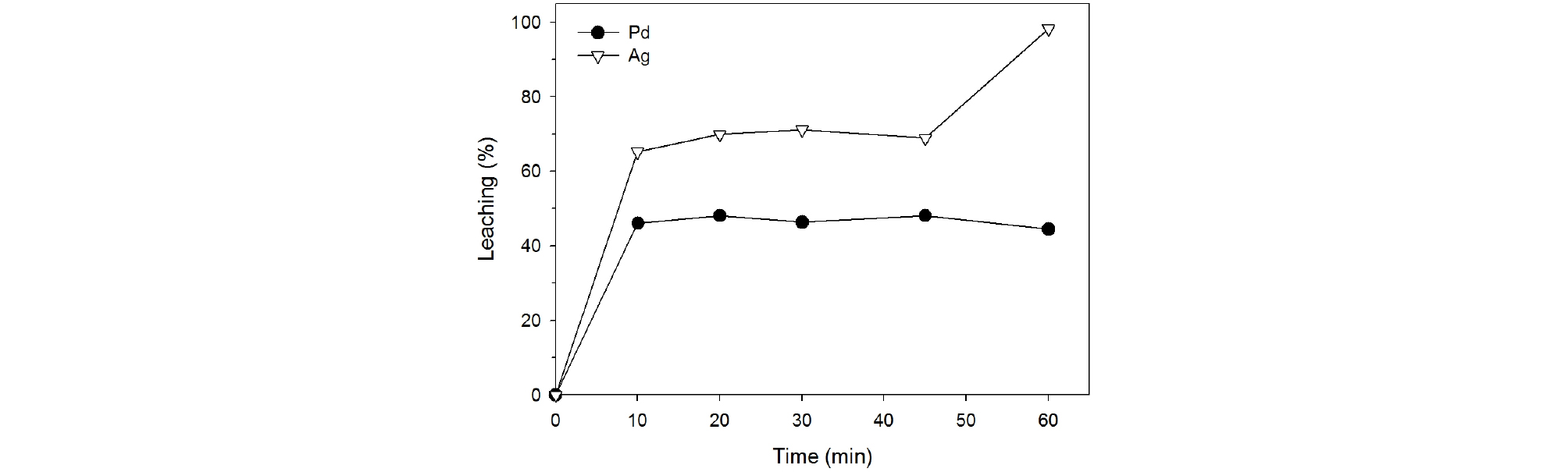
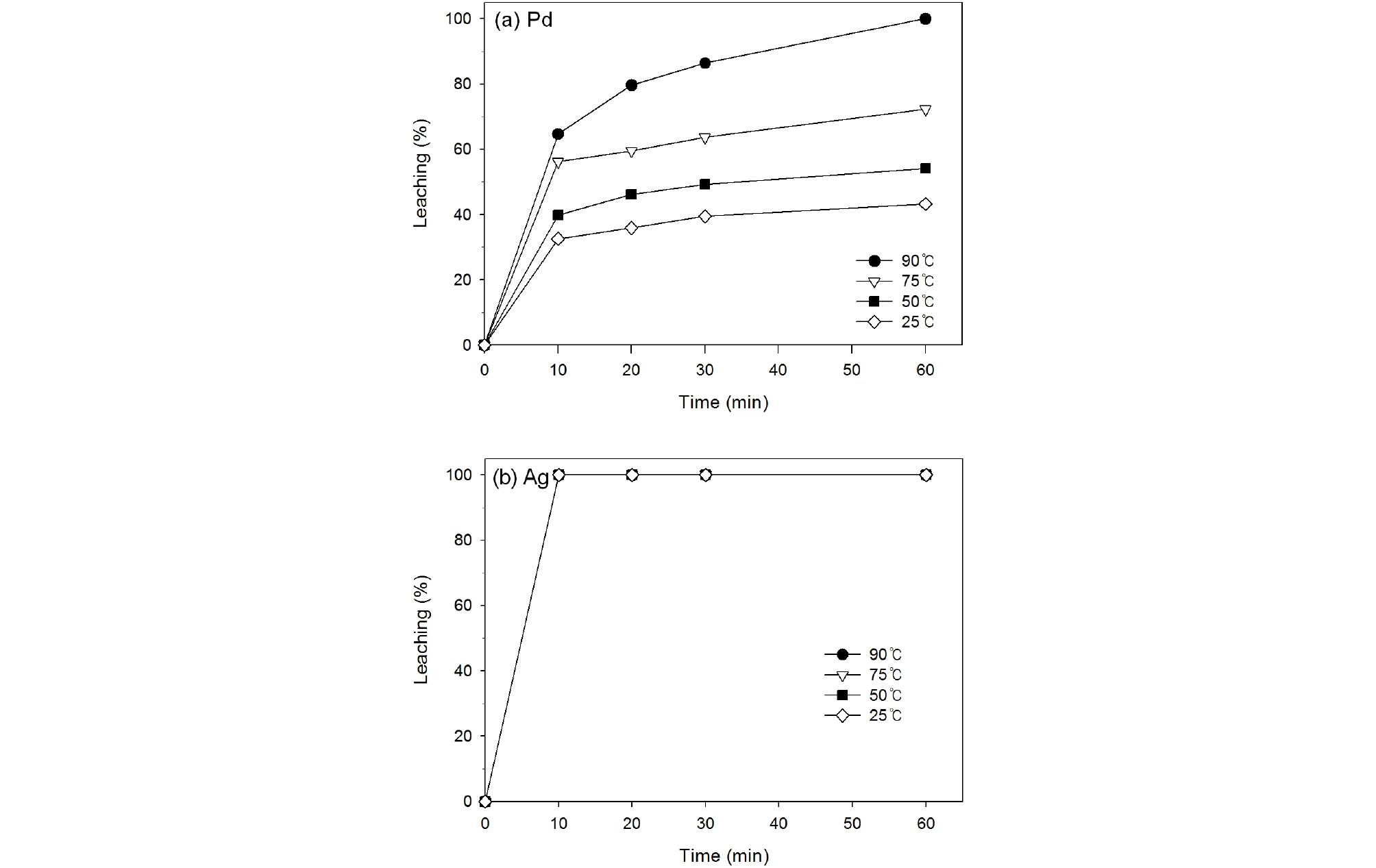
Fig. 4와 5는 2.0 M 질산용액으로 폐촉매로부터 팔라듐과 은을 침출하였을 때 침출온도와 시간의 영향을 각각 조사하여 나타낸 것이다. 침출온도와 시간은 각각 25~90°C, 10~60분으로 변화시켰으며 폐촉매의 입자크기는 –500/ +212 µm, 광액농도는 100 g/L, 교반속도는 350 rpm이었다. Fig. 4에서 보는 바와 같이 폐촉매의 질산침출을 행하였을 때 온도가 증가함에 따라 팔라듐의 침출율은 서서히 증가하였으나 50°C, 75°C, 90°C에서 팔라듐의 침출율은 각각 45%, 47%, 48%로서 침출온도의 영향이 매우 미미함을 알 수 있었다. 또한 Fig. 5에서 보는 바와 같이 침출온도가 90°C일 때 팔라듐의 침출반응은 20분 내로 종료됨을 보여 준다. 그러나 은의 경우 Fig. 4, 5에서 보는 바와 같이 온도 90°C, 시간 60분 일 때 침출율이 98%로 높은 침출율을 보였다.
산화제의 영향
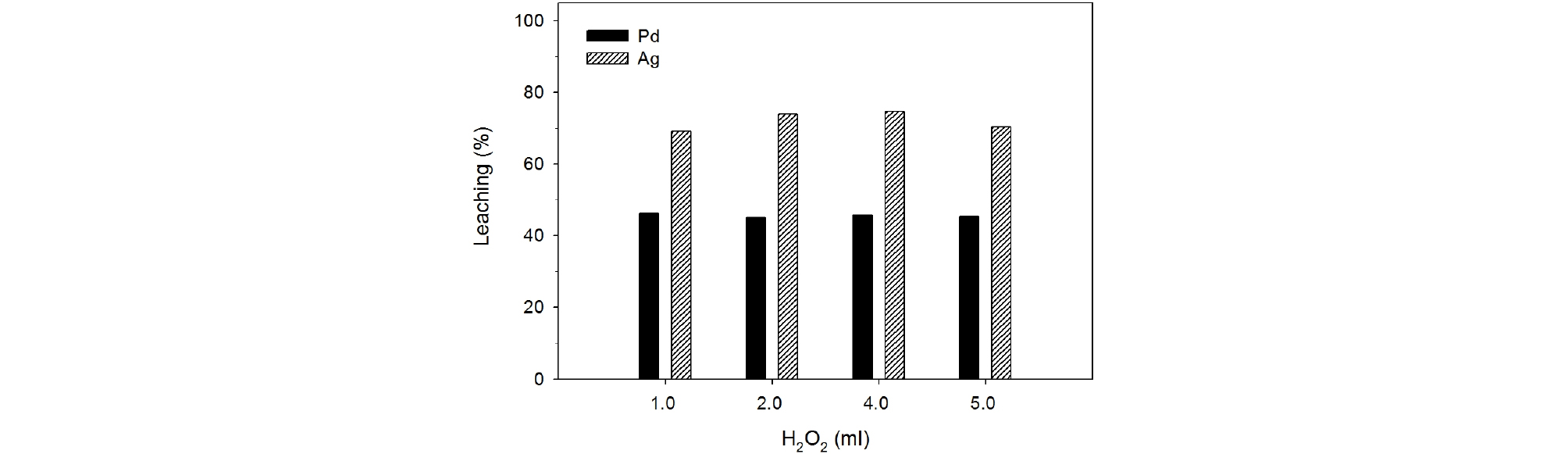
앞에서 서술한 바와 같이 본 실험조건에서 질산에 의한 폐촉매로부터 팔라듐의 침출이 45~46%에 불과하였다. 따라서 팔라듐의 침출율을 향상시키기 위하여 과산화수소수를 산화제 첨가하면서 팔라듐의 침출거동을 조사하였다. 일반적으로 과산화수소는 70°C 초과한 온도에서 분해하는 것으로 알려져 있으므로 이를 고려하여 폐촉매의 침출 온도를 70°C로 설정하였다(Chung et al., 2009). 침출실험 조건은 질산농도 2.0 M, 침출온도 70°C, 침출시간 60분, 폐 촉매의 입자크기 –500/+212 µm, 광액농도 100 g/L, 교반속도 350 rpm이었으며 과산화수소수의 첨가량은 1.0~5.0 mL로 변화시켰다. Fig. 6에서 보는 바와 같이 폐촉매로부터 팔라듐의 질산침출은 과산화수소의 첨가에 거의 영향을 받지 않았다. Fig. 4에서 보는 바와 같이 과산화수소수의 첨가 없이 2.0 M 질산용액을 사용하여 75°C에서 폐촉매를 60분간 침출하였을 때 팔라듐의 침출율은 47%이었으나 1.0~5.0 mL의 과산화수소수를 첨가하면서 70°C에서 동일한 조건으로 침출하였을 때 침출율은 45~46%이었다. 이것은 질산이 강력한 산화제이기 때문에 또 다른 산화제인 과산화수소의 첨가가 거의 효과가 없기 때문으로 생각된다. 또한 은의 침출율도 유사한 경향을 나타내었다.
염산에 의한 팔라듐과 은의 침출
질산을 사용하여 석유화학 폐촉매로부터 팔라듐과 은의 동시 침출을 시도하였지만 앞에서 서술한바와 같이 은이 완전히 침출된 것과는 달리 팔라듐의 침출율은 약 45%로 저조하였다. 따라서 염산에 의한 팔라듐의 침출거동을 조사하여 질산과 염산의 효율성을 비교하고자 하였다. 염산에 의한 팔라듐(Barakat et al., 2006) 과 은의 침출반응식은 다음 Table 2과 같이 나타낼 수 있다.
Table 2. Gibbs free energy of the reaction calculated with temperature (kJ/mol)
염산농도의 영향
질산침출과 동일한 실험조건에서 폐촉매의 염산침출을 수행하여 팔라듐과 은의 침출거동을 조사하였다. 침출온도 90°C, 침출시간 60분, 폐촉매의 입자크기 –500/+212 µm, 광액농도 100 g/L, 교반속도 350 rpm의 침출조건에서 염산 농도를 1.0~6.0 M으로 변화시키면서 폐촉매의 염산침출을 행하였다.
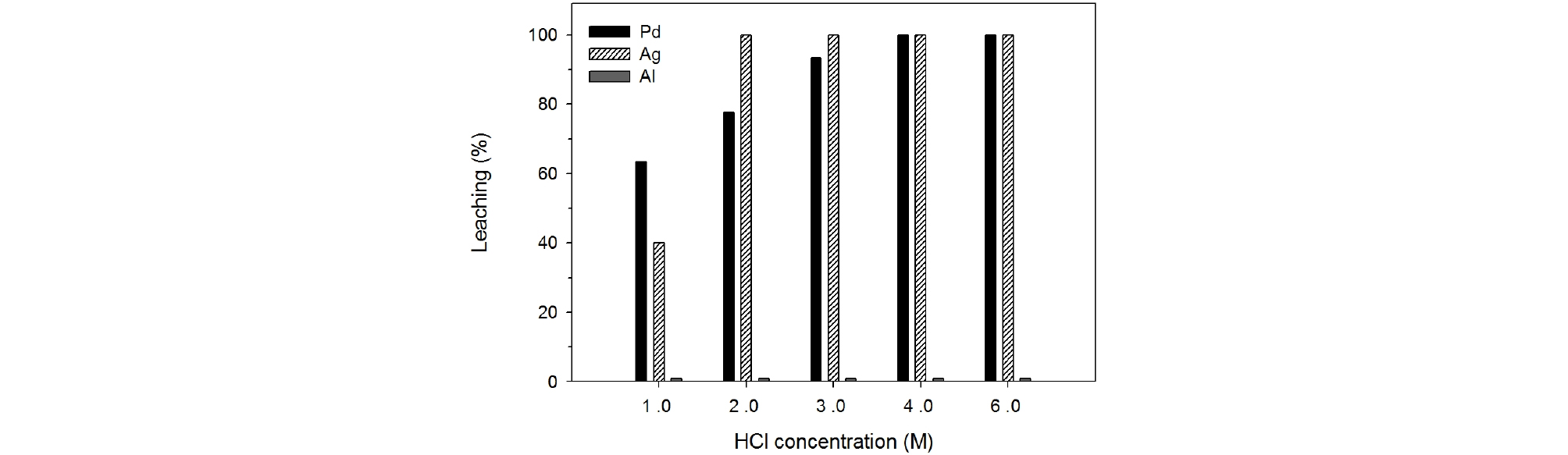
Fig. 7에서 보는 바와 같이 염산농도가 증가함에 따라 팔라듐과 은의 침출율이 급격히 증가하였다. 1.0 M과 2.0 M염산용액을 사용하여 폐촉매의 침출을 행하였을 때 팔라듐의 침출율은 각각 63%, 78%이었으나 4.0 M 염산용액으로 침출함에 따라 팔라듐은 완전히 침출할 수 있었다. Table 2에서 보는 바와 같이 열역학적 데이터를 기반으로 판단할 경우 팔라듐이 금속(metal) 상태로 존재한다면 염산과의 반응이 진행되지 않는 것을 알 수 있다. 따라서 본 연구에서의 팔라듐은 산화된 상태인 산화팔라듐(PdO) 상태로 존재할 수 있다고 사료된다(Barakat et al., 2006).
은의 경우 2.0 M 염산용액으로 완전히 침출하는 것이 가능하였다. 일반적으로 은과 염소의 반응은 Table 2의 은과 염소 반응식에서 같이 염화은이 침전된다(Ranitovic et al., 2016). 하지만 본 실험에서는 은은 염화은으로 침전이 되지 않고, 용액 내에 완전히 용해되었다. 이러한 원인을 염산용액 내 은의 용해도 관점에서 해석해 보았다. 상온 25°C에서 물에 대한 염화은의 용해도 곱 Ksp(solubility product) = [Ag+][Cl‑] 값은 Ksp=1.78×10‑10이며, 이때 은의 농도는 [Ag+]=1.33×10‑5 M 인 것을 알 수 있다(Zelyanskii et al., 2001). 그러나 본 연구는 염산 용액에서 온도의 변화에 따라 진행되었으므로 염화은의 용해도는 달라진다. 온도 85°C에서 염산 2.0 M에 대한 염화은의 용해도가 3.47×10‑3 mol/L 라는 연구가 보고된바 있다(Zelyanskii et al., 2001). 이때 은의 용해도는 3.47×10‑3 mol/L×108 g/mol(은 원자량)=3.75×10‑1 g/L이다. Fig. 7에서 보는 바와 같이 염산농도 2.0 M 이상일 경우 은의 침출율은 100% 임으로 시료에 함유된 은의 함량을 통해 용해된 양을 계산 할 수 있다. 초기 시료의 은의 양이 87 ppm이므로 은의 용해된 양은 0.87× 10‑5 g/L라는 것을 알 수 있다. 즉, 이 값은 비슷한 조건에서의 은의 용해도 3.75×10‑1 g/L 값보다 적은 값으로, 본 연구의 은의 침출은 폐촉매에 존재하는 은의 양이 염화은으로 석출되는 한계 양보다 작았기 때문이라 사료된다. 또한 염산 농도에 따른 염화은 이온 분포에 대한 연구결과가 보고된 바 있다(Aprahamian et al., 1995).
입자크기의 영향
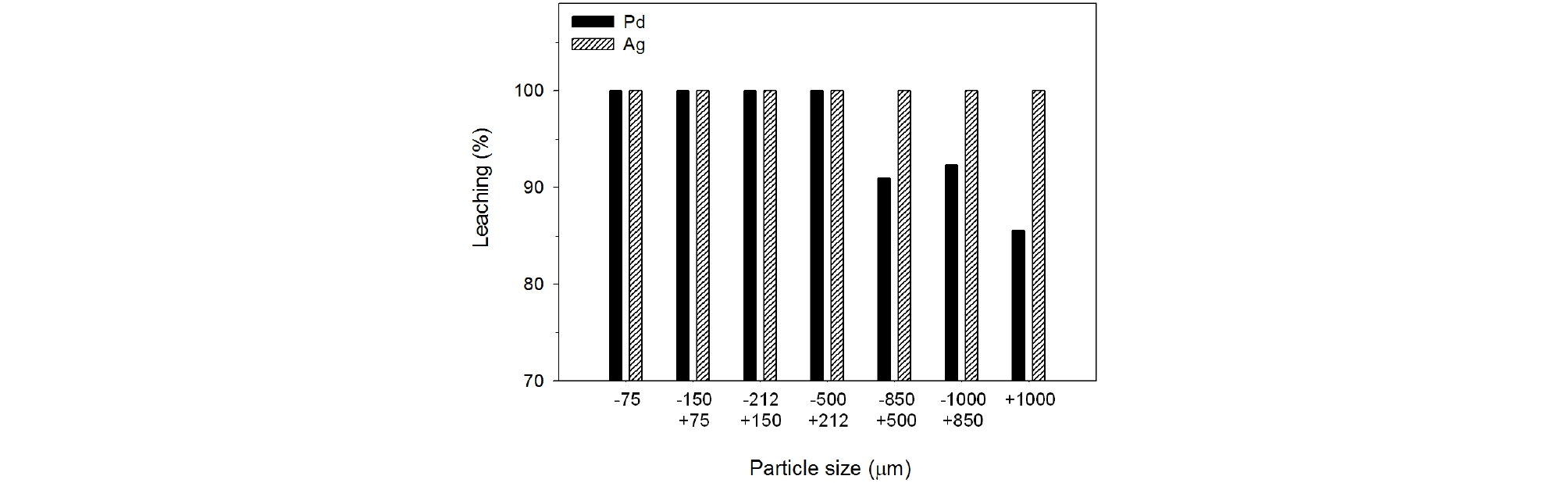
팔라듐과 은이 동시 100% 침출되는 4.0 M 염산용액을 사용하여 폐촉매의 입도 크기에 따른 침출기동을 조사하였다. 침출실험조건은 침출온도 90°C, 침출시간 60분, 광액 농도 100 g/L, 교반속도 350 rpm이었다. Fig. 8에서 보는 바와 같이 입자크기가 500 µm 이하인 폐촉매로부터 팔라듐을 완전히 침출할 수 있었나 입자크기가 500 µm 이상으로 커짐에 따라 침출율은 91%로 감소하였다. 은의 경우 입자 크기에 관계없이 100%의 은이 침출되었다. 따라서 4.0 M 염산용액으로 90°C에서 60분간 침출을 행할 때 팔라듐과 은을 동시에 100% 침출할 수 있는 최적입자크기는 –500 µm이었다.
침출온도의 영향
염산농도 4.0 M, 폐촉매의 입자크기 –500/+212 µm, 광액농도 100 g/L, 교반속도 350 rpm의 침출조건에서 온도를 25~90°C로 변화시키면서 페촉매의 침출을 수행하여 얻은 결과를 Fig. 9에 나타내었다. 그림에서 보는 바와 같이 폐촉매로부터 팔라듐의 침출율은 온도 증가에 따라 상당히 증가함을 보였다. 60분 동안 폐촉매를 침출하였을 때 침출온도가 25°C, 50°C, 75°C, 90°C로 높아짐에 따라 팔라듐의 침출율은 각각 42%, 54%, 72%, 100%로 증가하였다. 그리고 침출시간이 길어짐에 따라 팔라듐의 침출율은 완만하게 증가하였다. 반면에 은의 침출율은 온도의 영향을 받지 않고 10분 이내에 100% 침출이 완료되었다.
광액농도의 영향
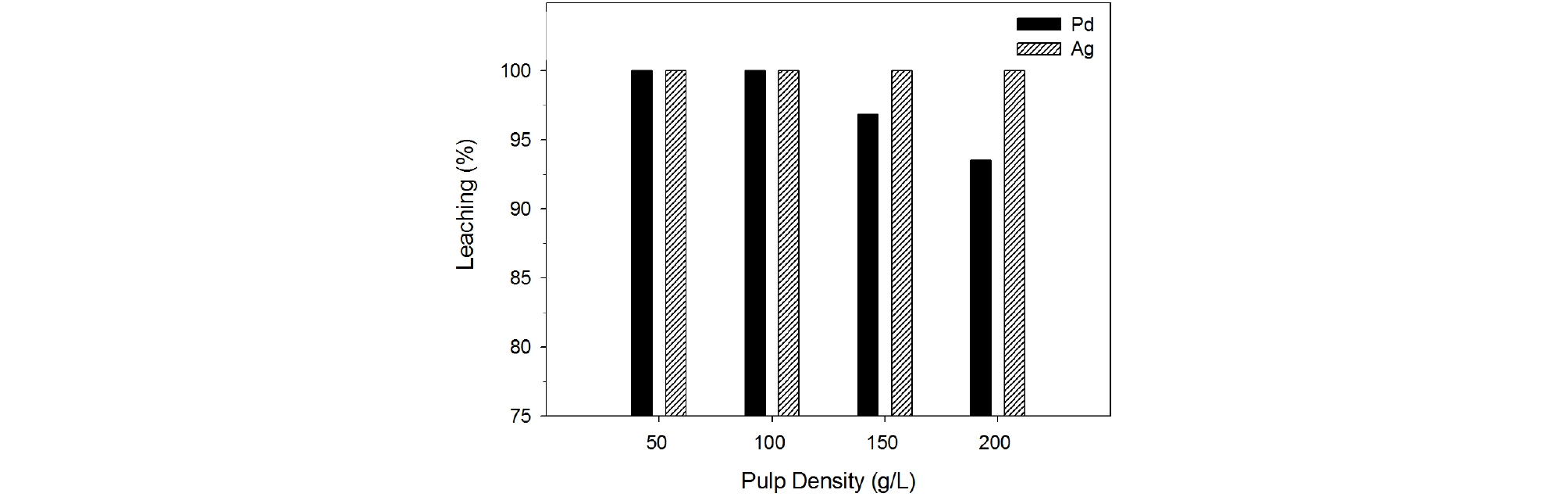
앞에서 행한 폐촉매의 염산 침출실험에서 팔라듐과 은을 동시에 완전히 침출할 수 있는 침출조건은 4.0 M 염산농도, 침출온도 90°C, 침출시간 60분 이었다. 따라서 염산 용액에 의한 팔라듐과 은의 동시침출을 최적화하기 위하여 동일한 침출조건에서 광액농도를 50~200 g/L로 변화시키면서 침출거동을 조사하였다. Fig. 10에서 보는 바와 같이 팔라듐의 침출율은 광액농도가 100 g/L 이상으로 증가함에 따라 조금씩 감소하였으며 200 g/L의 광액농도에서는 94%의 팔라듐이 침출되었다. 반면에 은은 200 g/L의 광액 농도에서도 100%의 침출율을 나타내었다. 팔라듐이 고가의 귀금속임을 고려하면 폐촉매로부터 팔라듐을 은과 동시에 완전히 침출하는 것이 필수적이며 따라서 최적광액농도는 100g/L이다.
속도론적 해석
본 연구에서 행한 침출실험의 조건에서 은의 침출거동은 침출온도와 침출시간의 영향을 거의 받지 않았기 때문에 은 침출거동의 속도론적 해석은 최적침출조건의 도출과 반응조 설계에 있어서 무의미한 것으로 판단되었다. 따라서 팔라듐 침출반응의 속도론적 해석만을 수행하였으며 다음과 같은 shrinking core model을 적용하였다(Lee and Mishra, 2018).
| $$1‑3{(1‑x)}^{2/3}\;+\;2(1‑x)\;=\;kt\;(\mathrm{for}\;\mathrm{pore}\;\mathrm{diffusion}\;\mathrm{control})$$ | (4) |
| $$1‑3{(1‑x)}^{2/3}\;+\;2(1‑x)\;=\;kt\;(\mathrm{for}\;\mathrm{pore}\;\mathrm{diffusion}\;\mathrm{control})$$ | (5) |
| $$x\;=\;kt\;(\mathrm{for}\;\mathrm{fluid}\;\mathrm{film}\;\mathrm{diffusion}\;\mathrm{control})$$ | (6) |
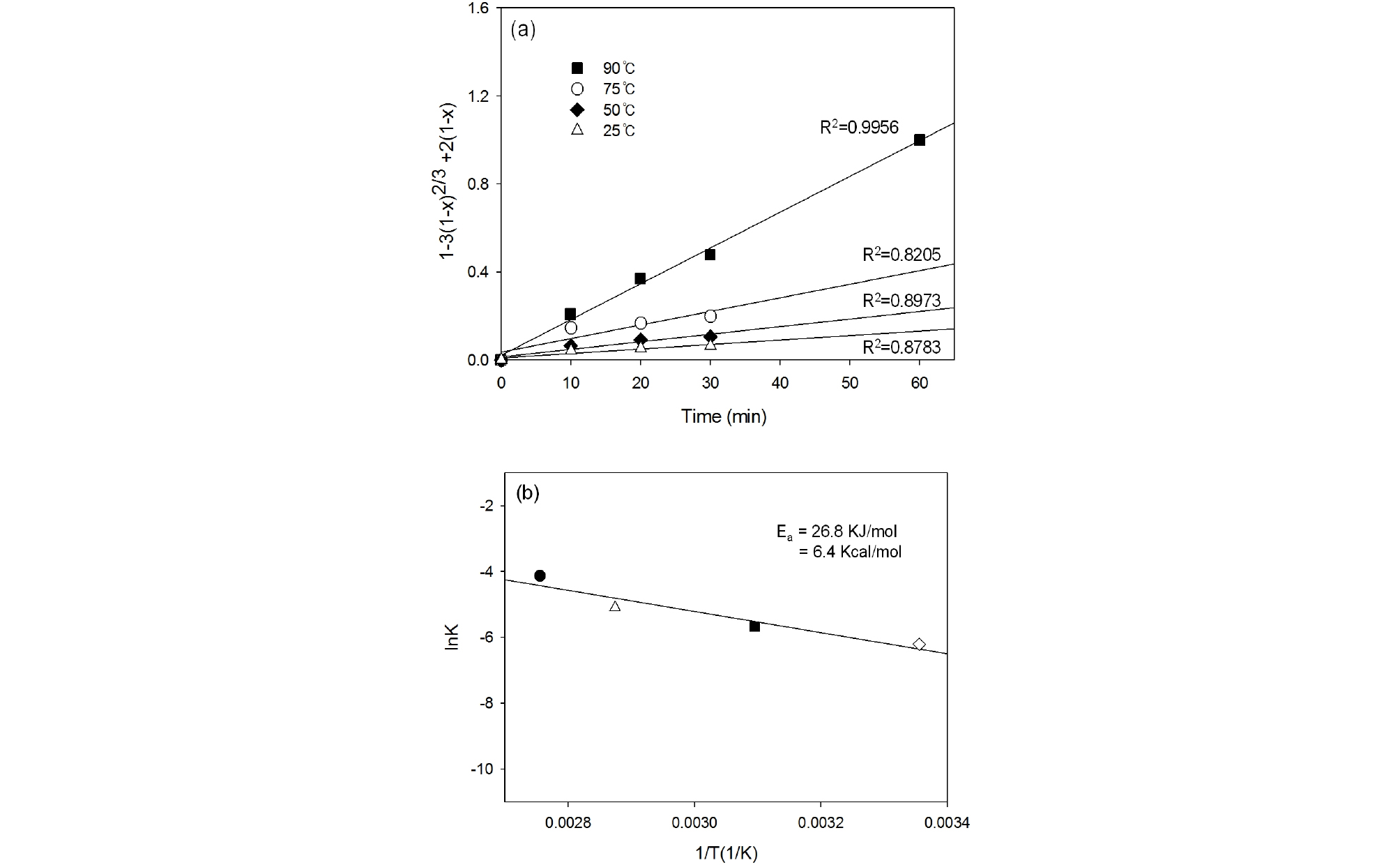
식 (4)~(6)에서 x는 침출율, k는 속도상수, t는 시간을 나타낸다. 3가지 식을 비교하여 각 그래프 중 R2(결정계수) 값이 가장 1에 가까운 모델을 구하고자 하였으며, Fig. 11(a)에서 보는 바와 같이 공극 확산율 속도반응식(pore diffusion control)에서 가장 1에 가까운 값을 보였다. 따라서 pore diffusion control 모델을 적용하여 활성화 에너지 값을 계산하였다.
| $$k\;=\;A\;exp\;(‑Ea/RT)$$ | (7) |
아레니우스 식 (7)에서 k는 속도상수, A는 잦음률, Ea는 활성화 에너지, R은 기체상수, T는 절대온도를 나타낸다. 아레니우스 식을 이용해 속도상수 k와 온도(1/T)의 관계를 나타내는 그래프를 Fig. 11(b)에 나타내었다. 일반적으로 Ea값이 10 kcal/mol를 초과하는 경우 화학율속(Chemical control), Ea값이 5 kcal/mol 미만일 경우 확산율속(Diffusion control), 5 kcal/mol 초과 10 kcal/mol 미만 사이의 Ea값을 갖는 다면 혼합된 반응(Mixed control)이다(Jung and Mishra, 2016). 본 연구의 경우 아레니우스 그래프를 통해 구한 활성화 에너지 Ea값이 6.4 kcal/mol이므로 팔라듐의 침출거동은 혼합된 반응이라는 것을 알 수 있다.
결 론
본 연구에서는 국내 석유화학산업의 수소첨가 크래킹 공정에서 발생하는 폐촉매로부터 귀금속인 팔라듐과 은의 효율적 회수를 위하여 질산과 염산에 의한 팔라듐과 은의 동시침출에 대한 연구를 수행하였다. 산에 의한 팔라듐과 은의 동시 침출에 대한 연구가 보고된바 없는 점에 착안하여 석유화학공정에서 발생하는 폐촉매로부터 팔라듐과 은의 질산 및 염산 침출 거동을 조사하고 팔라듐과 은을 동시에 침출할 수 있는 가능성을 살펴보았다. 아울러 질산과 염산의 농도, 침출온도와 시간, 광액농도 등 침출조건들이 팔라듐과 은의 침출거동에 미치는 영향을 조사하고 침출반응을 규명하고자 하였다. 각각의 침출거동을 조사, 비교하여 팔라듐과 은의 동시침출을 위한 최적침출조건을 도출하고 침출반응의 속도론적 고찰을 행하였다.
질산을 침출제로 사용하는 경우 질산농도 2.0 M, 침출온도 90°C, 침출시간 60분, 광액농도 100 g/L, 교반속도 350 rpm, 시료입도 –500/+212 µm의 침출조건에서 폐촉매로부터 100%의 은을 침출할 수 있었으나 팔라듐의 침출율은 약 45%에 불과 하였다. 또한 팔라듐 침출율의 향상을 위하여 산화제로 과산화수소를 첨가하였으나 효과가 없었다.
염산을 침출제로 사용하였을 때는 질산과는 달리 폐촉매로부터 팔라듐과 은의 동시침출이 가능하였다. 염산농도 4.0 M, 침출온도 90°C, 침출시간 60분, 광액농도 100 g/L, 교반속도 350 rpm, 시료입도 –500/+212 µm의 침출조건에서 폐촉매로부터 100%의 팔라듐과 은을 침출할 수 있었다.
폐촉매로부터 팔라듐의 염산침출반응은 Pore diffusion control 모델을 잘 따르는 것으로 분석되었고 이를 통해 속도상수를 구할 수 있었다. Arrhenius 식으로부터 계산한 활성화 에너지, Ea는 6.4 kcal/mol이었으며, 이로부터 팔라듐의 침출반응은 화학율속과 확산율속의 혼합율속반응임을 확인하였다.