서 론
실험재료 및 방법
금정광(gold concentrate)
심해저 망간각(deep-sea manganese crust)
토착호산성 박테리아
미생물용출(bioleaching)
결과 및 고찰
중합효소연쇄반응과 16S rRNA 염기서열에 의한 토착박테리아 동정
생물학적 산화에 의한 pH 및 Eh 변화
유용금속 용출
금정광 고체잔류물 내 Au, Ag 품위향상
결 론
서 론
금(gold, Au)은 일반적으로 황철석(pyrite)이나 황비철석(arsenopyrite)에 수반되어 주로 비가시성(invisible) 형태로 산출되며(Kim et al., 2013a), 비가시성 금은 황화광물 내 고용체로 존재하거나 다른 금속류와 화학적으로 합금을 형성하여 존재하기 때문에 심지어 전자현미경에서조차 관찰하기 매우 어렵다. 이런 이유로 인하여 비가시성 금을 함유한 황화광물을 미분쇄하여 단체분리(liberation)하기란 사실상 불가능하다(Goodall et al., 2005). 따라서 비가시성 금을 효과적으로 회수하기 위해서는 전처리과정이 필요하며, 이때 전처리 방법으로 소성, 고압산화, 미생물산화 등이 있다(Brierley, 2003). 이중 소성 및 고압산화 전처리 방식이 제련작업에서 가장 많이 활용되고 있으며, 부가적으로 친환경적 전처리 방법으로서 미생물에 의한 생물학적 산화방법 또한 적용되고 있다(Deng et al., 2000; Ningfei and Hongguan, 2012). 다만 미생물에 의한 전처리 방법은 화학적 전처리 방법에 비하여 환경적으로나 경제적인 측면에서는 유리하나 처리기간이 길고 용출 효율이 낮은 단점이 있다(Deng et al., 2000; Nestor et al., 2001).
미생물에 의한 전처리 방법은 박테리아의 생물학적 산화작용을 이용하여 비가시성 금정광의 품위를 향상시키는 방법으로서, 박테리아가 금을 포획하고 있는 황화광물을 산화시키도록 하는 것이다. 황철석(FeS2)의 경우 산화 박테리아에 의해 Fe2+(ferrous iron)은 Fe3+(ferric iron)으로, S-1 (sulfide)는 S6+의 황산염(sulfate)으로 각각 산화된다. 이때 박테리아가 황화광물 표면에 직접 접촉하거나(직접접촉산화) 부유상태로 존재(간접접촉산화)함으로서 황화광물의 산화 속도를 촉진시킬 수 있다. 일반적으로 박테리아의 생물학적 산화작용은 황화광물이 소진될 때까지 진행되므로 생물학적 산화가 진행되는 동안 지속적으로 황화광물의 크기와 체적은 감소된다. 이러한 황화광물의 산화과정 중 황화광물 내부에 포획되어 있거나 황화광물과 고용체를 이루고 있던 비가시성 금은 황화광물 표면으로 노출되거나 단체분리 될 수 있다. 이에 박테리아의 생물학적 산화작용을 포함한 shrinkage core model을 적용하여 황화광물로부터 비가시성 금의 품위를 향상시킨 사례가 있다(Lynn, 1997; Lindstrom et al., 2003).
일반적으로 황화광물 내 금회수를 위한 산성의 용출 작업 시 산화제를 첨가하면 황화광물의 산화가 매우 빠르게 진행되며(Li and Miller, 2007; Yang et al., 2011), 실제 금 용출을 위한 용매제로 사용되는 티오요소(thiourea)와 차아염소산(hypochlorite)에 산화제로 Fe2(SO4)3, CuSO4, H2O2, Na2O2 등이 활용되고 있다(Kim et al., 2013b, Kim et al., 20013c; Cho et al., 2012). 본 연구에서는 비가시성 금정광 내 Au, Ag 등 유용금속의 품위를 향상시키기 위하여 토착박테리아의 산화 기작을 활용하였다. 이때 산화 기작의 촉진을 위하여 무기 광물질 중 망간각(manganese crust)을 산화제로 첨가하여 용출 기작 내 발생하는 다양한 생지구화학반응을 고찰하고자 하였다. 실제 황화광물을 산화용해 시키기 위해 망간단괴(manganese nodule)나 망간각(manganese crust)을 산화제로 활용한 사례가 보고된 바 있다(Yaozhong, 2004; Zhang and Cheng, 2007).
실험재료 및 방법
금정광(gold concentrate)
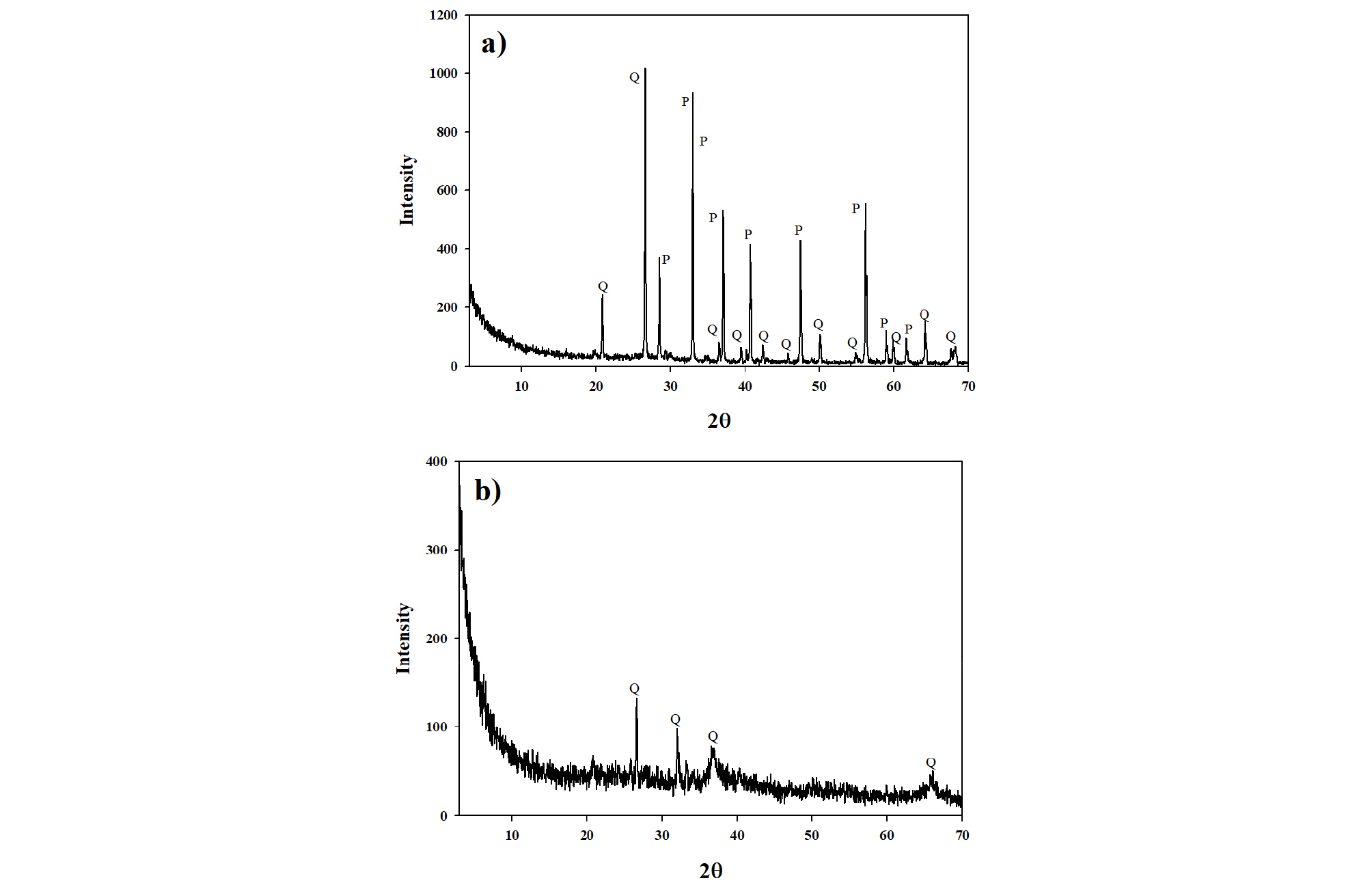
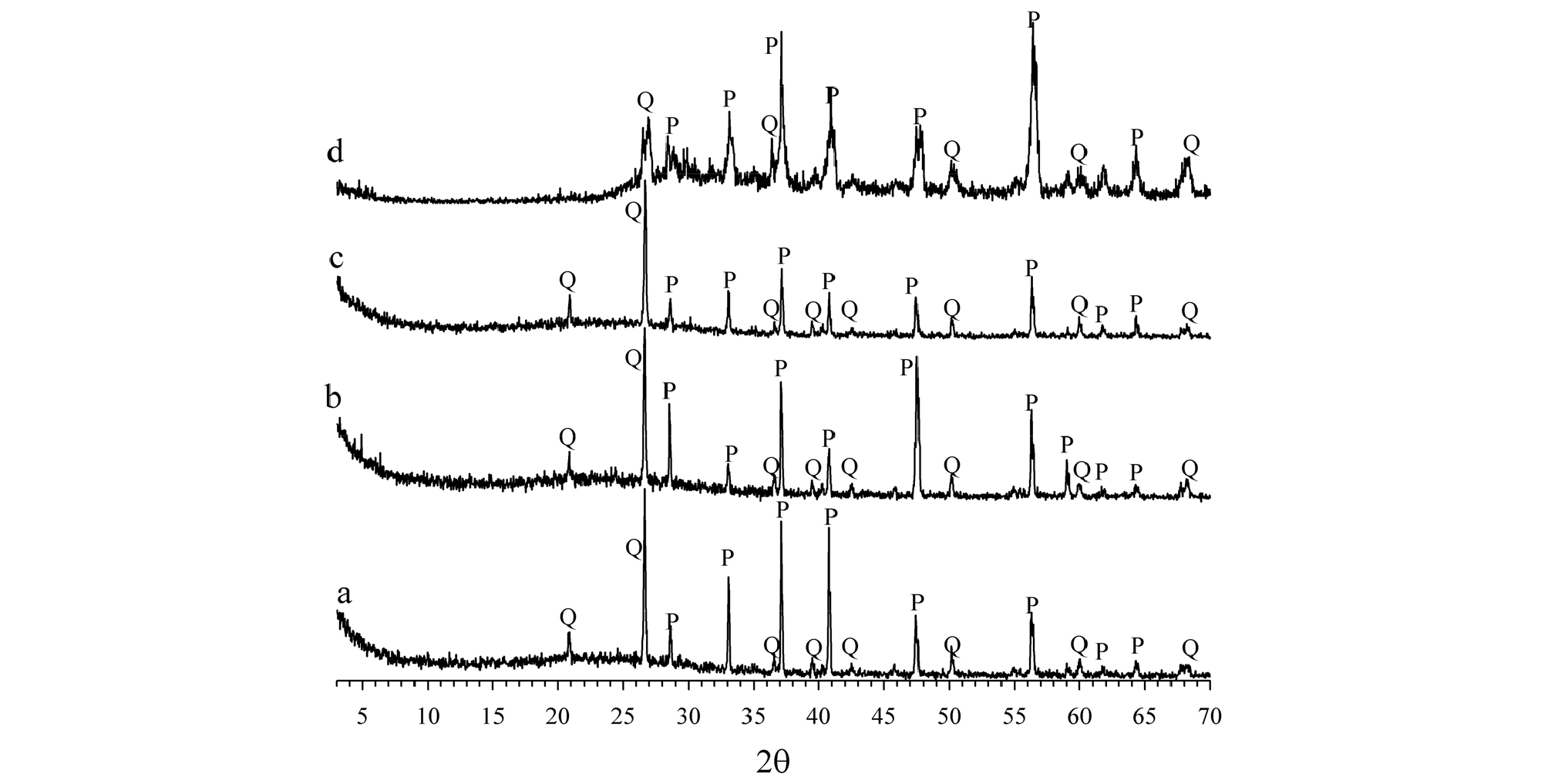
본 연구에서 유용금속 품위향상에 사용된 금정광은 전남 해남군 모이산 광산에서 제공받았으며, 이 정광은 지하 80 m에서 120 m 내 광석광물을 채광하여 부유선별한 것이다. 제공받은 금정광시료는 먼저 50°C의 초음파세척기에서 아세톤(acetone)으로 30분 동안 3회 반복 세척한 후 증류수에 2일 동안 방치하였다. 이후 세척된 정광시료는 자연건조 후 미생물 용출실험에 사용하였다. 세척건조된 금정광 시료의 XRD 분석 결과 석영과 황철석의 피크선이 관찰되었으며(Fig. 1(a)), 화학조성 분석을 위한 왕수분해 결과는 Table 1에 정리하였다. 금정광 내 Au, Ag, Te이 각각 130, 954, 1,043 mg/kg으로 함유되어 있으며, 6,845 mg/kg의 Fe 함량은 황화광물로 존재하는 고함량의 Fe을 의미하고, 이는 XRD 분석 결과 내 황철석의 존재와도 일치한다.
Table 1. Chemical composition of gold concentrate and manganese crust used in this study
| Elements | Gold concentrate (mg/kg) | Manganese crust (mg/kg) |
| (A) | (B) | |
| Au | 130 | 0.8 |
| Ag | 954 | 0.0 |
| Te | 1,043 | 0.0 |
| Fe | 6,845 | 1,254 |
| Cu | 301 | 62.4 |
| Mn | 5.5 | 19,501 |
| Ni | 13.2 | 152 |
| Co | 3.5 | 400 |
| Cr | 0.0 | 96.8 |
| Se | 316 | 0.0 |
심해저 망간각(deep-sea manganese crust)
본 연구 내 미생물 용출실험에서 산화제로 사용한 심해저 망간각은 한국해양과학기술원(KIOST)에서 제공받았으며, 해당 망간각 시료(KODOS 02-02-FFG16)는 위도 10.77833°N, 경도 135.542°W의 수심 5,500 m에서 채취되었다. 채취된 망간각은 200 mesh로 미분쇄하여 XRD 분석, 왕수분해 및 미생물 용출실험에 사용하였다. 망간각 시료는 주로 비정질로 구성되어 있으며(Acharya et al., 1999), XRD 분석 결과 석영의 피크선이 약하게 관찰되었다(Fig. 1(b)). 망간각 시료의 왕수분해 결과 Mn은 약 20 g/kg 수준으로 높게 함유되어 있고, Au, Ag, Te, Se은 금정광 시료와 달리 그 함유량이 없거나 매우 적음을 확인할 수 있다(Table 1).
토착호산성 박테리아
본 연구에서 금정광의 미생물 용출을 위해 사용된 박테리아는 금정광이 산출된 동일 광산 내 지하 82 m 광산배수(pH: 4.62, Eh: 365 mV)에 서식하는 토착박테리아를 활용하였다. 토착박테리아의 배양을 위해 광산배수 10 mL를 채취하여 미리 준비한 성장배양액(150 mL)에 접종하여 32°C 항온배양기에서 성장시켰다. 이때 성장배양액의 조성은 무기성분과 에너지원으로 구성되며, 무기성분은 0.2 g (NH4)2SO4, 0.5 g MgSO4·7H2O, 0.25 g CaCl2 및 3.0 g KH2PO4를 3차 증류수 1.0 L에 용해시켜 제조하고, 에너지원은 1.0 g/L 황 분말과 5.0 mg/L FeSO4·7H2O을 사용하였다. 성장배양액 내 토착박테리아는 32°C에서 28일을 주기로 4년 7개월 동안 계대배양(subculture)을 실시하였다.
또한 계대배양 된 일부 토착박테리아에 대해 중금속에 대한 내성(tolerance)을 부여하기 위하여 CuSO4·5H2O을 성장배양액에 첨가하여 21일을 주기로 20회 적응(adaptation)시켰다. 금정광 내 존재하는 Cu 함유광물로부터 용해된 Cu 이온은 박테리아의 성장을 방해할 수 있기 때문에(Tuovinen et al., 1971) 일부 시료에 대해 적응배양을 실시하였으며, 이후 미생물 용출시험에 있어 중금속 적응박테리아(adapted bacteria)와 비적응박테리아(non-adapted bacteria)를 구분하여 적용하였다.
미생물용출(bioleaching)
미생물 용출실험은 계대배양 이후 Cu 중금속에 적응배양 유무에 따라 적응박테리아와 비적응박테리아로 구분하고, 각 박테리아 배양액 300 mL에 대해 0.2 µm 여과지 분리를 통한 최종 10 mL 박테리아 농축액을 시험에 사용하였다. 미생물 용출실험에 대한 상세 시험조건을 Table 2에 기재하였다. 본 연구에서는 금정광의 산화용출에 대한 1) 박테리아 존재의 영향, 2) 중금속 적응박테리아의 영향, 3) 망간각 산화제 첨가 영향 등을 시험조건을 통해 평가하고자 하였다. 최종 실험을 위한 용출배양액(medium)의 부피는 1,000 mL로 고정하였고, 그 pH는 H2SO4을 첨가하여 4.5로 조정 후 용출실험이 진행되는 동안 추가적인 pH 조정은 실시하지 않았다. 각 시험조건의 용출실험은 가열교반기에서 32°C로 유지하면서 7.0 cm3/min의 공기 주입과 200 rpm 속도의 magnetic bar 교반을 실시하였다.
Table 2. Experimental conditions on the bioleaching of gold concentrate under the initial pH of 4.5, air sparging of 7.0 cm3/min., and 32°C with magnetic stirring with 200 rpm
| Exp. | Medium | Non-adapted bacteria | Adapted bacteria | Gold concentrate | Manganese crust |
| mL | mL | mL | g | g | |
| A | 1000 | - | - | 10 | 10 |
| B | 990 | 10 | - | 10 | 10 |
| C | 990 | - | 10 | 10 | - |
| D | 990 | - | 10 | 10 | 10 |
미생물용출실험 동안 용출배양액의 pH(Horiba, Japan)와 Eh(Thermo Orion 3star)를 정기적으로 측정하였다. 그리고 용출배양액 내 부유성 박테리아는 0.1 µm 여과지로 여과하여 2.5%의 글루타르알데히드(glutaraldehyde)를 첨가하여 1차 고정시키고, 75, 85, 95, 99%의 에틸알콜(ethyl alcohol)로 탈수 후 2시간 동안 자연건조를 실시하였다. 이후 백금 코팅을 거쳐 전자현미경(electron scanning microscope, Japan, Hitachi, S4800)으로 관찰하였다. 또한 반응 중 용출배양액 내 금속종의 함량분석을 위하여 계획된 시간에 따라 2.0 mL의 분석용액을 채취하여 원자흡광분광기(AA- 7000, Shimadzu, Japan)를 이용하여 분석을 실시하였다. 반응 중 채취된 분석용 시료의 양만큼 성장배양액을 첨가하고, 증발손실 된 양은 증류수로 보충하여 지속적으로 용출배양액의 부피는 1,000 mL를 유지하도록 하였다. 미생물용출실험의 종료 이후 최종 용출배양액은 0.2 µm 여과지로 여과하여 용출 고체잔류물을 채취하였다. 고체잔류물은 증류수 세척과 자연건조 후 왕수분해 및 XRD(X'Pert Pro MRD(MRD), PANalytical, Netherlands)분석에 사용하였다.
결과 및 고찰
중합효소연쇄반응과 16S rRNA 염기서열에 의한 토착박테리아 동정
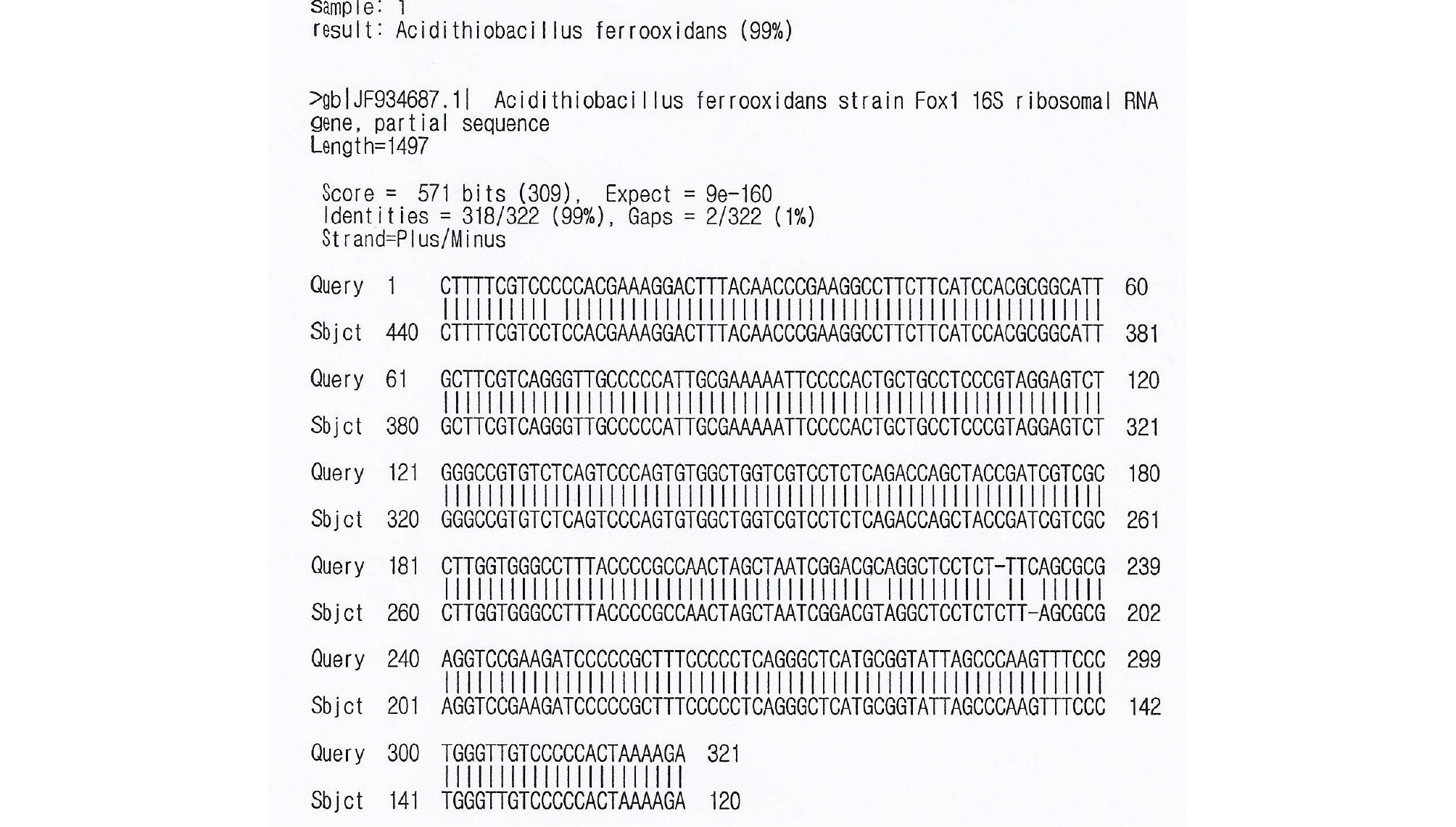
계대배양 된 토착박테리아에 대한 16S rRNA 염기서열은 ATCC 23270 표준균주인 Acidithiobacillus ferrooxidans의 염기서열과 pairwise 비교 정렬(alignment sequence)로 검사하였고, 그 결과를 Fig. 2에 정리하였다. 계대배양 된 토착박테리아에 대해 16S rRNA 동정을 실시하여 본 연구에서 사용된 토착박테리아는 Acidithiobacillus ferrooxidans 종(species)임을 확인하였다(Kim et al., 2012a, Kim et al., 2012b; Choi et al., 2013). 분석된 염기서열을 EzTaxon server를 이용하여 동정하였으며, 그 결과에 따른 유사도(similarity)가 99%로 나타났다. 일반적으로 16S rRNA 유전자 유사도지수가 97% 이상으로 나타나면 동일 균주로 분석 될 수 있기 때문에 본 토착박테리아는 Acidithiobacillus ferrooxidans 종(species)에 해당한다고 볼 수 있다.
생물학적 산화에 의한 pH 및 Eh 변화
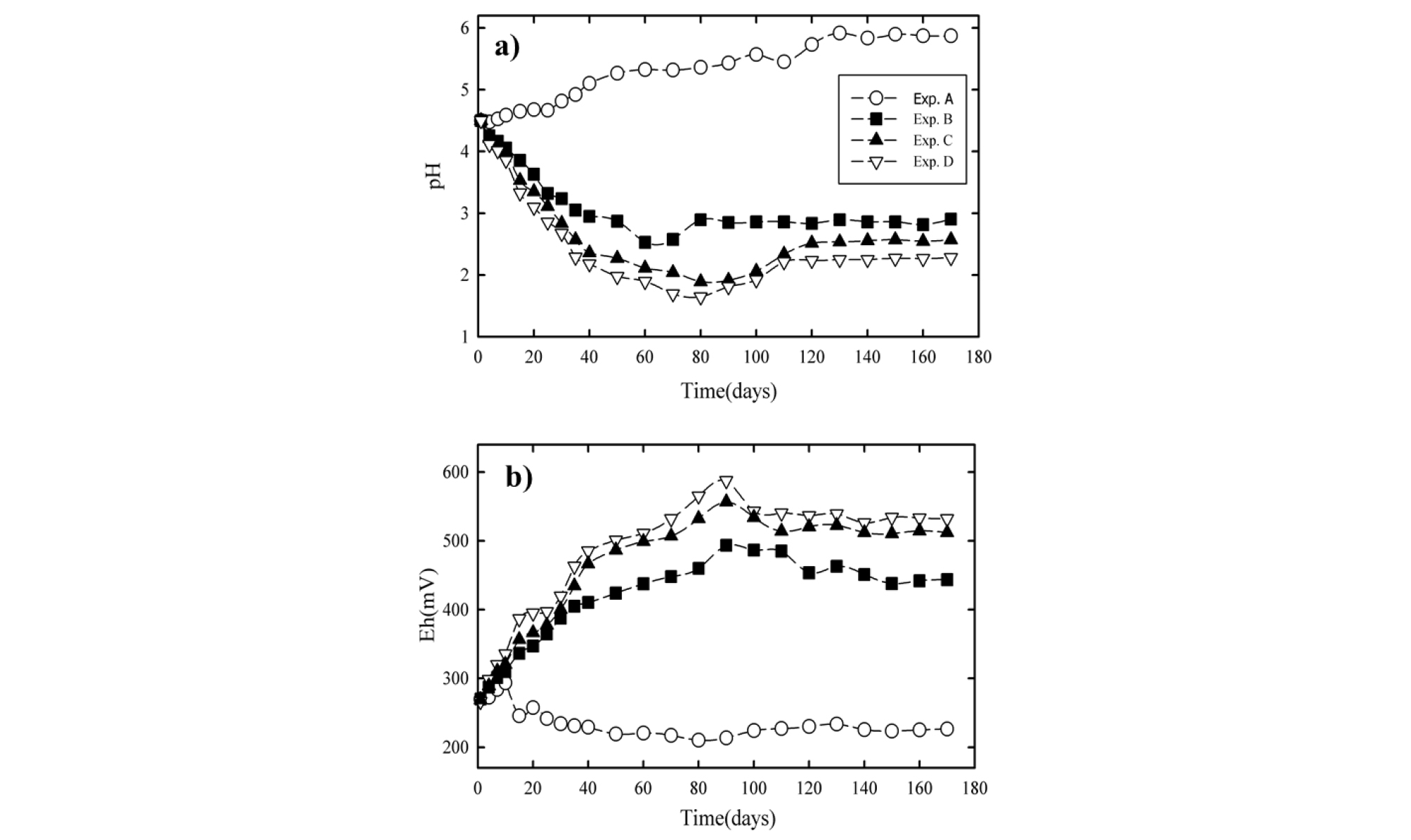
금정광 내 유용금속의 품위향상을 위한 산화용출실험의 조건을 상기 Table 2에 제시한 바 있다. Exp. A에서는 박테리아 없이 산화제로서 망간각만을 첨가하여 무기적 산화용출을 확인하고자 하였고, Exp. B에서는 중금속에 대한 비적응박테리아의 산화용출 정도를 평가하고자 하였다. Exp. C와 Exp. D에서는 중금속 적응박테리아를 반응에 적용하되, 산화제로서의 망간각의 촉진 역할을 판단하고자 하였다. 각 산화용출실험의 조건에 따라 반응 중 주기적으로 pH 및 Eh를 측정하여 그 결과를 Fig. 3에 도시하였다.
본 연구에서 금정광의 산화용출을 위한 배양액의 초기 pH는 4.5로 고정되었으나, 박테리아의 존재유무에 따라 반응에 따른 pH 변화는 상이하게 나타났다. 박테리아를 배제하여 무기적인 산화용출만을 시도했던 Exp. A의 경우 산화용출이 진행됨에 따라 pH는 증가하였으며 실험 종료 170일에는 5.9까지 증가하였다. 반면 박테리아를 산화용출에 사용했던 Exp. B, C 및 D의 경우 산화용출이 진행됨에 따라 pH는 반응 70일까지 급격히 감소하다가 이후 안정화 단계로 진입하였으며 실험 종료 170일에는 각각 2.9, 2.6, 2.3으로 측정되었다(Fig. 3(a)). 금정광의 산화용출반응에 따른 Eh 변화는 pH 변화와 정확히 반대의 경향으로 감소(Exp. A) 또는 증가(Exp. B, C, D)하는 경향을 보였다(Fig. 3(b)).
일반적으로 실험조건의 용출과정 동안 금정광 내 황화광물 및 산화제로 첨가된 망간각의 화학반응은 식 (1), (3) 및 (5)와 같이 나타날 수 있다. 또한 이들을 Nernst 식으로 표현하면 식 (2), (4) 및 (6)과 같이 Eh는 Mn2+, Fe2+, SO42- 및 pH의 함수로 표현될 수 있다(Nakazawa and Sato, 1995). 박테리아에 의한 생물학적 산화가 촉진되었을 때 금정광 내 황화광물의 산화용해반응은 더욱 가속화되며, pH는 감소하고 Eh는 증가하게 된다(Mousavi et al., 2007; Schippers, 2007). 반면 망간각의 경우 환원용해 되면서 pH는 증가하고 Eh는 감소하게 된다. 따라서 박테리아가 배제되었던 Exp. A 시험 조건에서 반응정도에 따라 pH가 증가하고 Eh가 감소하는 원인은 금정광 내 황화광물의 산화용해에 비해 망간각의 용해가 더 우세하였음을 지시한다.
| $$FeS_2+8H_2O=Fe^{2+}+2SO_4^{2-}+16H^++14e^-$$ | (1) |
| $$Eh=0.367+0.0042\log\lbrack Fe^{2+}\rbrack+0.0084\log\lbrack SO_4^{2-}\rbrack-0.0676pH$$ | (2) |
| $$FeS=Fe^{2+}+S^0+2e^-$$ | (3) |
| $$Eh=0.424+0.0295\log\lbrack Fe^{2+}\rbrack$$ | (4) |
| $$MnO_2+4H^++2e^-=Mn^{2+}+2H_2O$$ | (5) |
| $$Eh=1.228-0.1182pH-0.0295\log\lbrack Mn^{2+}\rbrack$$ | (6) |
배양된 토착박테리아에 중금속 적응을 실시하지 않은 시료를 사용하여 금정광의 용출을 실시한 Exp. B에서는 무기조건의 Exp. A와 달리 금정광 내 황화광물의 산화용해가 우세하여 반응에 따라 pH가 감소하고 Eh가 증가하는 경향을 보였다(Fig. 3). 다만 적응박테리아를 사용한 Exp. D에서 Exp. B에 비해 pH 감소 및 Eh 증가 경향이 더 뚜렷하고, 이는 장기간 동안 중금속(Cu 이온)에 적응된 박테리아가 금정광을 산화용해시키는 동안 지속적으로 기여하였음을 지시한다(Xia et al., 2008; Haghshenas et al., 2009). 실제 적응박테리아와 산화제로서의 망간각을 사용한 Exp. D 조건에서 용출실험 80일과 90일 사이에 가장 낮은 pH(1.64)와 가장 높은 Eh 값(587mV)을 보이고 있으며(Fig. 3), 본 연구에서 진행한 실험조건에 비추어 약 100일 정도에 반응이 거의 평형에 도달함을 알 수 있다.
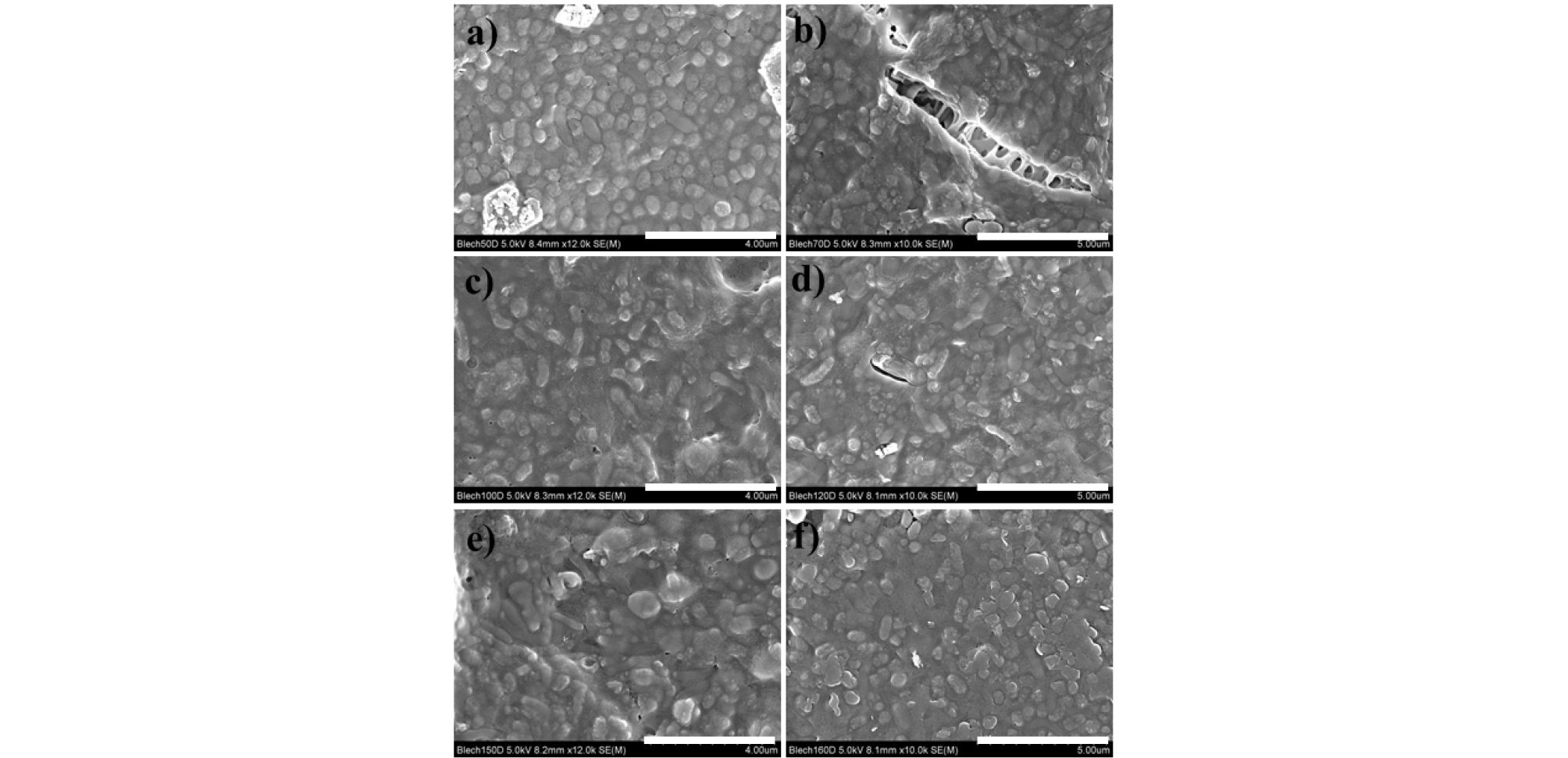
금정광의 산화용출반응 동안 박테리아의 활동 및 기여를 확인하기 위하여 Exp. D 실험시료의 반응 중 채취된 용출용액 내 부유성 박테리아를 관찰하였다(Fig. 4). 금정광의 생물학적 산화용출반응이 50, 70, 100, 120, 150 그리고 160일 경과했을 때에도 용출용액 내 부유성 박테리아를 확인할 수 있었고, 이는 해당 반응시간 동안 지속적으로 박테리아에 의한 금정광 내 황화광물의 산화용해가 진행되었음을 의미한다(Silverman, 1967). 금정광의 생물학적 산화용출반응 동안 식 (7)에서 (9)와 같이 황화광물 내 철과 황을 산화시키는 산화제로 작용했을 것이다(Bosecker, 1997).
| $$MeS+2O_2\rightarrow bacteria\rightarrow MeSO_4$$ | (7) |
| $$MeS+Fe_2(SO_4)_3\rightarrow MeSO_4+2FeSO_4+S^0$$ | (8) |
| $$2S^0+3O_2+2H_2O\rightarrow bacteria->2H_2SO_4$$ | (9) |
본 연구 내 실험조건(Table 2)에서는 금정광의 생물학적 산화반응에 산화제로서의 무기광물질(망간각)의 영향을 파악하고자 하였다. 망간각을 첨가하지 않은 반응 조건(Exp. C)에 비해 산화제로서 첨가한 조건(Exp. D)에서 pH가 더 낮게 감소하고 Eh는 더 크게 증가하였다(Fig. 3). 이는 용출용액이 전해질의 역할을 하고, 혼합형태로 반응용출용액에 존재하는 환원형태의 금정광 내 황화광물과 산화물 상태의 망간각 사이에 산화환원전위(redox potential)가 형성되었기 때문이다. 즉, 갈바니 전지(Galvanic cell)의 원리와 같이 정지전압(rest potential)이 큰 망간각(MnO2)과 정지전압이 비교적 적은 황화광물이 각각 음극(cathode)과 양극(anode)으로 작용하고(Madhuchhanda et al., 2000a, Madhuchhanda et al., 2000b), 황화광물에서는 (10)과 (11)식과 같이 산화반응이 발생하면서 동시에 망간각에서는 식 (12)와 같은 환원반응이 발생하여 금정광 내 황황광물의 산화용출을 더욱 촉진하였음을 알 수 있다(Gantayat et al., 2000; Xiao et al., 2007).
| $$MeS_x=Me^{2+}+xS+2e^-$$ | (10) |
| $$MeS_x+4xH_2O=Me^{2+}+xSO_4^{2-}+8xH^++(2+6x)e^-$$ | (11) |
| $$MnO_2+4H^++2e^-=Mn^{2+}+2H_2O$$ | (12) |
유용금속 용출
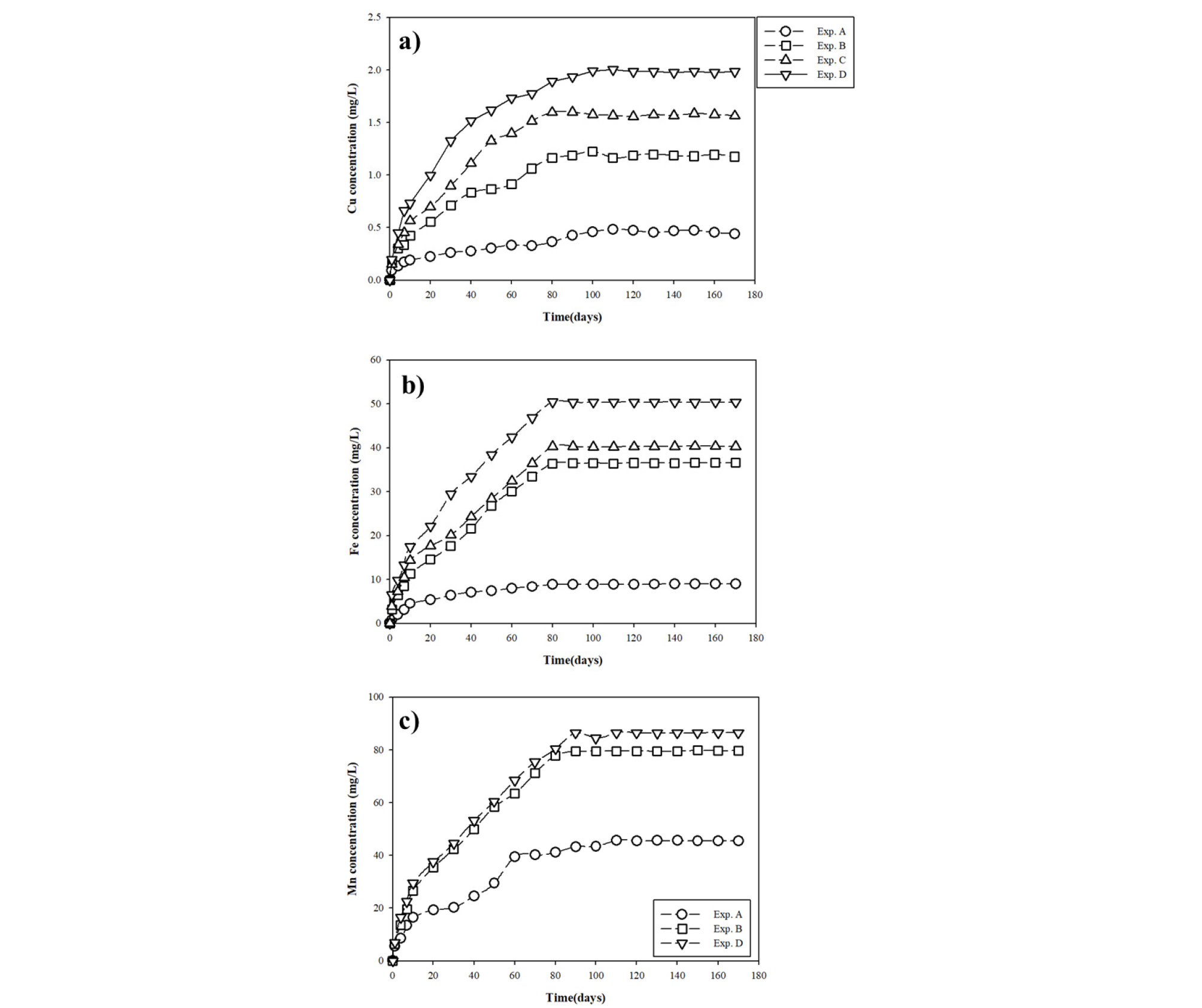
실험조건에 따른 금정광의 산화용출이 진행됨에 따라 용출반응액을 채취하여 반응액 내 Cu, Fe, Mn 함량을 분석하여 그 결과를 Fig. 5에 도시하였다. 용출반응액 내 Cu 및 Fe 이온은 금정광 및 망간각의 용해로부터 기인하며, 반응시간에 따른 pH 및 Eh 측정결과와 비슷하게 반응시간 약 100일까지 그 함량이 증가하다가 이후 일정한 함량을 유지함을 확인할 수 있다. 용출함량 또한 실험조건에 따라 Exp. A < B < C < D 순서대로 더 높게 나타났으며, 이는 박테리아의 산화 및 산화제로서 망간각의 첨가가 더욱 반응을 촉진시켰음을 지시한다.
용출반응용액 내 Mn 이온은 식 (12)와 같이 망간각의 환원용해로부터 기인하며, 산화제로서 망간각을 부여하지 않은 Exp. C에서 Mn 이온은 검출되지 않았다. 용출된 Mn 이온의 함량도 실험조건에 따라 Exp. A < B < D 순서대로 더 높게 나타났으며, 이는 망각간의 환원용해에 필요한 수소 이온(H+) 및 전자(electron)를 금정광 내 황화광물의 생물학적 산화로부터 충분히 공급하였음을 지시한다(Gantayat et al., 2000).
본 연구에서는 금정광 내 유용금속의 품위향상의 목적으로 생물학적 산화용출을 실시하였으며, 반응 과정 중 부산물로서 반응용출액 내 다양한 금속류들(Cu, Fe 및 Mn)의 존재를 확인할 수 있었다. 반응용출액 내 존재하는 이들 유용금속 이온들은 용매추출이나 전기분해로 회수할 수 있으나(Torma, 1984; Ritcey, 2006) 본 연구에서는 다루지 않기로 한다.
금정광 고체잔류물 내 Au, Ag 품위향상
금정광 내 목적금속(Au, Ag)의 품위향상을 위하여 박테리아와 망간각을 활용하여 산화용출을 진행하고, 용출용액 내 금정광 고체잔류물을 회수하여 왕수분해를 통해 화학조성을 분석하였다(Table 3). Table 1 내 금정광의 화학조성과 비교하면 산화용출 이후 금정광 잔류물에서 Fe와 Cu의 함량은 감소하고 Au 및 Ag의 함량은 증가하였다. 이는 금정광의 산화용출이 진행되는 동안 금정광 내 황화광물 표면의 Fe와 Cu는 용해 제거되고 비가시성 Au 및 Ag가 노출(shrinkage core model)되었기 때문이다. 다만 Table 3 내 Exp. A에서 회수된 금정광 잔류물의 Fe와 Cu의 함량이 용출시험 이전 금정광 Fe와 Cu 함량(Table 1)에 비해 다소 높게 분석되었으나 이는 산화용출 반응 이후 금정광 고체잔류물을 회수하는 과정에서 혼합된 망간각 불순물의 영향과 이온간 간섭인 것으로 판단된다. 금정광 고체잔류물 내 목적금속(Au, Ag)의 경우 산화용출 실험조건 Exp. A < B < C < D 순으로 높게 분석되었다(Table 3). 금정광 내 금(Au)의 품위는 산화용출 이전 함량(130 mg/kg, Table 1)에 비해 실험조건 Exp. A, B, C 및 D에서 각각 2.3%, 16.2%, 23.8% 및 33.1% 만큼 향상되었다. 또한 금정광 내 은(Ag)의 품위는 산화용출 이전 함량(954 mg/kg, Table 1)에 비해 실험조건 Exp. A, B, C 및 D에서 각각 3.0%, 7.5%, 11.0% 및 33.1% 만큼 향상되었다. 본 실험을 통하여 금정광 내 Au 및 Ag의 품위 향상을 위해 생물학적 산화 및 산화제 첨가에 대한 효율을 재고할 수 있었다.
Table 3. Chemical composition (mg/kg) of the gold concentrate residues after (bio-)leaching experiment.
| Elements | Exp. A | Exp. B | Exp. C | Exp. D |
| Au | 133 | 151 | 161 | 173 |
| Ag | 983 | 1,026 | 1,059 | 1,270 |
| Fe | 7,254 | 4,325 | 4,135 | 3,046 |
| Cu | 315 | 257 | 220 | 175 |
용출실험 종료 이후 남은 고체 잔류물에 대한 XRD 분석 결과, 석영과 황철석이 동정되었고(Fig. 6), 금정광의 용출 전후 시료에 대한 XRD 광물 동정의 결과에서 유의미한 차이가 없음을 확인하였다.
결 론
금정광 내 Au 및 Ag의 품위를 향상시키기 위해 박테리아의 생물학적 산화 및 망간각 산화제를 적용하여 산화용출 동안 발생하는 다양한 생지구화학 반응을 고찰하고자 하였다. 생물학적 산화에 사용된 박테리아는 광산배수에서 서식하는 토착박테리아를 배양하여 활용하였으며, 종 분석 결과 철과 황을 동시에 산화시킬 수 있는 Acidithiobacillus ferrooxidans 로 확인되었다. 또한 실험조건에서 금정광의 산화용출은 박테리아의 기여가 없는 경우(Exp. A), 중금속 비적응박테리아(Exp. B), 중금속 적응박테리아(Exp. C)의 적용 및 산화제로서의 망간각 첨가(Exp. D)로 구분하여 실시하였다. 실험조건 내 금정광의 산화용출이 진행되는 동안(Exp. B, C, D) 황화광물의 산화에 의해 pH는 각각 2.9, 2.6, 2.3으로 감소하였고, 산화환원전위(Eh)는 반대로 증가하였다. 금정광 용출실험 동안 용출용액 내 Cu, Fe 및 Mn 이온은 그 함량이 증가하다가 실험조건 약 100일 이후 평형에 도달함을 확인할 수 있었다. 금정광의 박테리아 산화용출에 있어 pH, Eh 및 용출용액 내 용해 금속류의 함량 변화는 실험조건에 따라 Exp. A < B < C < D 순서대로 그 변화가 크게 나타났는데, 이는 적응박테리아를 활용한 금정광의 생물학적 산화용출이 황화광물의 산화에 효과적이며, 이때 무기적 산화제 첨가가 더욱 산화반응을 촉진시킬 수 있음을 지시하고 있다. 최종적으로 박테리아의 생물학적 산화와 망간각 산화제가 첨가된 금정광의 용출실험(Exp. D) 종료 이후 회수된 금정광 잔류물에서 Au과 Ag의 품위가 동일하게 33.1% 향상되었음을 확인하였다. 생물학적 산화용출을 포함한 용출조건의 최적화 기술개발을 통해 금정광 내 Au 및 Ag의 품위 향상은 물론 용출용액으로부터 기타 유용금속의 회수 또한 향후 기대된다.