서 론
희토류 광물
바스트나사이트(Bastnaesite)
모나자이트(Monazite)
제노타임(Xenotime)
이온흡착형 광물(Ion-adsorption clay)
희토류 광물에 따른 부유선별 연구동향
바스트나사이트의 부유선별
모나자이트의 부유선별
제노타임의 부유선별
결 론
서 론
희토류(Rare Earth Element)는 원자번호 57번 란타넘(Lanthanum)부터 71번 루테튬(Lutetium)까지의 란타나이드 족(Lanthanaide group) 원소, 스칸듐(Scandium, 21번), 그리고 이트륨(Yttrium, 39번)을 포함한 17개의 원소를 의미한다. 이들 원소는 4f 부껍질(Subshell)내에서 전자가 쌍을 이루는지의 여부에 따라서 홀전자로 존재하는 경희토류(LREE, Light Rare Earth Element)와 전자쌍을 이루는 중희토류(HREE, Heavy Rare Earth Element) 그룹으로 구분된다. 경희토류 원소에는 란타넘(La, 57번)부터 유로퓸(Eu, 63번)까지, 중희토류 원소에는 가돌리늄(Gd, 64번)부터 루테튬(Lu, 71번)으로 구분되며 원자의 직경 및 화학적 특성이 비슷한 이트륨(Y)은 중희토류 원소에 포함된다. 스칸듐은 경희토류 및 중희토류 그룹에 포함되기 위한 화학적 유사성이 존재하지 않아 이들 그룹에는 포함되지 않는다. 지각을 구성하는 원소 중 희토류 원소가 차지하는 비율은 그 명칭만큼 희유하지 않다. 희토류의 매장량은 귀금속인 금(5×10-7 wt.%), 은(1×10-5 wt.%)등과 같은 원소보다 많은 양이 매장되어 있으며, 구리, 납, 아연, 니켈 등과 같은 원소와 대등한 양이 매장되어 있다(Haxel et al., 2002, Golev et al., 2014). Fig. 1은 란타나이드 족 원소의 지각 내 구성 비율을 나타내고 있으며, 희토류 원소 내에서도 각각의 매장량의 큰 편차가 존재하는 것을 확인할 수 있다(Gupta and Krishnamurthy, 2005; Trifonov, 1963). 하지만 순수한 상태의 물질로 자연에 존재하지 않고 다양한 종류의 광물에 혼재되어 존재하며, 상업적으로 개발 가능한 품위의 광물이 부존 된 지역이 부족하여 몇몇 대규모 광산으로부터 공급을 의존하고 있다는 것이 희토류 원소를 더욱 희귀하게 만드는 요인으로 보고된다(Humphries, 2012). 또한, 희토류 원소들은 이온 반경이 비슷한 특성을 가지고 있어, 광물의 격자 내에서 상호 호환하여 존재할 수 있으므로 원소들의 분리가 어려운 점이 특징이다(Gupta and Krishnamurthy, 2005).
최근 첨단기술의 발전으로 인해 다양한 산업 분야에서 희토류의 수요가 증가하고 있으며, 각각의 원소가 갖는 고유한 성질 때문에 희토류는 첨단 산업에서 대체될 수 없는 물질로 여겨지고 있다. 희토류가 사용되는 산업에는 영구자석, 배터리, 금속 합금, 석유정제, 차량 촉매, 세라믹, 디스플레이 분야 등이 있으며, 각각의 산업에 사용되는 희토류 원소의 종류와 전체 희토류 사용량 중 각각의 원소가 차지하는 비율을 Table 1에 나타냈다(Long et al., 2010). Table 1에서와 같이 전체 희토류 원소의 수요 중 인광체 및 세라믹 산업을 제외한 대부분이 경희토류에 편중되어 있는 것을 확인할 수 있으며, Alonso et al.(2012)에 따르면 2007년 기준 전체 희토류 원소의 수요 중 80% 이상이 경희토류 원소가 차지한다고 보고되었다. Table 2는 국가별 희토류의 생산량과 매장량을 보여주고 있다. 2010년 기준 전 세계 희토류 생산량의 95%이상이 중국에서 생산되었지만, 그 의존도가 점차 감소하여 2018년 기준 총 희토류 생산량에 대한 중국내 생산 비율이 70%로 감소하였다(USGS 2011, 2013, 2015, 2017, 2019). 하지만 여전히 70%이상의 희토류가 중국으로부터 생산되고 있으며, 특히 첨단산업용 중희토류의 생산은 대부분 중국에 국한되어 있는 실정이다.
Table 1.
Application of rare earth elements and its requirement on the each industry (Long et al., 2015) (Unit. %)
Table 2.
현재까지 희토류 원소를 함유하고 있는 광물은 산화물, 할로겐화물, 탄산염, 규산염, 인산염 광물 등 250여 가지 이상인 것으로 알려져 있다. 희토류를 함유한 광물은 하나의 광종에 경희토류 원소만 편재되어 있거나, 중희토류 원소만 편재되어 있는 것이 일반적이다. Table 3은 경희토류 및 중희토류를 포함하는 광물과 그 화학식을 보여준다(Jordens et al., 2013; Haque et al., 2014). 하지만 대부분의 희토류를 함유한 광물은 10~300 ppm의 낮은 품위를 가지고 있어 경제적으로 회수가 어려우며, 현재 상업적으로 희토류를 회수하고 있는 광물은 바스트나사이트(Bastnaesite), 모나자이트(Monazite), 제노타임(Xenotime), 이온흡착형광(Ion- adsorption clay)으로 한정된다(Jordens et al., 2013; Ito et al., 1991). 희토류 광물의 지질학적 생성 기원은 크게 카보나타이트광상(Carbonatite deposit), 알칼리 화강암 광상(Alkaline igneous deposit), 이온흡착형 광상(Ion adsorption clay), 표사광상(Placer deposit)으로부터 발생된다고 보고되며, 경희토류는 표사광상 및 카보나타이트 광상, 그리고 중희토류는 이온흡착광상으로부터 주로 회수된다(USGS 2019).
Table 3.
Types of the rare earth minerals and chemical composition
희토류 광물이 혼재된 원광으로부터 희토류 광물을 선택적으로 회수하기 위해 다양한 종류의 물리적 선별공정이 적용된다. 희토류 광물이 갖는 물리적, 자기적, 물리화학적 표면특성과 맥석 광물이 갖는 특성 차이를 이용하여 다양한 선별공정의 적용이 가능하다. 희토류 광물은 지질학적 기원에 따라 다양한 종류의 광물과 함께 부존 되어있어, 광물의 특성에 따라 다양한 선별 방법이 적용될 수 있으며, 비중선별, 자력선별, 정전선별, 부유선별 등의 공정을 단독, 혹은 조합하여 선광이 이루어진다. 하지만 선별공정에 투입되는 광물 입자 크기가 100 micron이하의 분말로 존재하면 일반적인 물리적인 선별법 적용 시 선별공정에서 유용광물의 손실의 발생 등으로 인하여 효율이 떨어지게 되므로 부유선별법을 사용하는 것이 일반적이다(Gupta and Krishnamurthy, 2005). 부유선별법은 저품위 복합광을 선별하는데 유용하며, 원광의 입경이 작아 다른 선별법으로 경제적으로 회수가 불가능 할 때 적용가능 하다는 장점을 갖는다. 현재 가장 큰 희토류 가행 광산인 중국의 Bayan Obo 광산에서는 저강도(Low intensity)와 고강도(High intensity) 자력선별을 통해 회수된 정광을 부유선별 급광으로 투입하여 약 55% 품위의 최종 정광을 회수하며(Li and Yang, 2014), 미국의 Mountain Pass 광산에서는 원광을 파, 분쇄 후 부유선별 단일 공정을 통해 초기 약 7% 품위의 원광으로부터 63% 품위의 정광을 회수한다(Pradip and Fuerstenau, 1991). 이외에도 캐나다 Thor lake 광산, 호주의 Mountain Weld 광산, 중국 Mianning 광산, Shangdon Weishan광산, Dulacao 광산, Maoniuping(MNP) 광산 등 대부분의 희토류 광산에서 부유선별을 통해 희토류 최종 정광을 회수하고 있고, 선별 효율을 높이기 위해 해당 광산의 원광을 이용한 다양한 부유선별 연구가 이루어지고 있다(Jordens et al., 2016; Xiong et al., 2018; Ren et al., 1997; Zhang et al., 2016a; Li and Yang, 2014). 하지만 여전히 많은 수의 연구가 중국으로 편중되어 있고, 희토류 광물의 부유선별에 대한 연구 및 문헌정보가 부족한 실정이다.
본 연구에서는 현재 상업적으로 회수되고 있는 희토류 광물의 부유선별 연구동향에 대해 조사하였다. 사례별로 선별효율 및 회수율 향상을 위해 적용된 부유선별 시약에 대한 정보 및 부유선별 결과를 정리하고, 다양한 표면분석 연구결과를 통해 광물 표면에서의 흡착 메커니즘에 대한 정보를 제공하고자 하였다.
희토류 광물
바스트나사이트(Bastnaesite)
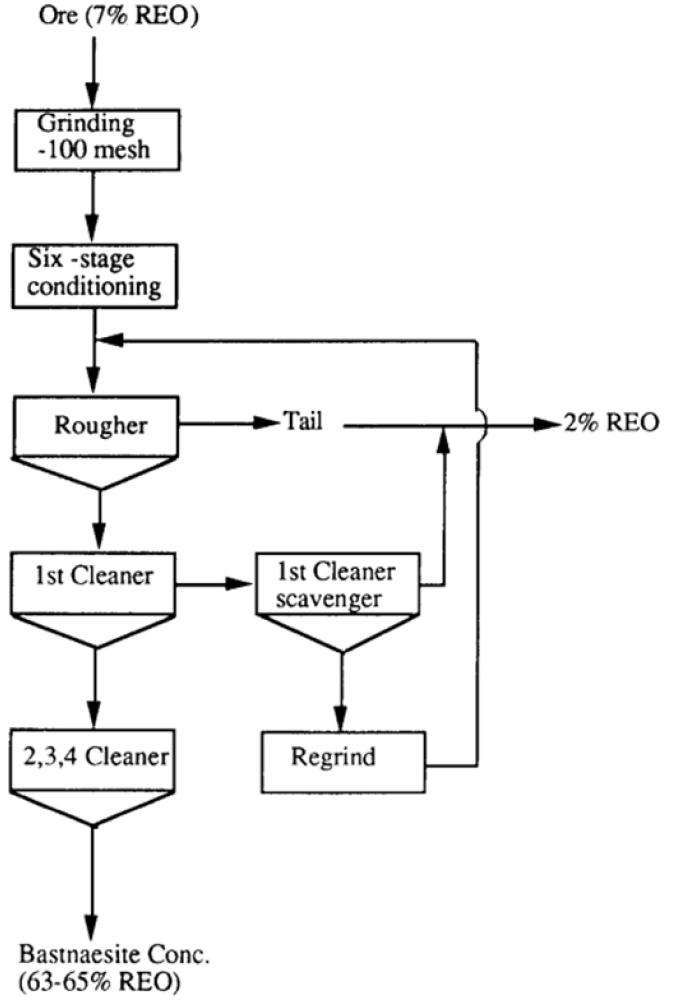
바스트나사이트는 (Ce, La)CO3F의 화학식을 갖는 플루오린화탄산염 광물로써, 세륨, 란타넘 등의 경희토류를 주로 함유하며 일반적으로 약 70%의 희토류 함량을 가진다. 바스트나사이트의 생성기원은 맥상광상(Vein deposit), 접촉변성광상(Contact metamorphic deposit), 페그마타이트광상(Pegmatite deposit) 및 카보나타이트광상(Carbonatite deposit) 등으로부터 생성된다고 보고된다(Gupta and Knishnamurthy, 2005). 현재 전 세계 희토류 생산량의 대부분을 차지하는 중국의 Bayan Obo 광산에서 산출되는 주요 희토류 광물은 바스트나사이트이며, 약 7:3의 비율로 모나자이트 또한 함께 산출된다. 또 다른 대형 광산인 미국의 Mountain Pass 광산은 대표적인 카보나타이트 광산으로써 바스트나사이트를 주요 희토류 광물로 갖는다(Kanazawa and Kamitani, 2006). 바스트나사이트의 선광에서 부유선별은 필수적인 공정으로, 대형 희토류 광산인 Mountain Pass 및 Bayan Obo 광산을 포함한 대부분의 광산에서 최종 정광은 부유선별을 통해 얻는다. Fig. 2는 Mountain Pass광산의 Molycorp Corporation으로부터 운영되고 있는 선광 프로세스 모식도를 나타낸다(Ferron et al, 1991).
모나자이트(Monazite)
모나자이트는 (Ce, La, Th)PO4의 화학식을 갖는 인산염 광물이며, 화학적 안정성이 뛰어나 주로 표사광상이나 해빈사광상(Beach sand deposit)으로부터 발견된다. 총 희토류 산화물 함량은 산출 지역과 광물조성에 따라 상이하지만 일반적으로 약 70%으로 알려져 있으며, 란타넘(~40%), 세륨(~30%) 등의 경희토류를 주로 함유한다(Houot et al., 1991). 또한 방사선물질인 토륨(Th)을 4~12% 함유하고 있어 과거에는 토륨의 회수를 위해 채굴되었지만, 희토류 원소의 수요가 증가함에 따라 희토류 원소의 회수를 위한 주요 광물로 주목 받아왔다(Abaka-Wood et al., 2017a). 1980년대 후반에는 전 세계 희토류 생산량의 40%를 모나자이트로부터 생산하였지만, 방사선 물질의 존재로 인해 폐기물처리가 곤란하고, 대규모 희토류 광산(Bayan Obo와 Mountain Pass)등의 개발로 인한 바스트나사이트 공급량이 증가로 인해 희토류 원료로써 모나자이트의 중요성이 감소되었다(Gupta and Knishnamurthy, 2005). 중사에서 부산물로 주로 회수되는 모나자이트는 저어콘, 티탄철석, 금홍석, 석류석, 석영 등과 함께 산출되며, 저어콘, 티탄철석 및 금홍석은 주요 산업광물로 회수 된다. 모나자이트의 선광은 중력선별, 자력선별, 정전기선별의 조합을 통해 이루어지지만, 중사광산으로부터 산출되는 입도가 작을 경우 부유선별을 통한 선광이 효율적이다(Ferron et al., 1991).
제노타임(Xenotime)
제노타임은 YPO4의 화학식을 갖는 인산염 광물로써, 중희토류인 이트륨 회수를 위한 주요 광물이다. 총 희토류 함량은 약 67% 이며 주 원소인 이트륨 외에도 세륨, 란타넘, 프라세오디뮴, 네오디뮴 등의 경희토류도 소량(~8.4%) 함유할 수 있다(Gupta and Knishnamurthy, 2005). 생성기원은 심성암부터 퇴적암, 변성암까지 다양한 광종에서 산출되며, 주로 중사 광상으로부터 모나자이트, 티탄철석, 금홍석 등의 비중이 큰 광물들의 선광과정에서 부산물로 회수되는 것이 일반적이다(Chenlgani et al., 2015). 주요 매장지역은 핀란드, 노르웨이 등의 북유럽 지역과, 말레이시아, 스리랑카, 태국 등의 동남아 지역에 분포한다고 보고된다(Pradip and Fuerstenau, 1991). 모나자이트의 약 0.5~5% 비율로 함께 산출되는 것이 일반적으로, 선광은 중사광상으로부터 물리적 선별을 통해 회수되는 것이 일반적이다. 하지만, 일부 물리적 선별에 적합하지 않은 광상에 대해서는 부유선별을 통해 회수된다.
이온흡착형 광물(Ion-adsorption clay)
이온흡착형 광물은 희토류 원소를 일정량 포함하는 모암의 지속적인 화학적, 생물학적 풍화에 의해 희토류 원소가 용해되고, 용액의 이동과정에서 점토광물 표면에 희토류 원소 이온의 지속적인 흡착과 농축과정에 의해 형성된다(Yang et al., 2013). 중국 남부 일부 지방(Jiangxi, Guangdong, Fujian, Zhejiang, Hunan, Guangxi, Yunnan)에 국한되어 부존 되어 있으며, 현재까지 다른 지역에서 발견된 기록은 존재하지 않는다. 이온흡착형 광물은 제노타임과 함께 중희토류의 회수를 위한 주요 광물로써, 일반적으로 0.03~0.2%의 희토류 함량을 가진다(Kanazawa and Kamitani, 2006; Yang et al., 2013). 광석상태로 존재하는 주요 희토류 광물에 비해 희토류 원소의 품위는 낮은 수준이지만, 대부분 노천채굴로 채굴이 가능하며 선광 공정을 거치지 않고 희토류 원소를 회수할 수 있는 장점을 갖는다.
희토류 광물에 따른 부유선별 연구동향
바스트나사이트의 부유선별
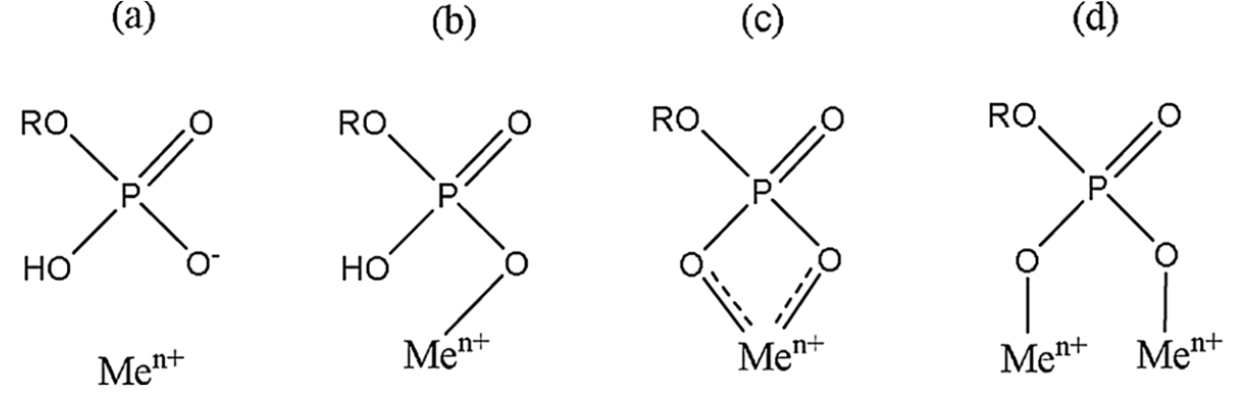
바스트나사이트는 주요 희토류 광물로써 전 세계에 부존 된 희토류광 중 80%를 차지한다(Gupta and Krishnamurthy, 2005). 선광 공정은 중력선별, 자력선별 등 다양한 물리적 선별을 적용할 수 있으나, 최종 정광은 부유선별 공정을 통해 회수되는 것이 일반적이다. 더 나은 부유선별 결과를 얻기 위해 광액농도, 산도, 반응기의 배치 등의 운영 조건을 조절할 수 있지만, 부유선별의 가장 중요한 목적인 광물의 선택적 회수를 위해서는 포수제 및 억제제의 적절한 사용이 핵심적이다. 현재까지 바스트나사이트의 부유선별에 사용되는 포수제는 Octyl hydroxamate(Pradip and Fuerstenau, 1983; Pavez et al., 1996; Zhang et al., 2014), Benzohydroxamic acid(Jordens et al., 2014, 2016; Xia et al., 2014, 2015a; Espiritu and Waters, 2018; Espiritu et al., 2018a, 2018b), Naphthyl hydroxamic acid(Xia et al., 2015a; Li et al., 2018), Salicyl hydroxamic acid(Cao et al., 2018a, 2018b), 3-hydroxyl-2-napthyl hydroxamic acid(Xia et al., 2014; Yang et al., 2017; Xiong et al., 2018), Sodium oleate(Pavez et al., 1996; Jordens et al., 2014; Espiritu et al., 2018b), Phosphoric acid ester(Jordens et al., 2014; Espiritu et al., 2018b), Benzoic acid(Ren et al., 2000), N-hydroxyl phthalicimide(Ren, 1993) 등을 사용한 연구들이 존재하며, 대표적으로 지방산(fatty acid), 하이드로자믹산(hydroxamic acid), 인산(phosphoric acid) 계열로 나눌 수 있다.
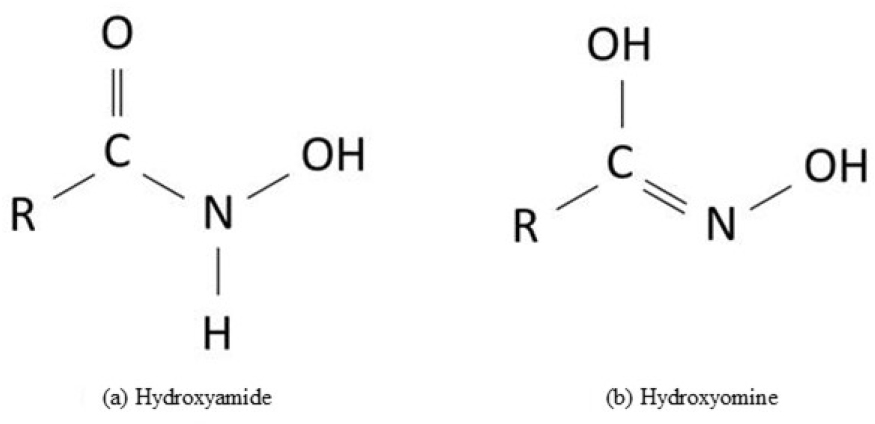
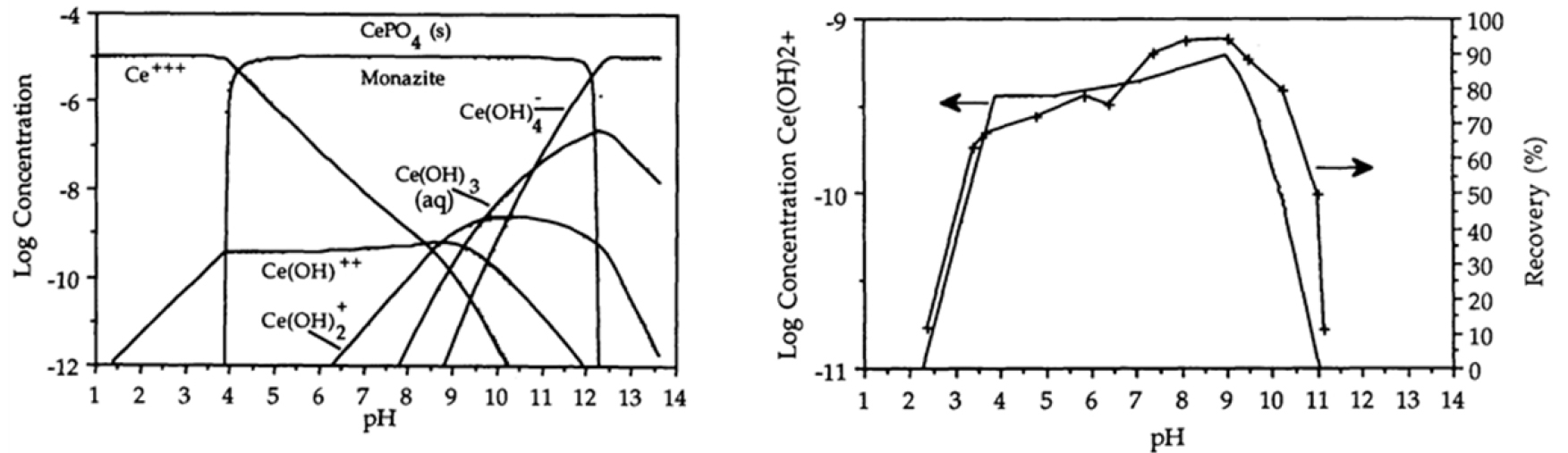
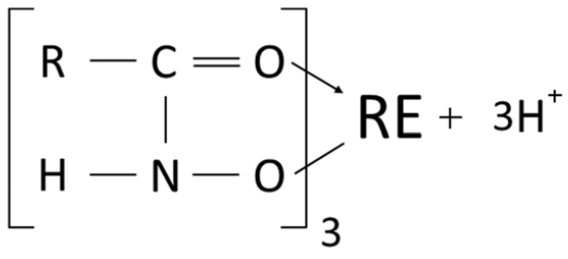
하이드로자메이트 계열의 포수제는 다른 계열의 포수제에 비해 희토류광물에 대해 높은 선택성을 갖는 것으로 알려져 있다. 하이드로자믹산의 구조는 Fig. 3과 같이 Hydroxyamide와 Hydroxyoxime의 2가지 형태로 존재 할 수 있으며, 하나의 리간드만 가질 수 있는 Hydroxyamide의 형태만 금속 양이온과 안정한 킬레이트를 형성한다고 알려져 있다(Pradip and Fuerstenau, 1983). 희토류 광물에 대한 하이드로자믹산의 높은 선택성은 맥석으로 존재하는 기타 금속 양이온보다 희토류 이온이 높은 전자가(electrovalence)를 갖기 때문에, 높은 전자가를 가질수록 포수제의 작용기와 생성할 수 있는 킬레이트 결합이 많아 더 큰 소수성을 부여할 수 있기 때문으로 설명된다(Pradip and Fuerstanu, 1983). 바스트나사이트의 표면에서 일어나는 하이드로자믹산의 흡착은 화학적 흡착을 통해 일어날 것으로 예상되었다. 이는 광물의 표면 전위와 하이드로자믹산의 작용기가 모두 음의 전위를 갖는 pH 범위에서 전기적 반발력에도 불구하고 높은 회수율을 보이기 때문이며, 이 같은 예상은 적외선분광법을 통해 규명되었다(Pradip and Freustanau, 1983; Luo and Chen, 1987; Pavez et al., 1996). 화학적 흡착 메커니즘은 광물표면으로부터 용해된 희토류 이온이 수산화물을 형성하고, 용액 중 형성된 수산화물이 광물 표면에 흡착하여 포수제의 흡착을 위한 활성표면을 제공함으로써 포수제의 흡착이 발생 하는 것으로 제안되었다(Pradip and Fuerstenau, 1983; Luo and Chen, 1987). 이러한 주장은 Fig. 4와 같이 용액 중 희토류 이온의 Species diagram을 통해, 용액 중 pH에 따른 희토류원소의 수산화물 이온(Ce (OH)2+, Ce(OH)2+, La(OH)2+, La(OH)2+)의 농도 곡선과 희토류광물의 부유선별 회수율 곡선의 경향이 일치하는 결과를 통해 수산화물 형성이 포수제의 흡착을 위한 핵심적인 요소임을 입증하였다(Pradip and Fuerstenau, 1983; Cheng et al., 1993). Fig. 5는 광물 표면으로부터 포수제의 흡착 형태를 보여주고 있다. Hydroxyamide기의 수소이온이 금속이온과 치환되어 공유결합을 하며, 카복실기에 존재하는 산소와 배위결합을 통해 5개의 이온이 고리를 이루는 결합을 하는 것으로 현재까지 하이드로자믹산의 흡착 메커니즘으로 설명되고 있다. 이러한 주장과 더불어, Sarvaramini et al.(2016)은 DFT(Density Functional Theory) 시뮬레이션을 통해 1가 및 2가 세륨수산화물 이온 외에 수화된 Ce(OH)3 형태 또한 하이드로자믹산과 화학적으로 안정하게 결합하여 2개의 킬레이트 결합을 형성 할 수 있음을 최근 연구를 통해 주장하였다.
바스트나사이트 부유선별에 대한 다양한 포수제의 효율을 비교하기 위해 Jorden et al.(2014), Espiritu et al.(2018b), Pavez et al.(1996)은 하이드로자믹산, 지방산, 인산 계열의 포수제를 사용하여 선택성을 비교하였다. 석영(Jorden et al., 2014)과 돌로마이트(Espiritu et al., 2018b)가 맥석일 때 일정 pH 범위에서 조건적으로 지방산과 인산 계열의 포수제는 선택성을 가질 수 있었으나, 하이드로자메이트 계열의 포수제가 가장 높은 선택성을 보이는 것을 실험을 통해 확인하였다. 지방산 계열의 포수제는 황화광물 등 일반적인 부유선별 공정에 널리 사용되고 있고, 가격이 저렴하며, 흡착능력이 좋아 쉽게 광물표면을 소수성화 시키는 장점을 갖고 있다. 하지만 선택성이 떨어져 다양한 맥석광물과 함께 산출되는 희토류광물의 특성상, 다량의 억제제의 사용이 필요한 한계를 가진다. Jorden et al.(2014)은 일정 농도 이상의 지방산 포수제를 사용 할 경우 발생하는 기포의 크기가 감소하고, 이로 인한 기포사이의 물리적 트랩으로 회수되는 맥석의 양이 증가하는 것이 선택성을 감소시키는 이유 중 하나 일 것으로 제시하였다. 같은 연구에서 인산계열 포수제를 사용했을 경우 지방산 계열의 포수제를 사용한 경우보다 높은 바스트나사이트의 회수율을 보였으나, 맥석으로 존재하는 석영의 회수율이 대폭 증가하여 선택성이 현저히 감소하는 것을 확인하였다. Espiritu et al. (2018b)은 위의 연구와 같이 3가지 그룹의 포수제를 이용하여 돌로마이트를 맥석으로 가질 때 바스트나사이트와 모나자이트에 대한 표면화학 연구 및 선택성을 비교하였고, 바스트나사이트와 올레인산 나트륨에 대한 포수제의 흡착 메커니즘은 수산화 된 금속이온의 흡착에 의한 활성표면 제공으로 이루어진다는 기존 문헌들과 일치하는 의견을 제시하였다. 인산을 작용기로 갖는 포수제의 흡착메커니즘에 대한 의견은 Fig. 6과 같이, 금속 양이온과 a)정전기적 인력에 의한 초기 흡착, b)화학적 결합을 통한 흡착, c)추가적인 산소의 배위결합에 의한 두 자리 리간드 결합의 순으로 진행되는 것으로 제시하였다. 또한, Gong et al.(2017)은 두 자리 리간드 결합은 일시적인 중간단계 일뿐, 최종적으로 d)와 같은 이핵 착물(Binuclear complex)의 형태로 결합 할 것으로 주장하였다. 부유선별 실험을 통해 얻어진 회수율을 바탕으로 선택성을 비교해본 결과, 하이드로자믹산이 가장 우수한 선택성을 가졌으며, 올레인산나트륨과 인산에스테르의 경우 산성-중성 범위의 pH에서 조건적으로 선택성을 가질 수 있는 것으로 확인되었다. 하이드로자믹산의 선택성이 상대적으로 우수한 이유는 각 포수제가 갖는 작용기의 산소이온의 극성에 기인한 것으로, 중심원자의 전기음성도가 N(하이드로자믹산) > C(올레인산나트륨) > P(인산에스테르)의 순으로 커, 중심원자와 결합된 산소(광물표면과 직접적으로 결합하는 원자)이온이 상대적으로 적은 음의 전하를 갖기 때문으로 설명된다(Espiritu et al., 2018b). 이와 더불어 Pavez et al.(1996)은 바스트나사이트에 대해 올레인산나트륨과 하이드로자믹산을 이용한 부유선별 회수율을 통해 부유도 직접적으로 비교하였고, 바스트나사이트의 부유도는 하이드로자믹산을 이용했을 때 pH 3-11범위에서 올레인산나트륨을 사용한 경우보다 다소 높은 부유도를 가지는 것을 확인하였다. 이 같은 연구 결과들은 하이드로자믹산이 기존에 널리 사용되던 지방산계열의 포수제보다 높은 선택성과 부유도를 가지는 것을 확인해준다.
Table 4을 통해 확인 할 수 있듯이, 현재까지 대부분의 바스트나사이트의 부유선별 연구는 하이드로자메이트 계열 포수제를 이용하여 진행되어왔지만, 포수제를 사용한 부유선별 연구도 존재한다. Ren et al.(1993)은 산화바륨, 산화칼슘, 실리카, 적철석 등을 맥석으로 갖는 원광으로부터 바스트나사이트의 회수를 위해 N-hydroxyl phthalicimide을 포수제로 이용한 부유선별 연구를 진행하였다. 바스트나사이트의 회수율은 pH 7-8 범위에서 최적 효율을 갖는 것을 확인하였고, 억제제의 사용을 통해 품위 9.52%의 원광으로부터 최종적으로 71.3%의 품위를 갖는 최종정광을 86.03% 회수하여 선택적 회수가 가능함을 확인하였다. 포수제의 흡착 메커니즘은 Fig. 7과 같이 두 개의 오각 고리를 갖는 킬레이트(Double pentacyclic chelate)를 형성하는 화학적 흡착이 주요 메커니즘일 것으로 설명하였다. 이어서 Potassium alum을 조건제로 사용할 때, 모나자이트로부터 바스트나사이트의 선택적 회수를 위해 벤조산(Benzoic acid)를 사용하여 부유선별을 진행하였다(Ren et al., 2000). 해당연구에서는 염기성조건(pH 8-10)에서 최적의 부유도를 갖는 하이드로자메이트 계열의 포수제와는 달리 벤조산을 포수제로 사용 시 pH 5의 약산성 조건에서 최적의 부유도를 갖는 것을 확인하였다. 최종적으로, 조건제의 투입량을 조절함에 따라 초기 70%의 모나자이트 회수율을 10%로 감소시킨 반면, 바스트나사이트의 회수율은 85%를 유지해 두 광물의 분리가 가능함을 확인하였다. Liu et al. (2016)은 선택성이 높지만 비교적 비용이 많이 드는 하이드로자믹산을 대체 할 수 있는 Potassium lauryl phosphate를 포수제로 사용하여 부유선별 연구를 진행하였고, 하이드로자믹산의 사용량과 비교하여 약 1/10의 사용으로도(5×10-6 M of potassium lauryl phosphate vs. 5×10-5 M of octanohydroxamic acid) 비슷한 회수율을 가질 수 있는 것을 확인하였다. 하지만, 앞선 인산 계열의 포수제를 사용한 연구결과를 비추어보면(Jordan et al., 2014), 인산 계열의 포수제는 흡착능력이 커서 석영 등의 맥석도 함께 부유시키는 결과를 초래한다. 따라서, Liu et al.(2018)은 방해석과 석영을 맥석으로 가질 때 바스트나사이트의 부유도 및 선택성 비교를 위해 다양한 농도의 Potassium lauryl phosphate를 이용하여 각 광물에 대한 접촉각, 제타포텐셜 측정 및 부유선별 실험을 진행하였다. 부유선별실험을 통해 3×10-6 M 농도의 potassium lauryl phosphate를 사용 했을 경우, 약 90%의 바스타나사이트가 회수된 반면 방해석 및 석영의 회수율은 20%, 0% 로 각각 나타나 효과적으로 바스트나사이트를 선별할 수 있었다. 하지만 농도를 증가시켜 1×10-5 M 농도의 potassium lauryl phosphate을 사용 할 경우 방해석 또한 90% 이상 회수되어 높은 포수제 농도를 사용할 경우 억제제의 사용이 필수적일 것으로 주장하였다. 석영의 경우 Jordens et al.(2014)의 연구에서 200 g/t의 phosphoric acid ester를 사용했을 때 80% 이상의 석영이 회수된 것에 반해, potassium lauryl phosphate를 사용한 경우 1×10-4 M 의 포수제 농도에서도 약 20%의 회수율을 갖는 것으로 확인되었다. 같은 인산염 포수제의 사용에도 불구하고 석영에 대한 큰 부유도 차이를 갖는 것은 포수제의 화학적 구조로부터 기인하는 것으로 예상하였고, 이 같은 메커니즘을 확인하기위한 추가적인 연구가 필요할 것으로 제시하였다. 계속해서 Liu et al. (2018)은 기존 연구에서 사용 되어 왔던 potassium lauryl phophate 포수제와의 비교를 위해 2-ethly-hexyl phosphate를 포수제로 사용하여 방해석 및 석영으로부터 바스트나사이트의 선택성 연구를 비교하였다. 해당 연구에서는 2-ethly-hexyl phosphate는 더 낮은 흡착 친화력(adsorption affinity)을 갖지만, 일정 농도에서는 더 큰 선택성을 갖는 것으로 확인 되었다. 이는 2-ethly-hexyl phosphate이 가지 구조(branched structure)를 가지기 때문에 광물 표면에 흡착하는데 있어 구조적인 방해를 받지만, 포수제에서 흡착에 관여하는 O1, O2 산소 원자의 전자 공여도(electron-donating ability)가 potassium lauryl phosphate에 비해 크기 때문으로 설명된다.
Table 4.
Summary of the flotation researches of Bastnaesite
| Author | Year | Mineral | Collector | Conditioner |
| Pradip and Fuerstenau | 1983 |
Bastnaesite, barite, calcite (MT. Pass in USA) |
Potassium octyl Hydroxamic acid | - |
| L. Jiake | 1987 |
Bastnaesite, monazite (Baotou in China) | Hydroxamic acid |
Sodium silicate Sodiumfluorosilicate |
| J. Ren | 1993 |
Bastnaesite, barite, fluorite, silicate, hematite | N-hydroxyl phthalicimide |
Sodium silicate, NH4Cl, ADTM |
| Pavez et al. | 1996 |
Bastnaesite, monazite (from Brazil) |
Octyl hydroxamate Sodium oleate | - |
| Ren et al. | 1997 |
Ore (MNP, BYEB mine in China) |
MOHA (modified hydroxamic acid) | Sodium silicate |
| Ren et al. | 2000 |
Bastnaesite, monazite (Haoniuping in China) | Benzoic acid | Potassium Alum |
| Zhang et al. | 2014 | Bastnaesite (from Pakistan) | Octyl hydroxamic acid | - |
| Jordens et al. | 2014 |
Bastnaesite (Mt. Pass and Madagaskar), quartz |
Benzohydroxamic acid Sodium oleate Phosphoric acid ester | Sodium silicate |
| Xia et al. | 2014 |
Thor lake ore (not specific type of ores) |
Salicylic hydroxamic acid Benzylhydroxamic acid H205(2-hydroxyl-3-naphthyl hydroxamicacid) | Sodium silicate |
| Xia et al. | 2015 |
Thor lake ore (not specific type of ores) |
Benzyl hydroxamic acid Naphthalenichydroxamate (LF-P81) |
Sodium silicate Pb(NO3)2(Activator) |
| Jordens et al. | 2016 |
Bastnaesite, monazite etc (Thor lake in Canada) | Benzohydroxamic acid | Lead chloride |
| Yang et al. | 2017 | Bastnaesite (Baotou in China) |
H205(3-hydroxy-2-naphthyl hydroxamic acid) | - |
| Espiritu et al. | 2017 |
Bastnaesite, monazite, dolomite (REE. Namibia, South Africa) | Benzohydroxamic acid | - |
| Xiong et al. | 2018 |
Bastnaesite, monazite, silicate, barite, etc (Dulucao deposit in China) |
H205(3-hydroxy-2-naphthyl hydroxamic acid) Lf Wx and Wx-1 | Sodium silicate |
| Li et al. | 2018 |
Bastnaesite, Monazite, fluorite, barite, silicate (Baotou in China) | Naphtyl hydroxamic acid | Sodium silicate |
| Liu et al. | 2016 |
Bastnaesite (Zagi mountain in Pakistan) | Potassium lauryl phosphate | - |
| Liu et al. | 2017 |
Bastnaesite (Zagi mountain in Pakistan), calcite, quartz | Potassium lauryl phosphate | - |
| Liu et al. | 2018 |
Bastnaesite (Zagi mountain in Pakistan), calcite, quartz | 2-ethyl-hexyl phosphate | - |
| Cao et al. | 2018a | Bastnaesite (Zaozhuang in China) | Salicylhydroxamic acid | Strontium Chloride |
| Cao et al. | 2018b |
Bastnaesite, calcite, dolomite, celestite, iron ore (hematite, magnetite) (Zaozhuang in China) | Salicylhydroxamic acid | - |
| Cao et al. | 2019 |
Bastnaesite (Weishanhu in China), Fluorite | Octyl hydroxamic acid |
EDTA (ethylenediamine tetraacetic acid) |
| Espiritu et al. | 2018 |
Bastnaesite, monazite, dolomite (Namibia, South Africa) |
Benzohydroxamic acid Sodiumoleate Phosphoricacidester | - |
바스트나사이트의 선택적 회수를 위해, 포수제와 더불어 중요한 것이 억제제의 종류 및 사용이다. 순수한 광물을 사용한 부유선별 실험에서는 대부분 90% 이상이 높은 회수율을 얻었지만, 원광을 대상으로 할 경우 자연적인 소수성 표면을 가진 맥석 및 물리적 포집에 의한 맥석의 포집 뿐 만 아니라 맥석 표면에도 사용되는 포수제가 흡착되어 함께 회수 될 수 있어 선택성이 다소 떨어진다. 카보나타이트 암석 기원의 바스트나사이트는 일반적으로 중정석, 돌로마이트, 방해석 등 탄산염 광물과 석영 등과 함께 산출되므로 부유선별의 선택성을 높이기 위해 적절한 억제제를 사용하는 것이 중요하다. 일반적으로 산화물 맥석인 실리카의 억제에 유용한 규산소다(Sodium silicate)가 널리 사용되고 있으며, 이 외에도 Sodium fluorosilicate, EDTA(ethylenediamine tetraacetic acid), Potassium alum, 염화납, 탄산염 이온 등을 이용해 희토류 광물의 회수율 향상을 위한 연구들이 진행되어 왔다(Luo and Chen, 1987; Ren, 1993; Ren et al., 1997, 2000; Jordens et al., 2014, 2016; Xia et al., 2014, 2015a, 2015b; Xiong et al., 2018; Li et al., 2018; Cao et al., 2019). Luo and Chen(1987)는 중국 Bayan Obo광산의 원광으로부터 희토류광물의 선택적 회수를 위해, 포수제로 하이드로자믹산, 억제제로 Sodium silicate 및 Sodium fluorosilicate를 사용하여 석영, 중정석, 형석, 방해석 등을 억제하는 연구를 진행하였다. 원래 철광상으로 개발되었던 Bayan obo광산은 복잡한 광물 조성을 가지고 있기 때문에 1970년대부터 희토류 광물의 선광 공정은 중력선별과 부유선별을 결합하여 적용해왔다. 해당 연구에서는 부유선별 단일공정으로 먼저 산화철 및 규산염 광물의 억제를 선행 후, 형석, 방해석, 중정석의 억제를 통해 희토류 광물의 선택적 회수가 가능함을 입증하였다. 이는 기존의 운영조건과 비교하여 더 높은 품위와 회수율의 희토류 광물의 회수율을, 절반의 비용으로 얻을 수 있는 것을 실증실험을 통해 증명하였다. Ren(1993)은 또한 중정석, 방해석, 형석을 주요 맥석으로 갖는 원광으로부터 바스트나사이트의 선택적 회수를 위해 Sodium silicate, NH4Cl, ADTM(Dipropyl ketonealcohol)을 조합하여 부유선별 거동을 관찰하였다. N-hydroxyl phthalicimide를 포수제로 사용한 부유선별 결과, 희토류 광물에 대해 71.31%의 품위와 86.03%의 회수율을 얻을 수 있었지만, 각각의 억제제가 각 광물의 억제에 작용하는 메커니즘 및 사용량에 따른 영향을 규명하는 실험은 진행되지 않았다. 금속 양이온과 복염을 형성하는 킬레이트제로 잘 알려진 EDTA를 사용한 형석의 억제 연구도 진행되었다. Cao et al.(2019)는 바스트나사이트와 형석의 혼합시료를 사용하여 EDTA를 사용한 형석의 억제 연구를 진행하였고, 7.79 kg/t의 EDTA를 사용했을 때 바스트나사이트의 부유도에는 영향을 미치지 않고 형석을 효과적으로 대부분 억제 시킬 수 있음을 확인하였다. 이는 형석 표면에 화학적으로 흡착된 Ca-hydroxamte 화합물은 EDTA에 의해 용해성 Ca-EDTA 화합물로 바뀌어 표면에서 제거되어 부유도가 감소하는 반면, 바스트나사이트 표면에서는 희토류 3가 양이온에 대한 강력한 하이드로자메이트 계열 포수제의 선택성으로 인해 Ce-EDTA로 변하지 않기 때문으로 해석된다. 맥석으로 존재하는 가용성 광물(Soluble mineral)에 의해 의도하지 않는 희토류 광물의 억제효과에 의해 부유선별 효율이 감소 할 수 있다. Espiritu et al.(2018a)은 돌로마이트 등의 맥석 광물이 존재할 때, 맥석 광물로부터 용해된 Mg2+, Ca2+, MgOH+, CaOH+ 등의 화학종들이 포수제와 복염을 형성하여 포수제의 흡착을 방해 할 수 있음을 확인하고, 대안으로 볼밀 등의 파분쇄 단계에서 포수제를 투입하여 포수제의 흡착을 선행시키는 것을 제안하였다. 맥석으로 존재하는 천정석(celestite) 또한 가용성 광물로써, 광액 중 Sr2+ 이온으로 용해된다. Cao et al.(2018a)은 바스트나사이트의 부유선별에 Sr2+이 미치는 영향을 관찰하기 위해 Salicylhydroxamic acid와 SrCl2를 사용하여 연구를 진행하였으며, pH 8에서 5 × 10-4 M의 Sr2+가 존재 할 때 부유도는 72.3%에서 45.4%로 감소 함을 확인하였다. 이같은 결과는 XPS 표면분석을 통해, Sr2+이 광물 표면의 CeOH0의 산소 이온과 결합하여 Ce-O-Sr+ 착물을 형성하여 포수제의 흡착을 위한 활성 표면을 감소 시키기 때문으로 설명되었다. 이후 Cao et al. (2018b)는 Sr2+ 뿐만 아니라, 돌로마이트 및 철광석에서 용해될 수 있는 Fe3+, Al3+, Mg2+, Ca2+이 존재할 때 바스트나사이트의 억제에 미치는 영향을 관찰하기위한 연구를 계속 진행하였다. 이를 통해 바스트나사이트에 대해 Fe3+ > Al3+ > Mg2+ > Sr2+ > Ca2+의 순서로 큰 억제효과를 갖는 것을 확인하였다. Fe3+ 및 Al3+의 경우 광물 표면에서 수산화물 형태로 광물 표면에 흡착하여 포수제의 흡착을 방해하는 반면, Ca2+ 및 Mg2+의 경우 광물 표면에서의 직접적인 흡착 보다는 이들 이온과 착물 형성을 통한 포수제의 소모로 인해 바스트나사이트 부유도가 감소할 것으로 주장하였다.
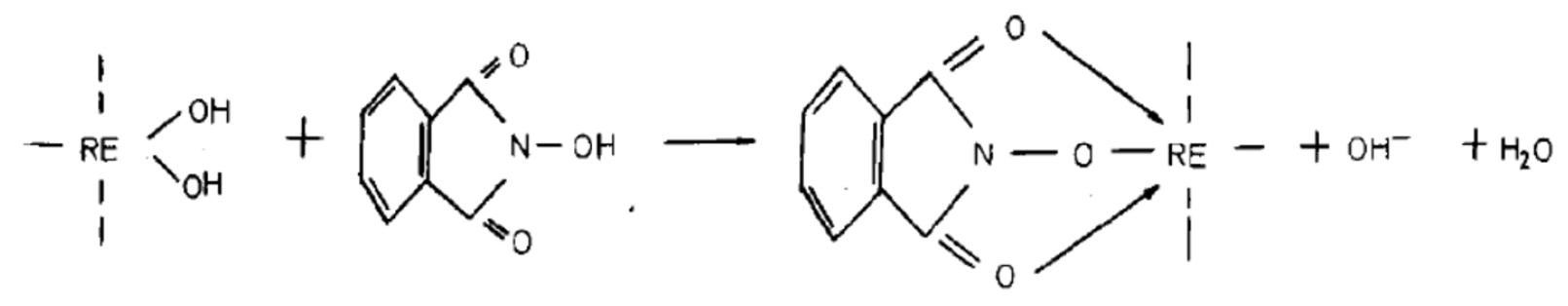
일반적인 맥석으로부터 희토류 광물의 선택적 회수를 위한 억제제의 사용 외에도, 대표적 희토류 광물인 바스트나사이트와 모나자이트의 분리를 위해 억제제로써 Potassium alum을 사용한 연구도 진행되었다(Ren et al., 2000). 바스트나사이트와 모나자이트의 표면은 공통적으로 Ce과 La 등의 경희토류 원소를 가지고있어 부유선별 거동이 유사하므로 함께 회수되는 것이 일반적이다. 하지만, 회수된 정광 내에 두 광물들이 혼재되어 있을 경우 습식제련 공정에서 많은 비용이 소요되기 때문에 선광 단계에서 두 광물을 분리하는 것이 효과적이다. 부유선별을 통한 두 광물의 분리실험 결과, 억제제를 사용하지 않았을 경우 70%였던 모나자이트 회수율은 7 kg/ton의 Potassium alum을 사용한 경우 모나자이트의 회수율이 10%이하로 감소하는 결과를 얻었고, 이 때 바스트나사이트 회수율의 큰 변화가 없는 것을 확인하였다. 이 같은 결과는 조건제로 사용된 Potassium alum의 경우 용액 속에서 K+, Al3+, SO42-이온으로 해리되며, 이들 중 수산화 된 Al3+이온이 모나자이트에 우선적으로 모나자이트 표면에 흡착하여 친수성을 부여하기 때문으로 설명된다. 알루미늄 이온에 의한 희토류 광물의 억제효과는 희토류 광의 회수율 감소로 이루어지기 때문에 제거해야 할 대상이기도 하다. 이를 위해 Xia et al.(2015b)은 Thor lake 광산의 시료를 이용하여 알루미늄 이온에 의한 희토류 광물의 억제 효과를 제거하기 위해 시트르산을 이용한 연구를 진행하였고, 억제 효과를 일정량 완화 시킬 수 있음을 확인하였다. 광물 표면에 흡착된 알루미늄 수화물에 의해 발생 된 억제효과는, 알루미늄 이온과 시트르산의 킬레이트 결합을 통해 용해성 금속 리간드 형성이 이루어져 광물 표면으로부터 제거되기 때문으로 주장하였다.
선별 효율 증가를 위해 억제제의 사용 외에 포수제의 흡착을 도와주는 활성제를 사용할 수 있다. 캐나다 Thor lake 광산을 개발 중인 Avalon Rare Meta 사는 내부 연구 결과를 통해 하이드로자믹산을 포수제로 사용한 부유선별에서 질산납(Pb(NO3))을 사용 시 효율 증가를 기대할 수 있음을 제시했다(Xia et al., 2015a). 이를 증명하기 위해 Xia et al. (2015a)은 질산납의 투입량에 따른 희토류 광물의 품위 및 회수율 변화를 위한 연구를 진행하였다. 해당 연구를 통해 1,000 g/ton의 상대적으로 적은 양의 질산납을 사용 했을 때 경희토류 원소의 품위 및 회수율 증가를 보였으며, 2,000 g/ton의 양을 투입 할 경우 저어콘, 니오븀 등의 품위 향상이 크게 일어나는 것을 확인하였다. 활성 메커니즘은 pH 8.5-9 범위에서 지배적으로 존재하는 Pb(OH)+이온이 음의 전위를 갖는 광물에 정전기적으로 흡착하여 광물 표면 제타 전위의 음의 값을 일정량 상쇄하며, 이를 통해 음의 작용기를 갖는 하이드로자메이트 계열 포수제의 흡착을 용이해지기 때문으로 주장하였다. 이어서 Jorden et al.(2016)은 Thor lake 원광을 이용하여 부유선별 실험 후, 희토류 광물 및 맥석 광물에 대한 납 이온의 영향을 관찰 하는 기초연구를 진행하였다. 선행 연구와 비교하여 납 이온의 제공을 위해 질산 납 대신 염화납(PbCl2)을 사용하여 연구를 진행 하였으며, 셀의 크기, 샘플의 준비 과정 등의 차이가 존재 했지만, 최종적으로 납 이온의 첨가로 인해 희토류 광물 회수율의 증가를 확인하였다. 하지만, 맥석으로 존재하는 실리카 및 함철 규산염 광물들의 부유도도 함께 증가하여 선택성은 다소 감소하는 것을 확인하였다.
모나자이트의 부유선별
화학적 안정성이 뛰어나 표사광상의 중사로부터 주로 발견되는 모나자이트는 저어콘, 금홍석, 티탄철석, 석영 등을 주요 맥석으로 갖는다. 중사의 선광은 물리적 선별법이 주요 선광 공정으로 여겨지지만, 입도가 작은 해빈사(Beach sand) 정광으로부터 모나자이트의 선택적인 회수 및 비교적 단순한 맥석 광물 조성을 갖는 페그마타이트형 광상으로부터 산출되는 모나자이트의 회수에는 부유선별이 사용된다(Ferron et al., 1991). 대표적 희토류 광산인 Mountain Pass 광산에서도 바스트나사이트와 함께 산출된다. 모나자이트의 부유선별 공정은 산출되는 광상의 광물학적인 차이 때문에 바스트나사이트의 부유선별 공정과는 차이가 존재하며, 같은 광상을 통해 이루어지는 연구자료 또한 부족하다(Jordens et al., 2013). 하지만, 모나자이트의 선택적 회수를 위해 부유선별 공정에 주로 사용되는 포수제는 지방산 계열 및 하이드로자메이트 계열로써, 바스트나사이트에 사용되는 포수제의 종류와 크게 다르지 않다. 이는 두 광물 모두 Ce3+ 및 La3+ 등의 경희토류 이온을 공통적으로 함유하고 있고, 바스트나사이트와 같은 방식으로 광물 표면에서 3 가 양이온 상태로 존재하는 금속 이온과 포수제의 반응을 통해 금속 화합물을 형성하기 때문으로 설명된다. 하지만, 모나자이트와 함께 존재하는 주요 맥석들은 모나자이트의 부유선별 거동과 매우 유사하기 때문에 선택적인 모나자이트의 회수를 위해서는 포수제와 더불어 조절제의 적절한 사용이 필수적이다(Pavez and Peres, 1993). Table 5는 다양한 포수제 및 조절제를 사용한 모나자이트의 부유선별 연구들을 보여준다.
Table 5.
Summary of the flotation researches of Monazite
| Author | Year | Mineral | Collector | Conditioner |
| Choi and Whang | 1963 |
Monazite (Gu-rae, Jeon-La-Nam-Do) |
Dodecylammonium chloride SodiumDodecylSulphate Oleicacid Linolenicacid | - |
| Sorensen and Lundgaard | 1966 |
Monazite, steenstrupine in the Ore (from Kavanefjeld in Greenland) |
Oleic acid Sodiumoleate |
Sodium silicate Lanthanumnitrate (La(NO3)3) |
| A.M. Abeidu | 1972 | Monazite, zircon |
Sodium dodecylsulphate Oleicacid Dodecylamine | Sodium sulphide |
| Pavez and Peres | 1992 | Monazite, zircon, rutile |
Sodium oleat Potassiumhydroxamate V3759(hydroxamate) |
Sodum metasilicate Sodium sulphide |
| Pavez and Peres | 1994 |
Monazite, zircon, rutile (MG, Brazil) |
Commercial hydroxamate Sodiumoleate | Sodium metasilicate |
| Zhang et al. | 2016 |
Monazite (China), Calcite (USA), silica, Clay | Octyl hydroxamic acid |
Sodium hexametaphosphate |
| Abaka-Wood et al. | 2016 |
Monazite (RZ mine in Australia), hematite, quartz | Sodium oleate | - |
| Nduwa-Mushidi and Anderson | 2017 | Monazite (from new mexico) | Octanohydroxamic acid | - |
| Abaka-Wood et al. | 2017 | Monazite, hematite, quartz |
Sodium dodecyl sulphate Sodiumoleate Aerofloat6494 (hydroxamicacid) | - |
| Abaka-Wood et al. | 2017 | Monazite, hematite, quartz | Oleic acid | Sodium silicate Starch |
| Zhang and Honaker | 2017 | Monazite (in china) | Octanohydroxamic acid | - |
| Zhang et al. | 2017 | Monazite (China), calcite(USA) | Octanohydroxamic acid | - |
| Zhang and Honaker | 2018 | Monazite (China), calcite(USA) | Octano hydroxamic acid |
Sodium hexametaphosphate Sodiumsilicate Citricacid EDTA |
| Espiritu and Waters | 2018 |
Monazite (Carbonatite deposit in Namibia), dolomite (Sterling Hill Mine in USA) |
Benzohydroxamic acid Sodiumoleate Organicphosphoricacid (Flotionor1682) | - |
| Abaka-Wood et al. | 2018 | Monazite, hematite, quartz |
Aero float 6494 (hydroxamic acid) |
Sodium silicate starch |
부유선별을 통한 모나자이트의 회수기술은 1952년 Climax Corp. 사의 몰리브데나이트 부유선별 공정에서 발생하는 광미(Tailing)로부터 부산물을 선별하기 위해 아민계열의 포수제와 가성 녹말(Causticized starch)을 공정에 적용하기 시작하여, 1960~70년대에 들어 아민계열의 포수제, 올레인산 및 술폰산 등을 포수제로 사용하며 다양한 연구가 본격적으로 진행되었다(Houot et al., 1991). Choi and Whang (1963)은 국내 중사로부터 선광 된 모나자이트 샘플에 대해서 양이온 및 음이온 포수제를 이용해 부유선별 거동을 관찰하였다. 양이온 포수제인 Dodecylammonium chloride (C12H25NH3Cl)와 Sodium dodecyl sulfate(C12H25SO4Na), Oleic acid(C17H33COOH), Linolenic acid(C17H31COOH)를 사용한 부유선별 결과, 비교적 짧은 탄소 사슬을 갖는 양이온 포수제(Dodecylamine)와 음이온 포수제(Sodium dodecyl sulfate, SDS)는 모나자이트 표면의 제타 전위가 각각 음과 양의 전위를 가질 때 높은 회수율을 보여 전기적 인력으로 인해 결합하는 것으로 생각되었다. 반면에 탄소 사슬의 길이가 비교적 긴 음이온 포수제인 올레인산과 리놀렌산의 경우 모나자이트 표면의 제타전위가 음의 값을 갖는 pH 범위에서도 높은 부유도를 갖는 것을 실험을 통해 확인하였고, 이는 먼저 흡착된 포수제의 탄소 사슬 분자와 평행한 방향으로 반데르 발스(van der Waals) 힘에 의해 추가적인 포수제의 흡착이 발생하기 때문으로 설명하였다. 이와 유사한 결과는 Abeidu(1972)의 실험에서도 나타난다. 해당 연구에서는 양이온 포수제로 Dodecylamine을 사용하고 음이온 포수제는 SDS와 oleic acid를 사용한 결과, SDS를 포수제로 사용한 경우 모나자이트 표면이 양의 전위를 갖는 pH 5.5 이하의 영역에서 높은 회수율(약 95%)을 보였으며, Dodecylamine을 포수제로 사용 할 경우 음의 표면 전위를 갖는 pH 5.5 이상의 영역에서만 부유도(약 80%)를 갖는 것을 확인하였다. 이에 반해, 올레인산은 모나자이트 표면의 제타전위가 음의 값는 갖는 pH 6-8 범위에서도 높은 회수율(약 70%)을 가지는 것을 확인하였다. 전기적 반발력에도 불구하고 높은 부유도를 보이는 것은, 등전위점보다 높은 pH 범위에서 발생하는 화학적 흡착에 의한 결과로 설명된다(Cheng et al., 1993). 하지만, Pavez et al.(1996)의 연구결과에서는 올레인산 나트륨을 포수제로 사용한 경우, 등전위점 보다 낮은 pH 범위인 pH 2-3에서도 90% 이상의 높은 부유도를 갖는 것을 확인 하였고, 물리적 흡착 또한 발생하는 것으로 제안되었다. Espiritu et al.(2018b)은 적외선 분광법을 통해, 올레인산 나트륨으로 처리된 모나자이트 표면에서 물리적 흡착을 의미하는 카르복실산 이합체 신축 진동 피크(Carboxylic acid dimer C=O stretching vibration)와 화학적 결합을 지시하는 RE-올레이트 카복실레이트 비대칭 신축(RE-oleate carboxylate asymmetric stretching) 피크를 통해 물리적결합과 화학적 결합 모두 발생 할 수 있음을 확인하였다. Sorensen and Lundgaard(1966)은 올레인산과 올레인산나트륨의 비교를 위해 그린란드 Kvanefjeld에서 산출되는 모나자이트를 포함한 희토류 광의 부유선별 연구를 진행하였고, 포수제로 올레인산나트륨을 사용한 경우 올레인산을 사용했을 때 보다 더 높은 부유도 갖는 것을 확인하였다. 이 외에도, 대부분의 연구에서 올레인산은 높은 모나자이트의 부유도를 부여하는 것으로 확인되었으나, 함께 회수되는 맥석의 함량도 높아서 선택적인 분리가 다소 어려운 것을 확인하였다(Pavez and Peres, 1993; Pavez et al., 1996; Abeidu, 1972; Abaka-Wood et al., 2017b; Espiritu and Waters, 2018).
선택성이 떨어지는 지방산 계열의 포수제의 대안으로 희토류 광물에 대해 높은 선택성을 갖는것으로 알려진 하이드로자믹산을 이용한 연구 역시 다수 진행되어 왔다(Pavez and Peres, 1993, 1994; Zhang et al., 2016b, 2017; Zhang and Honaker, 2017a, 2018; Espiritu and Waters, 2018; Abaka-Wood at al., 2017a, 2017b, 2018). Pavez와 Peres (1993)는 억제제를 사용하지 않고 올레이트와 하이드로자메이트 계열의 포수제를 사용 했을 때, 모나자이트 뿐만 아니라 맥석으로 갖는 저어콘과 금홍석의 부유선별 거동의 차이는 없음을 확인하였다. 또한, 호주 남부의 모나자이트 광에서 주로 함유하는 맥석인 적철석과 석영에 대한 부유선별 거동과 모나자이트의 거동을 비교한 결과, 올레인산 나트륨과 하이드로자믹산 모두 모나자이트 뿐 만 아니라 적철석을 함께 부유시키는 것을 확인하였다(Abaka-Wood et al., 2017b). 방해석을 맥석으로 가질 때에도 octanohydroxamic acid를 포수제로 사용할 때, 5×10-5 M의 소량의 포수제를 사용 시 모나자이트와 방해석의 부유도가 각각 약 20%와 5%로 다소 선택성 가지는 것으로 확인되었으나, 그 이상의 농도에서는 선택성이 급격하게 감소하여 5×10-4 M이상의 농도에서는 두 광물 모두 부유 되어 대부분 회수되는 것을 확인하였다(Zhang et al., 2016b). 하지만, 모나자이트와 돌로마이트의 혼합 시료에 대한 부유선별 실험 결과, 올레인산나트륨을 사용한 경우 모나자이트과 함께 돌로마이트의 회수가 일어나는 반면, 벤조하이드로자믹산을 사용 했을 경우 모나자이트만 선택적으로 회수되는 결과를 얻었다(Espiritu and Waters, 2018).
앞선 연구결과들과 같이, 모나자이트는 잘 알려진 대표적 맥석인 저어콘, 금홍석, 석영 등의 광물뿐만 아니라 산출 지역에 따라서 방해석과 돌로마이트와 같은 탄산염 광물 및 적철석 등의 산화물 광물 등 다양한 광종을 맥석으로 갖는다. 이러한 다양한 광물학적 특징은 희토류 광물에 대해 높은 선택성을 갖는 하이드로자메이트 계열의 포수제의 사용에도 불구하고 선택적으로 모나자이트를 회수하는 것을 어렵게 만든다. 따라서 모나자이트의 선택성을 높이기 위해서 다양한 종류의 억제제 뿐 만 아니라, 활성제를 이용하여 다양한 연구들이 진행되었다. Table 5에 나타나듯이, 억제제로 잘 알려진 Sodium silicate 뿐만 아니라 Sodium sulfide, sodium hexametaphosphate, 녹말 등의 사용을 통해 모나자이트의 선택성을 높이기 위한 연구들이 진행되어왔다(Sorensen and Lundgaard, 1996; Abeidu, 1972; Pavez and Peres, 1993, 1994; Zhang et al., 2016; Abaka-Wood et al., 2017a, 2018; Zhang and Honaker, 2018). Sorensen and Lundgaard(1966)는 Kvanefjeld 희토류 광산의 원광으로부터 모나자이트의 회수를 위해 주요 맥석인 Arfvedsonite와 Aegirine등의 함철 광물을 억제를 위해 Sodium silicate를 사용하였으며, 억제제를 사용하지 않은 경우와 비교하여 더 높은 품위의 정광을 얻을 수 있었지만 모나자이트 또한 억제 되는 것을 확인했다. Abaka-Wood et al.(2017a, 2018)의 연구에서도 적철석과 석영의 억제를 위해 Sodium silicate를 사용하였다. 해당 연구에서, 억제제의 사용으로 적철석과 석영의 부유도가 각각 최대 29.13%, 13.86%까지 억제 되어 선택성은 증가 하였으나, 모나자이트의 억제도 다소 발생하는 것을 확인하였다. 방해석을 맥석으로 가질 때에도, 맥석의 억제와 동시에 모나자이트의 억제도 발생하는 것이 확인되었다(Zhang and Honaker, 2018). 모나자이트와 방해석의 혼합시료를 이용한 부유선별 결과, 방해석의 억제를 위해 사용된 Sodium silicate와 Sodium hexametaphosphate는 효과적으로 대부분의 방해석을 억제 할 수 있었지만, 억제제의 사용에 따라 모나자이트 또한 큰 범위로 억제 되었다. Sodium silicate의 경우 Sodium hexametaphosphate 보다 모나자이트에 대한 억제 효과가 적어 상대적으로 높은 선별효율을 가짐을 확인하였다. Sodium silicate에 의한 모나자이트의 억제 메커니즘은 모나자이트 표면에서 발생하는 칼슘 화합물(CaCO3와 CaHCO3+)과 실리콘 수산화물(Si(OH)4와 SiO(OH)3-)의 동시흡착에 의한 것으로, 포수제의 흡착을 방해하기 때문으로 설명된다.
또 다른 억제제인 Sodium sulfide은 10 mg/L의 비교적 적은 양을 사용하면 저어콘과 모나자이트에 대한 활성제로 사용 될 수 있지만, 37.5 mg/L의 양을 사용하면 모나자이트의 부유도에는 영향을 미치지 않고 저어콘의 억제가 가능함이 보고되었다(Zakharov et al., 1967). 이를 바탕으로, Abeidu(1972)는 부유선별을 통한 모나자이트와 저어콘의 분리를 위해 Sodium sulfide를 사용하여, 다양한 포수제(SDS, Dodecylamine, Oleic acid)에 대한 모나자이트와 저어콘의 부유선별 거동을 비교하였다. 실험 결과, 올레인산을 포수제로 사용한 경우 Sodium sulfide의 사용량에 따라 저어콘이 다소 억제 되며, 모나자이트의 부유도가 크게 증가하여 선택성이 증가하는 것을 확인하였다. 모나자이트 표면에서의 활성 메커니즘은 다음 식 (1), (2)와 같이 S2- 및 SH- 이온이 인산 이온과 결합하여 포수제 흡착을 위한 새로운 활성 표면을 제공하는 것으로 제시하였다. 반면 저어콘 표면에서는 음의 전하에 의한 전기적 반발력에 의해 S2-및 SH-의 흡착이 일어나지 않으므로, 저어콘의 부유도의 변화가 나타나지 않았다.
Pavez and Peres(1993)는 Sodium metasilicate와 Sodium sulfide의 억제 효과를 비교하기 위해 모나자이트, 저어콘, 금홍석의 혼합시료를 이용하여 부유선별 연구를 진행하였고, 메타 Sodium silicate의 사용량에 따라 저어콘과 금홍석의 부유도를 10% 미만으로 억제 시킬 수 있어 Sodium sulfide보다 더 큰 억제 효과를 가지는 것을 확인하였다. 또한, 앞선 Abeidu(1972)의 논문에 언급된 것과 같이, 비교적 높은 농도의 Sodium sulfide를 사용했을 때 하이드로자믹산을 포수제로 사용한 경우 모나자이트의 부유도가 다소 증가하여 모나자이트의 활성 효과를 갖는 것이 관찰되었다.
녹말은 규산염, 바륨, 철 등의 원소를 함유한 맥석의 억제제로 사용될 수 있으며, 광물 표면에서 이미 흡착된 포수제에 대한 가리움제(masking)로 작용하여 광물에 소수성을 부여하는 것으로 알려져 있다(Houot et al., 1991; Somasundaran and Wang, 2006). Abaka-Wood et al.(2017a, 2018)은 녹말을 억제제로 사용하여 적철석과 석영을 효과적으로 억제 할 수 있음을 실험을 통해 확인 하였지만, 부유선별에 사용되는 포수제의 종류에 따라 녹말의 억제 효과에 차이가 존재하는 것을 알 수 있었다. 올레인산을 포수제로 사용한 경우 1,000 g/t의 낮은 농도에서 세 광물 모두 억제되기 시작하여, 8,000 g/t의 농도에서는 적철석 및 석영뿐 만 아니라, 모나자이트까지 100% 억제 된 반면(Abaka-Wood et al., 2017a), 하이드로자믹산을 사용한 실험 조건에서는 8,000 g/t의 녹말을 억제제로 사용했을 경우, 억제제를 사용하지 않은 경우보다 선택성이 다소 높아지는 것을 확인하였다(Abaka-Wood et al., 2018).
맥석으로부터 용해된 이온에 의해 모나자이트의 부유도가 감소한 사례도 존재한다. Zhang et al.(2016b, 2017)은 용해도가 비교적 큰 탄산염 광물인 방해석이 맥석으로 존재할 때 적은 양의 하이드로자믹산(3.0 × 10-4 M)을 사용 할 경우 모나자이트의 부유를 억제시키는 것을 확인하였다. 부유도의 감소는 모나자이트 표면에 존재하는 인산염에 대한 CaOH+이온과 하이드로자믹산의 경쟁 흡착에 의해 발생된 포수제 흡착농도의 감소로 인한 것으로 설명된다. 칼슘의 흡착은 다음 식 (3),(4),(5),(6)과 같이 광물표면의 인산염 및 희토류 산화물에 존재하는 산소기와 칼슘 수산화물의 정전기적 인력(식 (3), (4)) 혹은 광물 표면에 존재하는 수산화기와 수소결합에 의해 발생하는 것으로 생각된다(식 (5), (6)). 칼슘에 의한 억제 효과를 제거하기 위해 추가적인 연구가 계속되었고, Zhang et al.(2018)은 모나자이트의 부유도 개선을 위해 시트르산과 EDTA를 사용하여 모나자이트 표면에 흡착된 칼슘이온을 제거한 결과, 효과적으로 킬레이트를 형성해 칼슘이온을 제거할 수 있음을 확인하였다.
이 식에서 REE는 희토류를 의미한다.
제노타임의 부유선별
일반적으로 모나자이트의 약 0.5~5% 비율로 함께 수반되어 나타나는 제노타임은 중사 광물 및 주석 광물의 선광과정에서 부산물로 회수되며, 중희토류인 이트륨의 회수를 위한 주요 광물로 여겨진다(Ferron et al., 1991; Jordens et al, 2013). 부유선별을 통한 제노타임의 회수는 역부선을 통해 모나자이트와 제노타임을 맥석으로 남기고, 직접부선을 통해 모나자이트로부터 분리되는 2단계 부유선별 공정을 통해 이루어질 수 있다(Chelgani et al., 2015). 바스트나사이트와 모나자이트와 비교하여 제노타임의 부유선별 연구에 대한 문헌 정보는 매우 한정적으로 존재하며, Table 6은 제노타임 부유선별 연구 문헌 정보를 보여주고 있다.
Table 6.
Summary of the flotation researches of Xenotime
| Author | Year | Mineral | Collector | Conditioner |
| Cheng et al. | 1993 | Monazite, Xenotime | Sodium oleate | - |
| Cheng et al. | 1994 | Xenotime | Sodium oleate | - |
| Pereira and Peres | 1997 |
Xenotime (95%), zircon (5%) (from Pitinga mine in Brazil (Sn mine) |
V3579 (hydroxamic acid) |
Lignin sulfonate Quebracho Conventionalcornstarch (RMR) Amylopectin Sodiummetasilicate |
| Zhang and Anderson | 2016 |
Xenotime, ilmenite, staurolite, zircon, schorl |
Sodium oleate Octanohydroxamicacid |
Sodium silicate Ammoniumlignosulfonate |
| Satur et al. | 2016 | Ore (Xenotime contents 0.46%) |
Tall oil fatty acid (Aero 704) SylfatFA2 |
Sodium metasilicate Sodiumligninsulfonate Sodiumfluoride Solublestarch |
| Zhang and Anderson | 2017 |
Xenotime (rutile plant in Hainan province in China) |
Sodium oleate Octanohydroxamicacid |
Sodium silicate Ammoniumlignosulfonate |
Cheng et al.(1993)은 제노타임의 부유선별 거동 및 흡착 메커니즘을 규명하기 위해 올레인산 나트륨을 포수제로 하여 부유선별 연구를 진행하였고, 최대 부유도를 갖는 pH 7.5 조건에서 대부분의 제노타임이 회수 가능함을 확인하였다. 또한, 포수제와 광물 표면의 흡착 강도(Adsorption strength)가 강할수록 높은 회수율을 갖는 경향을 관찰하였다. 해당 연구에서는, 제노타임 표면에서 올레인산 나트륨의 흡착 메커니즘은 규명해내지 못했다. 이는 Ce3+와 La3+ 등의 경희토류를 함유하는 바스트나사이트, 모나자이트와는 달리, 제노타임에 대한 Species diagram를 규명하기 위한 문헌 정보가 부족하였기 때문으로 설명된다. 하지만, 음의 제타전위를 갖는 범위에서 갖는 높은 회수율을 화학적 흡착에 대한 증거로 제시하였다. 이후 Cheng et al.(1994)은 소프트웨어를 이용해 제노타임의 Species diagram과 이트륨 이온의 용해도 계통도(Solubility diagram)를 작성하였고, 염기성 조건에서 지배적으로 존재하는 Y(OH)2+ 이온 농도 곡선과 회수율 곡선이 유사한 경향을 보이는 것을 확인하였다. 이러한 결과는, 앞서 모나자이트와 바스트나사이트의 흡착 메커니즘에서 설명된 희토류 수산화물의 흡착에 의한 포수제의 화학적 흡착 메커니즘으로 설명 될 수 있다. 산성 영역에서도 올레인산 나트륨의 높은 흡착밀도를 가졌으나, 높은 회수율로 이어지지는 않았다. 이는 Fig. 8과 같이, 산성영역에서는 낮은 용해도로 인해 친수성기가 밖으로 향하는 미셀(micelle)을 형성하여 광물 표면에 침전이 발생하기 때문이다. 이렇게 발생한 침전은 광물표면을 더욱 친수성화 시키며 및 친수성화 된 광물 입자들간의 집합(aggregation)에 의해 낮은 부유도를 갖게 만들 수 있다.
Pereira and Peres(1997)는 포수제로 하이드로자믹산(V3579)을 사용하여 제노타임과 맥석으로 갖는 저어콘의 부유선별 거동을 관찰하였고, pH 10과 포수제 사용량 20~50 mg/L의 조건에서 약 98%의 부유도를 갖는 것을 확인하였다. 제타전위 측정 결과, 등전위점 이상의 pH 범위(pH 3 이상)에서 하이드로자믹산에 의한 광물 표면 제타전위의 뚜렷한 변화는 관찰되지 않았다. 하지만 화학적 결합을 의미 할 수 있는 등전위점 주변 범위인 pH 2~3에서는 음의 값을 유지하였다. Zhang and Anderson(2017a)은 제노타임의 선택적 회수를 위해 하이드로자믹산(octano hydroxamic acid)을 사용하여, 중국 하이난에 위치한 금홍석 광산으로부터 얻어진 광물에 대한 부유선별 연구를 진행하였다. 주요 맥석으로 티탄철석, 저어콘, 숄(schorl), 십자석(staurolite) 등을 맥석으로 갖는 광물 시료를 이용한 부유선별 결과, pH 9 조건에서 제노타임에 대한 포수제의 흡착 밀도는 맥석에 대한 값 보다 낮았지만, 회수율은 다소 더 높은 값을 가지는 것이 확인되었다. 하지만 각 광물이 갖는 회수율의 차이가 크지 않아 선택 주요 맥석의 억제를 위한 억제제의 사용이 필요할 것으로 예상하였다. 포수제와 제노타임의 흡착 메커니즘은 제타 전위와 회수율의 비교를 통해 화학적 흡착이 발생 할 것으로 제시하였고, species diagram을 통한 Y(OH)2+ 이온 분포와 회수율의 비교를 통해 화학적 흡착에 대한 의견을 뒷받침 하였다. 앞선 연구에 이어서, 동일한 광물조성에서 올레인산 나트륨과 하이드로자믹산(octano hydroxamic acid)을 이용하여 제노타임 부유선별에 대한 선택성을 비교하는 연구도 진행되었다(Zhang and Anderson, 2017b). 선택성 비교를 위해 pH 9 조건에서 0.0005 M의 포수제 농도를 사용해 실험을 진행하였으며, 두 포수제 모두 93% 이상의 회수율을 가짐을 확인했다. 하지만 하이드로자믹산을 사용한 경우 약 1~4% 높은 회수율을 가졌다. 회수된 정광의 품위의 경우 올레인산 나트륨을 사용한 경우 더 높은 품위를 갖는 것이 확인되었다. 하이드로자믹산을 사용한 경우 더 높은 회수율을 갖는 것은 더 짧은 탄소 사슬을 갖는 경우 기포의 안정성이 증가하기 때문으로 설명되며, 이러한 의견은 Wiese et al.(2011)의 의견과 일치한다.
제노타임 또한 포수제의 적절한 사용에 따라 높은 부유도를 갖지만, 주요 맥석 광물들과 부유선별 거동이 비슷하여 선택성을 높이기 위해서는 억제제의 사용이 필수적이다. Pereria and Peres(1997)은 하이드로자메이트 포수제를 이용하여 약 98%의 제노타임 회수율을 얻었고, 해당 실험조건에서 저어콘의 억제를 위해 Lignin sulfonate, Sodium metasilicate, Quebracho, Corn starch, Amylopectin를 억제제로 사용하여 각 억제제의 성능을 비교하였다. 실험결과 Quebracho와 Amylopectin은 저어콘의 억제효과가 낮을 뿐만 아니라 제노타임의 부유도도 큰 폭으로 억제시켰으며, Lignin Sulfonate는 제노타임의 부유도에는 영향을 미치지 않았지만 저어콘에 대한 억제효과가 떨어지는 것이 관찰되었다. 반면에 Sodium metasilicate와 옥수수 녹말은 제노타임의 부유도(각각 93.9%, 96.5%)에는 영향을 미치지 않으며, 저어콘의 회수율을 21.6%, 30.8%까지 억제시켜 가장 효과적인 억제제임을 확인하였다. Ammonium lignosulfonate와 Sodium silicate는 저어콘의 억제 외에도, 티탄철석(Ilmenite), 전기석(Schorl), 십자석(Staurolite)의 억제를 위해 사용되었다(Zhang and Anderson, 2017b). 일반적으로 알려진 바와 같이, Sodium silicate의 경우 올레인산나트륨을 포수제로 사용하면 저어콘 등과 같은 규산염의 억제제에 효과적으로 사용될 수 있으며, Ammonium lignosulfonate은 올레인산나트륨과 사용하면 철을 함유한 맥석의 억제에 효과적인 것으로 설명하였다. 하지만, 두 억제제 모두 하이드로자믹산을 포수제로 사용 시 티탄철석에 대한 억제 효과는 미미함을 확인하였다. 이는, 광물 표면에 존재하는 Fe2+ 이온의 경우, 두 억제제의 규산질 이온 및 술폰산 이온(R-SO3-)보다 하이드로자믹산과 우선적으로 결합하여 여전히 부유도를 갖기 때문으로 설명된다.
결 론
본 연구에서는 대표적 희토류 광물인 바스트나사이트, 모나자이트, 제노타임의 부유선별 연구에 대한 문헌 정보를 통해, 희토류 광물의 화학적 조성 및 기원, 표면 특성, 흡착 메커니즘, 부유선별 시약의 종류 및 효과에 대한 정보를 정리하였다. 희토류의 대부분의 공급량을 생산하고 있는 Bayan Obo 광산 및 Mountain Pass 광산은 부유선별을 통해 희토류 광물 정광을 회수하고 있어 비교적 문헌 정리가 체계적인 반면, 중소 광산에서 산출되는 희토류 정광에 대한 부유선별 연구 문헌은 여전히 한정적으로 존재했다. 희토류 광물은 생성 기원이 되는 모암의 종류에 따라서 다양한 맥석과 함께 산출되어, 같은 광물에 대해서도 다른 부유선별 조건을 필요로 하는 특징을 가졌다. 특히, 산출 지역에 따른 다양한 희토류 광물의 화학적 조성 및 격자 구조의 차이는 다양한 범위에서 등전위점을 갖게 하는 주요 요인인 것으로 확인되었다. 문헌 조사를 통해 획득한 바스트나사이트의 등전위점은 염기성 영역에서 대부분 관찰되었고, 모나자이트와 제노타임의 경우 산성 영역에 위치한 것을 확인하였다. 세 광물 모두 희토류 이온과 포수제의 작용기 사이의 배위공유결합을 통한 화학적 흡착을 통해 포수제와 결합될 것으로 제안되었으며, 적외선 분석을 통해서 이를 뒷받침 하였다. 자연적으로 친수성 표면을 갖는 희토류 광물들은 지방산 계열 및 하이드로자메이트 계열 포수제를 통해 쉽게 부유되었으며, 많은 연구에서 하드로자메이트 계열의 포수제의 선택성이 높음을 입증하였다. 또한, 포수제의 사용에 따른 맥석의 부유도 증가도 함께 발생하여, 포수제와 적절한 억제제의 사용이 필수적으로 요구되는 점을 시사했다.
산업의 비타민이라 불리는 희토류 원소는 각 원소들의 고유한 특성으로 인해 첨단 산업의 발전과 함께 그 수요가 함께 증가하고 있지만, 몇몇 대규모 광산에 공급을 의존해야 하며, 토륨 등의 방사선 물질 폐기물이 생산되며, 분리 정제 공정에서 막대한 환경오염을 줄 수 있는 점은 희토류 안정적인 공급에 큰 걸림돌이 되어왔다. 또한, 한 국가로부터 대부분의 공급을 의존해야 하는 사실은 희토류의 공급 불안정성을 꾸준히 야기 시켜왔고, 2010년 중국과 일본 사이의 수출 중단 사태는 큰 의존성이 무역 전쟁의 공격 수단이 될 수 있는 사례가 되었다. 이를 극복하기 위한 노력으로, 이미 개발 중인 대형 및 중소 희토류 광산의 및 새로운 희토류 광산의 효율적 생산을 위한 다양한 연구 개발이 진행되어왔고, 편중된 공급의 불안정성을 다소 완화시키는 결과를 얻었다. 하지만, 여전히 선별 효율을 높이기 위한 과제를 가지고 있으며, 새롭게 발견되는 광상에 대한 새로운 연구들이 지속적으로 이루어질 필요성이 존재한다. 본 연구에서 제공한 정보는 현재 생산 중이거나 새로이 발견되는 희토류 광상에 대한 효율적인 부유선별 공정 설계를 위한 기본적인 참고자료가 될 것으로 기대된다.