서론
하이드레이트 구조
구조 I
구조 II
구조 H
하이드레이트 구조의 영향
하이드레이트의 물리/화학적 특성
하이드레이트 상평형과 해리 엔탈피
퇴적층 내 하이드레이트의 물리적 특성
퇴적층 내 하이드레이트의 지구 화학적 특성 및 지표
하이드레이트 생성 기원(Origin) 및 분포, 생산기술
생물기원(Biogenic)과 열기원(Thermogenic) 하이드레이트
하이드레이트 분포와 매장량
하이드레이트 생산기술 및 현황
하이드레이트의 지구 환경적 영향
결론
서론
인류 사회는 지난 몇십 년간 꾸준한 인구의 증가, 경제와 산업의 발전을 이룩해왔으며, 이에 따라 전 세계의 전력 소비량 또한 지속적으로 증가해왔다. 미국 에너지 관리청(U. S. Energy Information Administration, EIA)의 보고에 의하면 전 세계 전력 소비량은 2040년대까지 꾸준하게 증가할 것으로 예상되며, 특히 인도와 중국과 같은 신흥공업국(Newly Industrialized Countries, NIC)을 중심으로 급속도로 증가할 것이라 여겨지고 있다(U.S. Energy Information Administration, 2013). 이러한 움직임과 더불어 전력 생산의 기초가 되는 1차 에너지원(Primary Energy Sources)의 요구치도 꾸준히 증가하고 있으며, 현재 전력 생산량의 약 80%에 가까운 양이 석탄, 석유, 천연가스와 같은 탄소기반 화석연료를 이용하고 있다(U.S. Energy Information Administration, 2013). 화석연료의 지속적인 사용을 통한 환경오염 및 기후변화에 발맞춰, 세계의 여러 국가들은 파리 협약(Paris Agreement)을 통하여 신 기후체계를 목표로 대체 에너지 개발, 에너지 효율 향상 등의 에너지 관련 새로운 산업 개발에 몰두하고 있다. 특히, 최근의 국내 에너지 정책은 탈원전, 탈석탄을 기조로 하여 천연가스로의 에너지발전 시스템전환을 목표로 로드맵을 세워 움직이고 있다. 2011년 발표된 국제 에너지 기구(International Energy Agency)의 특별보고서에 따르면, 기존의 천연가스(Conventional Gas)와 개발단계에 있는 셰일가스 및 석탄층메탄가스와 같은 비전통 천연가스(Unconventional Gas)의 양은 향후 약 250년간 사용할 수 있을 만큼 충분하다고 여겨지고 있다(International Energy Agency, 2011). 하지만 이러한 예상치는 커다란 불확실성에 기반하고 있기에, 2012년의 보고서에서는 회수 가능한 미국 내 셰일가스 매장량은 482 TCF(Trillion Cubic Feet)로 전 년도 수치인 827 TCF에서 급격히 감소된 수치로 예측되었다(U.S. Energy Information Administration, 2012). 이에 따라, 비전통 천연가스 종류의 하나인 천연가스 하이드레이트(Natural Gas Hydrate, NGH)에 대한 관심이 증가되고 있다.
가스 하이드레이트(Gas Hydrate)는 낮은 온도와 높은 압력의 조건에서 저분자량의 가스 분자와 물 분자가 모여 형성된 3차원 결정성 포접화합물(Inclusion compound)을 일컫는다(Sloan, 2003). 물 분자들은 수소 결합(Hydrogen Bond)을 통해 주체(Host) 구조를 형성하며, 이 때 수소 결합에 의해 형성된 동공(Cage) 내에 저분자량의 가스 분자들이 객체(Guest)로써 포집(Inclusion)되어 안정된 구조를 형성하게 된다(Sloan, 2003; Youn and Cha, 2018). 이러한 가스 하이드레이트가 최초로 알려지게 된 것은 1810년 경 Davy 경에 의해 0 oC 이상의 온도에서 얼음과 유사한 형태의 물질이 발견되면서 부터이다. 이 발견은 학자들의 호기심을 일으켰으며 지속적인 연구 수행 결과로 다양한 하이드레이트의 조성(Composition), 생성/해리(Formation and Dissociation), 상변화(Phase Change), 결정 구조(Crystal Structure) 등과 같은 학문적인 발전이 이루어져왔다(Sloan, 2003). 학계의 관심에서 머물던 가스 하이드레이트가 본격적으로 산업계의 주목을 받기 시작한 것은 1934년 Hammerschmidt의 의한 논문 발표에 의해서다(Hammerschmidt, 1934). 이 논문 발표에 따르면, 천연가스의 수송 과정 중 파이프라인(Pipeline)은 가스 하이드레이트의 생성으로 인해 막힐 수 있으며 이에 대한 해결책으로 억제제(Inhibitor)의 투입이 필요하다는 점이 강조되었다. 이 발견은 아직까지도 가스 및 유전 개발에서 지속적으로 해결해야 할 과제로 손꼽히고 있으며, 지금까지도 지속적인 연구가 수행되고 있다.
이러한 가스 하이드레이트는 1965년 러시아의 시베리아(Siberia) 영구 동토층(Permafrost) 지역에서 방대한 양의 천연가스가 하이드레이트의 형태로 부존되어 있음이 발표되면서 전환점을 맞이하게 된다(Makogon, 1965). 시베리아 지역에서의 천연가스 하이드레이트 존재 발표를 시작으로 전 세계 지역까지 천연가스 하이드레이트에 대한 탐사가 1980년 이후부터 본격적으로 이루어졌으며, 기존의 화석연료를 대체할 수 있는 에너지 자원으로서의 가스 하이드레이트에 대한 중요성이 대두되기 시작하였다(Makogon et al., 2007). 이에 따라, 국내에서도 2007년 세계 5번째로 동해 울릉분지 지역의 천연가스 하이드레이트 실물 채취에 성공한 사실이 언론을 통해 알려지며 큰 관심을 불러일으켰다(Chong et al., 2016). 이에 앞서, 2002년에는 미국, 캐나다, 독일 등으로 구성된 컨소시엄의 의해 캐나다의 영구동토층 중 하나인 Mallik 지역의 천연가스 하이드레이트에 대한 시험생산이 이루어짐에 따라, 대체 에너지 회수에 대한 기술 도입이 시도되고 있다. 그 뒤에도 2008년 같은 Mallik 지역, 2012년 미국 Alaska 지역, 2013년 일본 Nankai Trough 지역에서의 시험생산 등이 꾸준히 이루어지며, 상업적 천연가스 하이드레이트의 개발을 위한 움직임이 지속되고 있다(Chong et al., 2016).
우리나라는 천연가스 하이드레이트에 대한 본격적인 연구가 미국 및 유럽, 일본 등에 비하여 늦게 시작되긴 하였지만, 꾸준한 연구 성과 달성과 지속적인 투자를 통하여 동해 천연가스 하이드레이트의 실물 채취에 성공하였다. 또한 지속적인 연구 결과, 효율적인 하이드레이트 생산 기법 개발에도 힘을 쏟고 있어, 천연가스 하이드레이트 개발을 위한 프로젝트도 운영 중이다. 미래 에너지로서의 가스 하이드레이트를 제대로 이해하고 안전하게 대체에너지원인 가스 하이드레이트를 개발하기 위해서는, 가스 하이드레이트의 특성, 하이드레이트의 생성 기원과 전 세계적인 분포, 하이드레이트의 매장량과 이에 대한 생산기법 이해가 반드시 필요하다. 또한 천연가스 하이드레이트의 생성과 해리 과정을 통한 지구환경적인 영향 역시, 미래 에너지로서의 가스 하이드레이트를 이해하는데 핵심 분야라 할 수 있다. 이에 따라 본 총설에서는 가스 하이드레이트와 이의 물리/화학적 특성, 그리고 지구화학적 변화 거동에 대하여 고찰하였다.
하이드레이트 구조
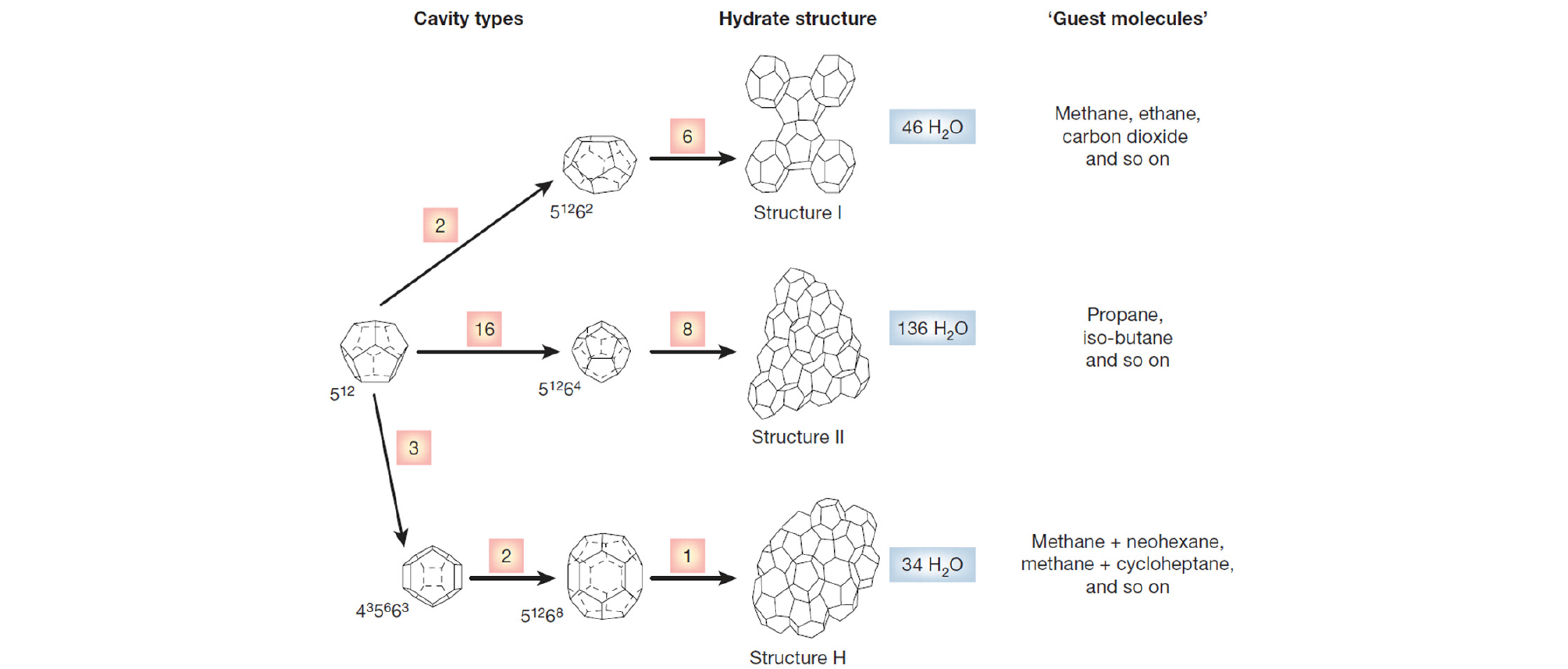
가스 하이드레이트는 낮은 온도와 높은 압력의 조건에서 물 분자들이 서로 수소 결합을 통해 형성되는 주체(Host) 구조의 동공(Cage) 내에 메탄, 수소, 질소, 이산화탄소와 같은 저분자량의 기체 분자들이 객체(Guest)로서 포집되는 결정구조를 말한다(Sloan, 2003). 수소 결합을 이루고 있는 물 분자들의 형태에 따라 동공 구조는 다양한 크기와 모양을 가지게 되며, 이 들의 조합에 따라 Fig. 1과 같은 다양한 결정구조(Crystal Structure)를 가지게 된다. 물 분자로 구성되는 동공의 종류에는 12개의 5각면(Pentagonal Face)이 모여 형성된 12면체의 512, 12개의 5각면과 2개의 6각면(Hexagonal Face)으로 구성된 14면체의 51262 등 구성되는 면의 형태와 개수로 정리하고 있다(Sloan, 2003). 이에 따라, 생성되는 대표적인 가스 하이드레이트 결정구조로는 구조 I(Structure I), 구조 II(Structure II), 그리고 구조 H(Structure H) 하이드레이트가 존재한다. 각각의 구조는 서로 다른 물 분자의 개수와 동공의 종류, 형태 등을 가지고 있다. 이에 따라 정리된 하이드레이트 구조의 형태, 구조별 동공의 크기와 물성은 Fig. 1 및 Table 1과 같다.
Table 1. Description of hydrate cage and hydrate crystal structure (Sloan, 2003)
가스 하이드레이트의 결정구조를 구성하는 기본 단위체인 동공은 물 분자 사이의 수소 결합에 의해 결정된다. 이에 따라, 포집되는 객체 분자(Guest Molecule)의 크기는 가스 하이드레이트의 구조를 결정하는 중요한 변수로 작용하게 되며, 이는 객체 분자와 동공의 크기비(R=Molecular Diameter/Cage Diameter)로 종종 표현하고 있다(Sloan, 2003). 객체 분자의 크기가 동공의 크기보다 훨씬 커서, 크기비(R)가 1을 크게 넘는 경우에는 객체 분자의 왜곡 없이는 동공에 안정되게 포집되기 힘든 상태라 할 수 있다. 반대로 객체 분자의 크기가 동공의 크기에 미치지 못하여 크기비(R)가 0.76보다 훨씬 작은 경우에는, 동공 내에서 객체 분자가 반데르발스 상호작용을 통한 안정된 구조의 유지가 힘들어 구조의 형성이 어렵다.
구조 I
구조 I 하이드레이트는 46개의 물 분자와 함께 구성된 6개의 51262, 2개의 512 동공 구조를 기반으로 입방정계(Cubic) Pm3n의 결정구조를 이루고 있다(Fig. 1). 입방정계 Pm3n의 구조 I 하이드레이트 결정구조는 약 a = 1.2 nm의 격자상수(Lattice Parameter) 값을 가지고 있으며, 대표적으로 메탄(Methane), 에탄(Ethane), 이산화탄소(Carbon Dioxide), 황화수소(Hydrogen Sulfide)와 같은 가스 분자가 구조 I 하이드레이트를 형성하는 것으로 알려져 있다(Sloan, 2003). 메탄, 이산화탄소, 황화수소와 같은 가스는 심해저의 해저 면에서 생성되는 생물학적 가스(Biogenic Gas)의 성분과 유사하기에, 대다수의 해저 면에서 발견되는 천연가스 하이드레이트의 경우는 구조 I을 보이는 경우가 많다.
구조 II
구조 II 하이드레이트는 입방정계(cubic) Fd3m의 결정구조로 약 a = 1.72 nm의 격자상수를 가지고 있다(Fig. 1). 동공의 구성 형태는 8개의 51264, 16개의 512 동공이 136개의 물 분자에 의해 구성되며, 구조 I 하이드레이트에 비하여 비교적 큰 동공(51264)을 가지고 있어 프로판(Propane), 아이소부탄(Isobutane)과 같은 가스 분자들이 구조 II의 형성 가스로 알려져 있다(Sloan, 2003). 때에 따라서, 구조 I 하이드레이트를 형성하는 것으로 알려진 메탄과 에탄 가스의 경우도 특정한 비율로 혼합되어 있는 상태의 경우에는 구조 II를 형성하기도 한다. 이 밖에, 수소, 질소, 산소와 같이 분자 크기가 상대적으로 동공에 비해 작은 경우에는 512 동공의 비율이 더 많은 구조 II 하이드레이트를 형성하는 것을 선호한다. 구조 II 하이드레이트의 경우, 석유나 천연가스의 생성 기원에 해당하는 열적 가스(Thermogenic Gas)의 성분을 포함하는 경우가 있어 자연계에서 종종 발견되기도 한다.
구조 H
육방정계(hexagonal) P6/mmm의 결정구조를 가지고 있는 구조 H 하이드레이트는 약 a = 1.22 nm, c = 1.01 nm의 격자상수를 가지고 있다(Sloan, 2003). 1개의 51268, 2개의 435663, 3개의 512 동공이 34개의 물 분자에 의해 구성된다. 51268 동공은 상당히 큰 분자 크기를 포집할 수 있기 때문에, 네오헥산(Neohexane), 메틸사이클로헥산(Methylcyclohexane)과 같이 분자가 포집되는 것이 가능하다. 하지만 일반적으로 네오헥산과 같은 분자는 단독으로 구조 H를 형성하지는 못하기 때문에, 메탄과 같은 가스의 도움(Help Gas)을 받아 같이 포집되며 구조 H를 형성하는 것으로 알려져 있다. 구조 II 하이드레이트와 유사하게 많은 탄화수소를 포함하고 있는 객체 분자의 경우, 열적 과정(Thermogenic Process)에 의해 생성되며 이에 따라 자연계에서 구조 H 하이드레이트는 종종 발견된다.
하이드레이트 구조의 영향
가스 하이드레이트 구조는 포집되는 객체 분자의 종류에 따라 형태를 달리하지만, 가스 하이드레이트의 구조가 바뀌어도 그 성분은 약 80% 이상의 물과 나머지의 객체 분자로 구성되게 된다. 비록 하이드레이트의 구성 성분 비율에는 큰 변화가 없지만, 하이드레이트 구조의 변화에 따라 동공 내 포집되는 객체 분자의 종류나 조성이 변하게 되며 이는 가스 하이드레이트의 상평형 조건과 물성 변화를 야기하게 된다. 가스 하이드레이트의 상평형 조건은 하이드레이트 구조를 안정하게 유지하기 위한 온도와 압력 조건을 보통 일컬으며, 특히 자연계에 매장되어 있는 천연가스 하이드레이트의 열역학적 안정성을 평가하기 위해서 필수적으로 파악해야 하는 정보에 해당한다. 또한 하이드레이트의 조성 변화는 천연가스 하이드레이트 내 천연가스의 부존량 등 기초 물성에도 변화를 일으킴으로, 하이드레이트 구조의 이해는 안정적인 에너지개발을 위한 하이드레이트 응용 기술 개발에 필수적이라 할 수 있다.
하이드레이트의 물리/화학적 특성
앞서 언급한 바와 같이 하이드레이트의 구조는 포집되는 객체 분자에 따라 변하지만, 일반적으로 그 구성 성분은 약 85%의 물과 15%의 객체로 이루어진다. 이에 따라, 하이드레이트의 기계적 특성(Mechanical Property)은 얼음의 특성과 매우 유사한 형태를 이루게 된다. Table 2는 얼음, 구조 I, 구조 II 하이드레이트의 다양한 물성 비교치를 보여주고 있으며, 특히 기계적 성질의 경우 얼음과 하이드레이트 구조 간에 큰 차이를 보이지 않음을 알 수 있다. 열전도도(Thermal Conductivity) 및 열팽창계수(Thermal Expansivity)의 경우에는 하이드레이트 내 동공 구조와 객체 분자의 특성으로 인하여 다르게 나타나는 것으로 확인된다. 하지만, 실제 자연에서 발견되는 천연가스 하이드레이트의 경우 다공성 매질에서 퇴적물과 함께 발견되는 만큼, 퇴적층 내 함유된 하이드레이트의 물리적 특성과 화학적 특성은 하이드레이트의 탐사뿐만 아니라 생산에도 핵심 정보를 제공해준다.
Table 2. Comparison of ice and gas hydrates (Sloan, 1998)
하이드레이트 상평형과 해리 엔탈피
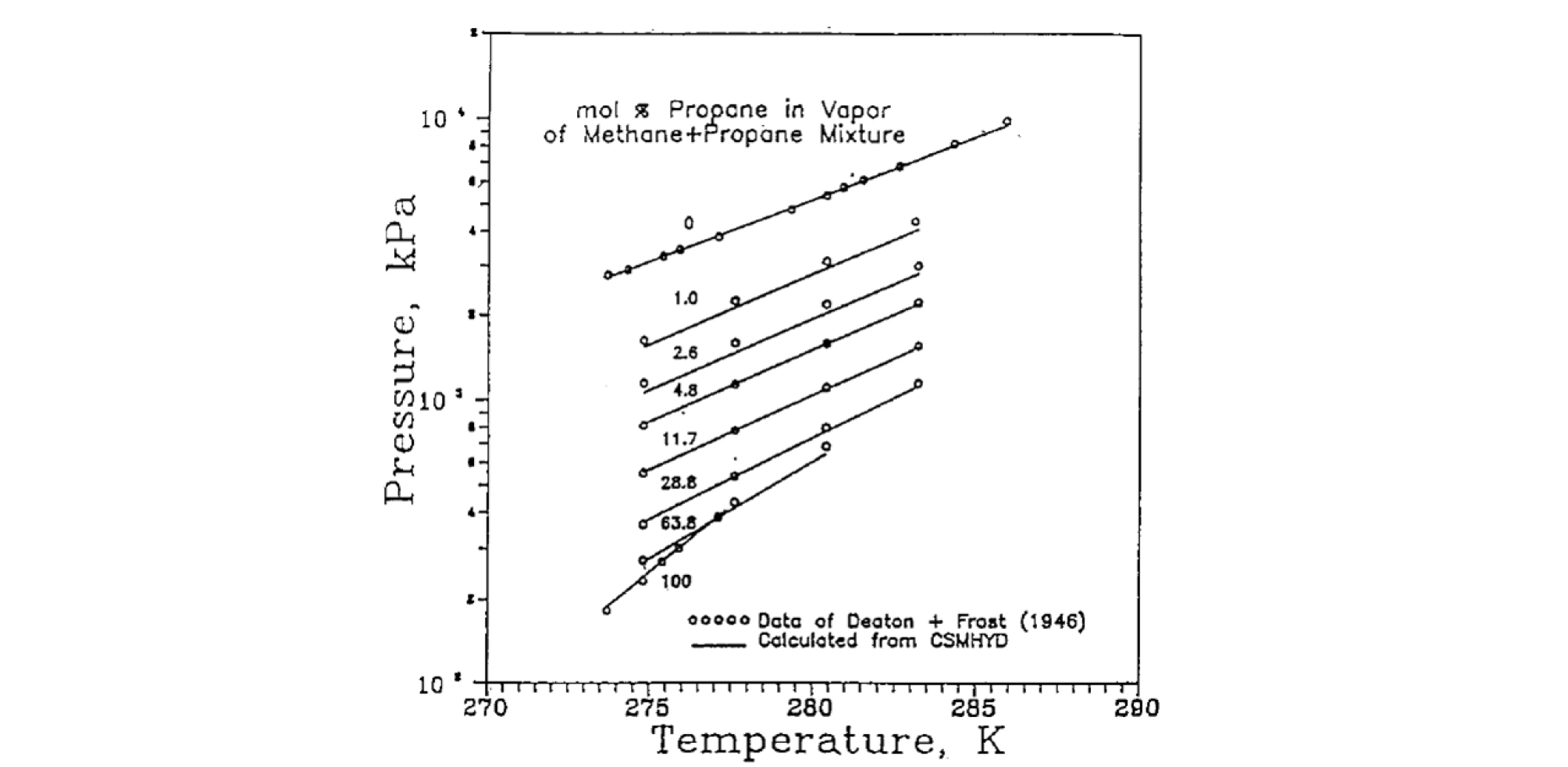
Fig. 2는 메탄과 프로판으로 혼합된 가스 조성에서의 가스 하이드레이트 상평형 곡선을 보여주고 있다. 가스 하이드레이트는 낮은 온도 및 높은 압력의 조건에서 구조를 유지하는 만큼, Fig. 2의 상평형선 위에서는 액상(Liquid Phase)의 물, 기체상(Vapor Phase)의 가스, 고상(Solid Phase)의 하이드레이트 등 다양한 상(Phase)이 공존하게 되는 상태를 유지한다. 상평형선을 기준으로 높은 온도 및 낮은 압력의 영역에서는 가스 하이드레이트는 모두 해리(Dissociation)되며, 이러한 가스 하이드레이트의 상평형 정보는 하이드레이트를 구성하는 가스의 성분, 가스의 조성, 퇴적층 내 함유된 하이드레이트로 인한 모세관 압력의 영향, 해수 염분에 의한 전해질 농도 등 다양한 변수에 의존하게 된다. 이에 따라 하이드레이트 상평형 정보를 모든 변수 조건에 따라 실험적으로 확인하는 것은 불가능에 가까우며, 열역학적 모델을 활용하여 하이드레이트 상평형선을 예측하고자 하는 시도가 활발하게 진행 중이다(Sloan, 1998). 특히 하이드레이트 상평형 정보는 자연계에 매장되어있는 천연가스 하이드레이트의 부존 특성을 이해하는 데 필수적으로 사용될 뿐만 아니라 가스 하이드레이트 생산을 위한 기술개발에도 핵심 역할을 하고 있다.
천연가스 하이드레이트 개발은 대부분 하이드레이트의 해리를 기반으로 천연가스 회수를 목표로 하고 있다. 가스 하이드레이트의 해리 반응은 화학적으로 흡열반응(Endothermic Reaction)이기 때문에, 하이드레이트 해리 시 필요한 에너지의 양(엔탈피, Enthalpy)을 계산하는 것 또한 중요하다(Sloan, 2003). 하이드레이트 해리 엔탈피를 측정하고자 하는 많은 실험적, 계산적 연구가 수행되고 있으며, 그중에서 하이드레이트 상평형 정보를 기반으로 Clausius-Clapeyron 식을 통하여 계산하는 과정이 시도되고 있다. 다음의 식 (1)은 Clapeyron 식에서 시스템 내부에서 하이드레이트와 용액의 몰 부피가 거의 일정하게 유지되며, 가스의 몰 부피를 부피 변화로 간주한다는 가정과, 온도 및 압력 조건의 변화에 따라 하이드레이트 상평형선의 기울기가 변하지 않는다는 가정을 활용하여 정리한 Clausius-Clapeyron 식이다(Handa, 1986; Sloan, 1998).
| $$\frac{d\mathrm{In}(P)}{d\left({\displaystyle\frac1T}\right)}=-\frac{\triangle H}{z\cdot R}$$ | (1) |
여기서 P는 압력, T는 온도, R은 기체상수,, z는 특정 온도와 압력 조건에서의 압축계수(Compressibility Factor)를 의미하며, 다양한 상태방정식을 통해 계산이 가능하다. 이때 식을 활용하여 계산된 하이드레이트의 해리 엔탈피(ΔH)는 하이드레이트 상평형 정보와 마찬가지로 다양한 변수에 의해 변하지만, 하이드레이트 해리에 필요한 에너지의 양을 예측할 수 있는 정보를 제공해준다.
퇴적층 내 하이드레이트의 물리적 특성
퇴적층 내 매장되어있는 천연가스 하이드레이트의 물성은 퇴적층의 특성에 의존하는 성격을 지닌다. 이는 일반적으로 다공성 매질 내에서 공극을 일부 채우고 있는 하이드레이트의 부존 특성으로 비롯된 것으로, 매장지의 특성과 하이드레이트 특성에 따라 30∼40% 정도의 공극 내에 낮게는 10% 미만, 높게는 80∼100% 수준의 하이드레이트 포화도(Hydrate Saturation, Sh)를 나타내기도 한다(Waite et al., 2009). 열전도도(Thermal Conductivity), 비열(Specific Heat), 열확산도(Thermal Diffusivity)는 대표적인 열적 물성으로, 퇴적층 내 하이드레이트의 열적 물성은 역시 하이드레이트 포화도와 공극률에 크게 의존하게 된다(Maxwell, 1954; Woodside and Messmer, 1961; Krupiczka, 1967; Revil, 2000; Waite et al., 2009).
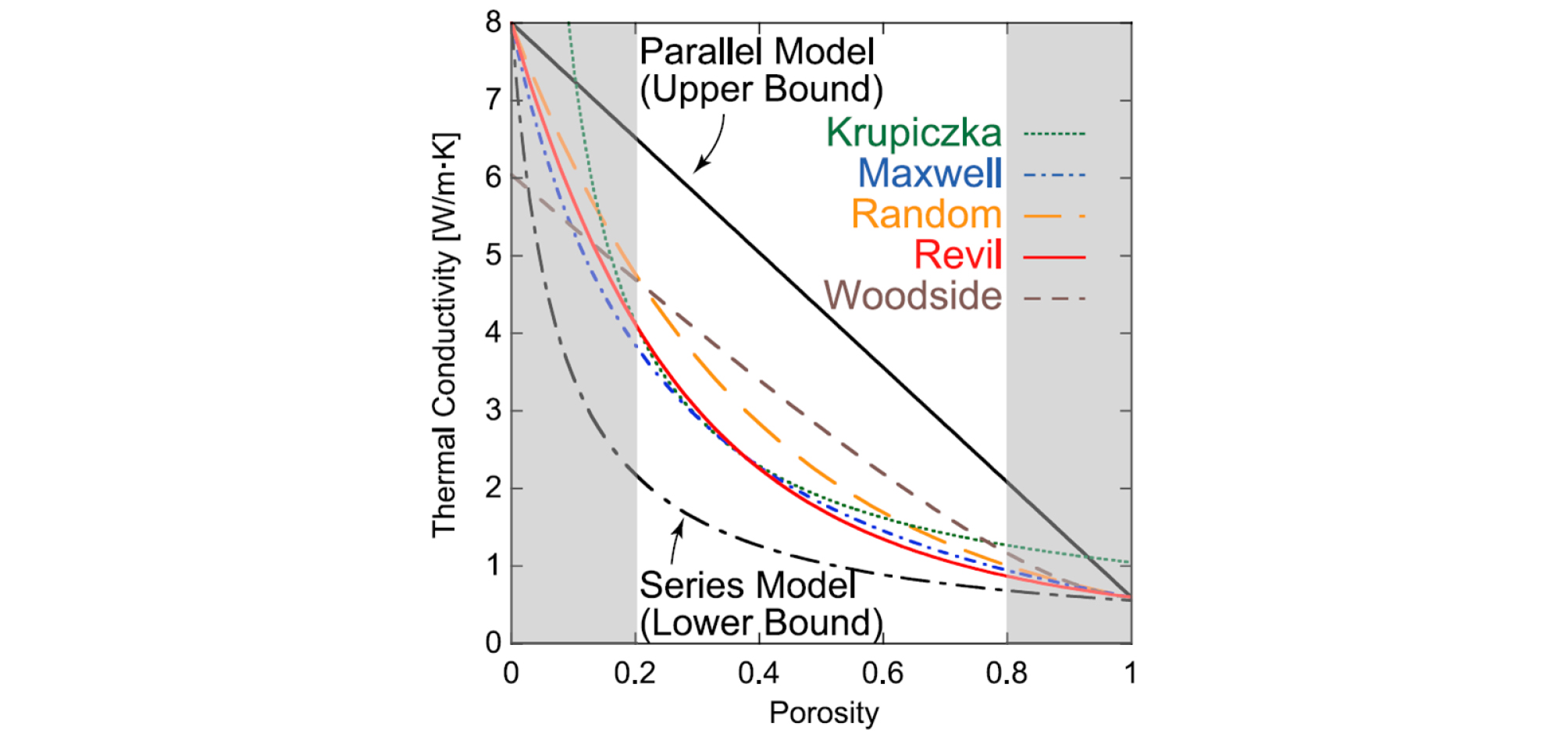
일반적으로 가스 하이드레이트와 물의 열전도도 차이는 10% 이내로 나기 때문에, 공극 내 하이드레이트 포화도를 고려하기보다는 물이 공극을 모두 차지하고 있다고 가정해도 무방하다고 알려져 있다(Maxwell, 1954; Woodside and Messmer, 1961; Krupiczka, 1967; Revil, 2000; Waite et al., 2009). 하지만 하이드레이트 매장지 내 공극률 변화는 열전도도 값에 큰 영향을 미치며, 특히 공극률이 같다고 하더라도 공극의 형태와 공극의 크기가 변화할 경우 계면에서의 열전달 모델 수립에 큰 영향을 주게 된다(Fig. 3). 더불어 하이드레이트 생성에 필요한 가스가 시스템에 추가될 경우, 다양한 계면에서의 열전달 요소를 고려한 열전도도 해석 모델 수립이 추가적으로 필요하다.
비열은 하이드레이트가 포함된 퇴적층의 온도 변화에 대한 열의 흡수 또는 방출량을 의미하고 있다. 열전도도에서는 공극의 크기와 분포, 계면의 효과가 큰 영향을 주는 것과는 다르게, 비열은 퇴적층 내 하이드레이트, 퇴적층, 물의 질량 분율이 가장 큰 변수로 작용하게 된다(Masui et al., 2005; Yun et al., 2007; Waite et al., 2009). 이에 따라 일반적으로 퇴적층의 비열 예측에 대한 모델 수립은 퇴적층 내 성분의 질량 분율과 함께 하이드레이트 포화도, 공극률을 사용한 간단한 계산으로 정리되는 경우가 대부분이다. 하지만, 가스 하이드레이트의 비열은 일반적으로 물의 비열의 절반에 미치지 못하기에 하이드레이트 포화도에 대한 실제 천연가스 하이드레이트 매장 정보의 적용이 필수라 할 수 있다. 특히 상업적으로 생산을 고려해볼 만한 수준인 캐나다 Mallik 지역의 경우 하이드레이트 포화도가 80%에 이르는 것으로 알려졌지만, 낮을 경우는 10% 미만의 하이드레이트 포화도를 보이는 천연가스 하이드레이트 매장지도 있는 만큼 비열에 관한 정보의 확보와 이해는 하이드레이트 개발을 위해 반드시 필요하다. 열확산도는 열전도도와 하이드레이트가 포함된 퇴적층의 밀도, 비열의 곱 사이의 비율로, 외부의 열 자극에 민감하게 온도가 변하는지를 나타내는 지표를 의미하고 있다(Masui et al., 2005; Yun et al., 2007; Waite et al., 2009). 또한 일반적으로, 가스 하이드레이트는 물보다 두 배 이상의 열확산도를 가지고 있어 하이드레이트를 포함하고 있는 퇴적층의 열확산도는 그렇지 않은 퇴적층에 비해 더 온도 변화에 민감하다(Table 3). 이와 더불어, 하이드레이트가 포함된 퇴적층의 유체투과율(Fluid Permeability)은 하이드레이트 생산 공정에서 유체의 흐름을 조절하는 가장 핵심적인 변수로 여겨진다(Waite et al., 2009). 유체의 투과도에 따라 열과 물질의 전달은 중요한 변수로 작용하게 되며, 이에 따라 하이드레이트의 형성, 분포 등에도 영향을 미치는 것으로 알려져 있다. 일반적인 경우 퇴적층 내에서 단상(Single-phase) 또는 다상(Multi-phase)의 유체 흐름에 대한 모델을 수립하는 경우가 많으며, 퇴적층은 균일한 다공성 매질로 구성되어 있다고 가정하는 경우가 대다수다(Waite et al., 2009). 퇴적층 내에 하이드레이트를 추가함으로써 유체투과율의 예측 및 거동 분석은 시스템의 복잡함을 야기하며, 이는 하이드레이트의 존재가 유체의 흐름을 변동시키거나, 퇴적층의 공극률이나 공극의 모양을 바꾸기 때문이라 할 수 있다(Liu and Flemings, 2007). 이에 따라 하이드레이트가 포함된 퇴적층의 유체투과율에 대한 모델의 연구는 매우 어렵기도 하지만, 안정적인 하이드레이트 생산을 예측하기 위한 필수적인 과제라 할 수 있다(Kleinber et al., 2003; Lee, 2008).
Table 3. Thermal properties of hydrate and hydrate-bearing sediments (Waite et al., 2009)
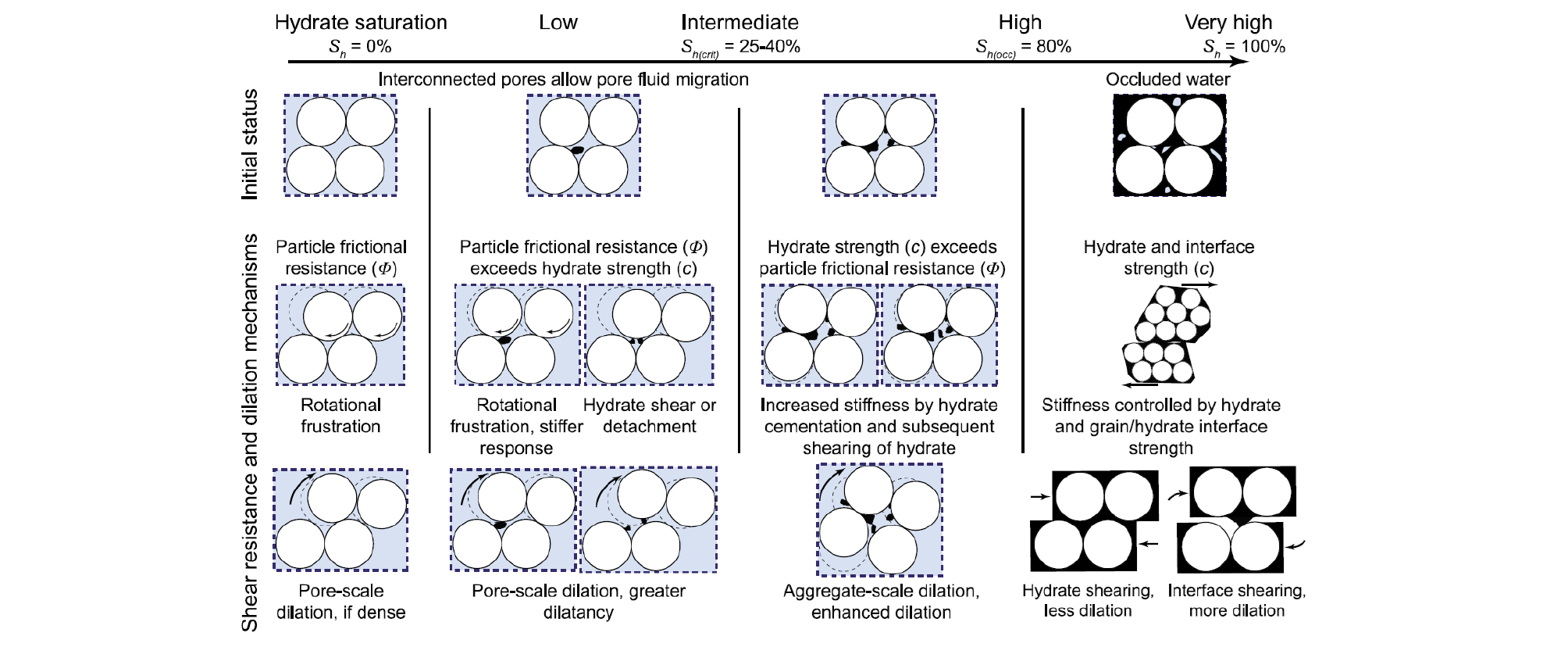
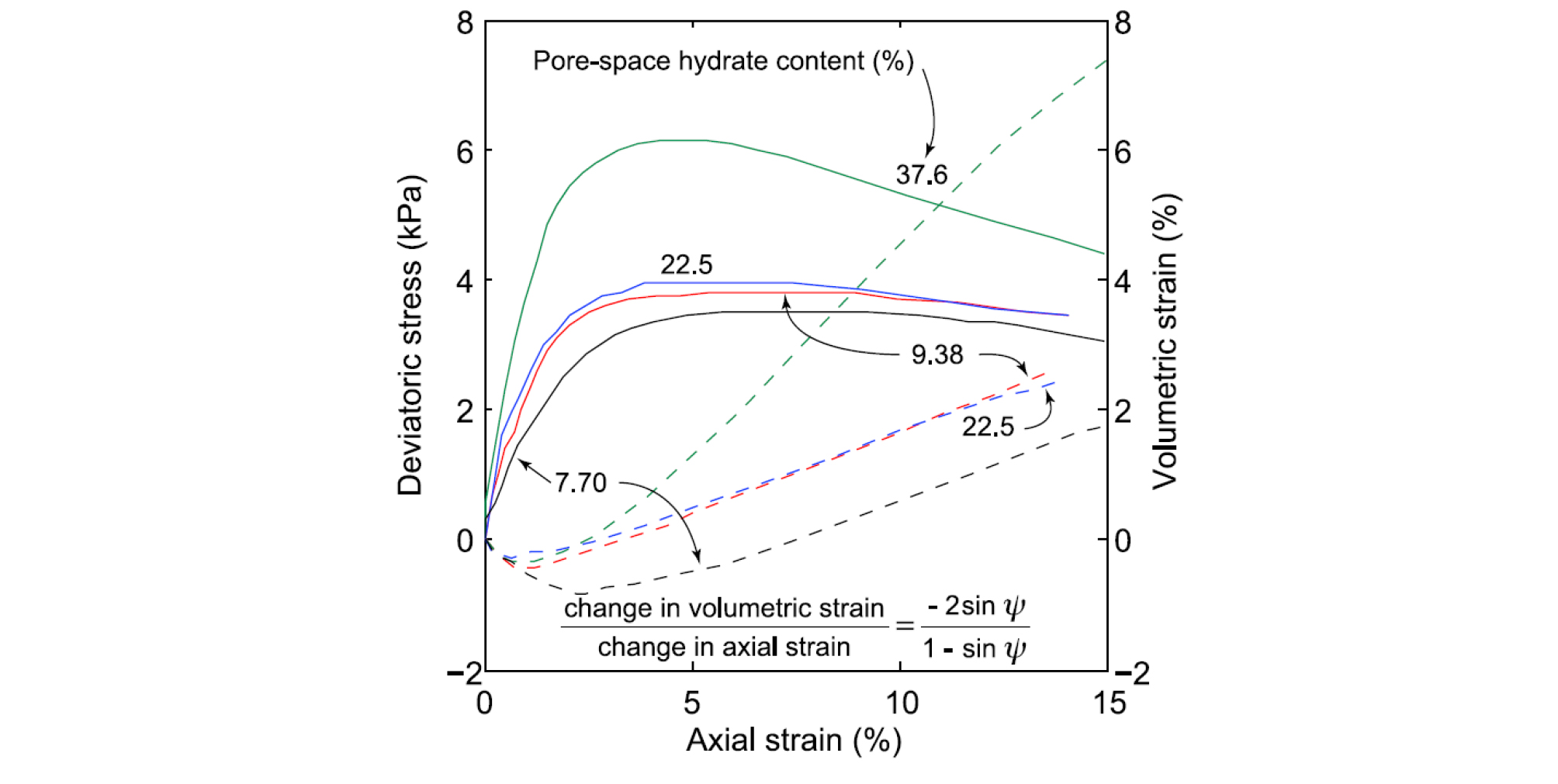
하이드레이트가 매장된 퇴적층의 강도(Strength)와 변형(Deformation)은 하이드레이트 생산을 고려할 시 퇴적층의 안정성(Stability)과 직결되는 중요한 변수인 만큼, 이에 대한 상세한 연구가 진행 중이다. 하이드레이트가 매장된 퇴적층의 전단응력(Shear Stress)에 대한 변형은 공극 내 하이드레이트 포화도에 크게 의존하는 것으로 판단되며, 응력-변형률 곡선 또한 하이드레이트 포화도에 의존하는 성격을 보여주고 있다(Figs. 4, 5). Fig. 4는 하이드레이트 포화도에 따라 변화하는 전단응력에 의한 전단저항과 팽창의 원리를 설명해주고 있다(Yun et al., 2007; Waite et al., 2009). 공극 내에 하이드레이트가 존재하지 않을 경우, 전단응력은 퇴적층 내 입자의 회전, 미끄러짐, 재배열 등을 야기한다(Fig. 4). 낮은 하이드레이트 포화도(Sh< 40%)를 보이고 있을 경우 공극 내에 존재하는 하이드레이트는 때때로 전단응력에 의한 회전과 변형을 방해하기도 하며, 하이드레이트 입자의 결합력과 포화도는 변형과 팽창 현상에 의존하기도 한다(Fig. 4). 공극 내 하이드레이트 포화도의 변화는 강도(Strength)에 영향을 주게 되며, Fig. 5는 공극 내 포함되어 있는 하이드레이트의 양에 증가에 따라 증가하는 하이드레이트의 강도를 보여주고 있다(Masui et al.., 2005). 이에 따라, 전반적으로 하이드레이트가 매장된 퇴적층의 기계적 거동은 하이드레이트 포화도가 증가됨에 따라, 강성(Stiffness)과 강도(Strength) 모두 증가되는 경향을 보이고 있다(Masui et al.., 2005; Yun et al.., 2007; Waite et al.., 2009).
천연가스 하이드레이트가 부존되어 있음을 간접적으로 확인할 수 있는 수단으로는 비저항측정(Electrical Resistivity Profiling), 탄성파 탐사(Seismic Survey), 자력탐사(Magnetic Measurement) 등이 있다. 이 중에서도, 탄성파 탐사를 통해 해저면 모방 반사면(Bottom Simulating Reflector, BSR)의 확인은 가장 널리 사용되는 하이드레이트 부존 확인 방법이라고 할 수 있다. BSR은 하이드레이트가 매장된 퇴적층과 물 또는 가스로 포화된 퇴적층 사이에의 경계에서 탄성파 속도와 밀도 차이에 의해 표현된 반사면으로, 경계면을 기준으로 탄성파의 속도가 크게 변화하게 된다. 이에 따라 가스 하이드레이트의 상평형 조건이 맞아 떨어지면서, BSR의 존재를 확인하게 된다면 하이드레이트의 부존 가능성은 상당히 올라간다고 말할 수 있다. 간접적인 증거 확보 후에는 시추를 통하여 확실하게 하이드레이트의 존재를 검증하게 되며, 이때 전기비저항 측정을 통하여 하이드레이트가 포함된 퇴적층의 특성을 분석하기도 한다. 일반적으로 하이드레이트는 물(해수)에 비해 높은 전기비저항 값을 가지고 있기 때문에, 하이드레이트가 포함된 퇴적층의 전기비저항 값은 그렇지 않은 퇴적층에 비해 높은 전기비저항을 나타내게 된다.
퇴적층 내 하이드레이트의 지구 화학적 특성 및 지표
퇴적층 내 하이드레이트의 물리적 특성 정보를 기반으로 하이드레이트의 부존 가능성을 간접적으로 확인하게 된다면, 좀 더 많은 정보를 얻기 위하여 하이드레이트의 지구화학적 특성을 활용하기도 한다. 이러한 지구화학적탐사 기법에는 퇴적층과 물(해수)을 채취하여 분석하는 방법이 대표적이며, 이는 해저면 인근 해수에 녹아있는 가스를 분석하거나 퇴적층과 공극에 포함된 유기물과 가스의 분석, 퇴적층 내 물의 염소이온 농도 또는 산소동위원소 분석 등이 포함된다.
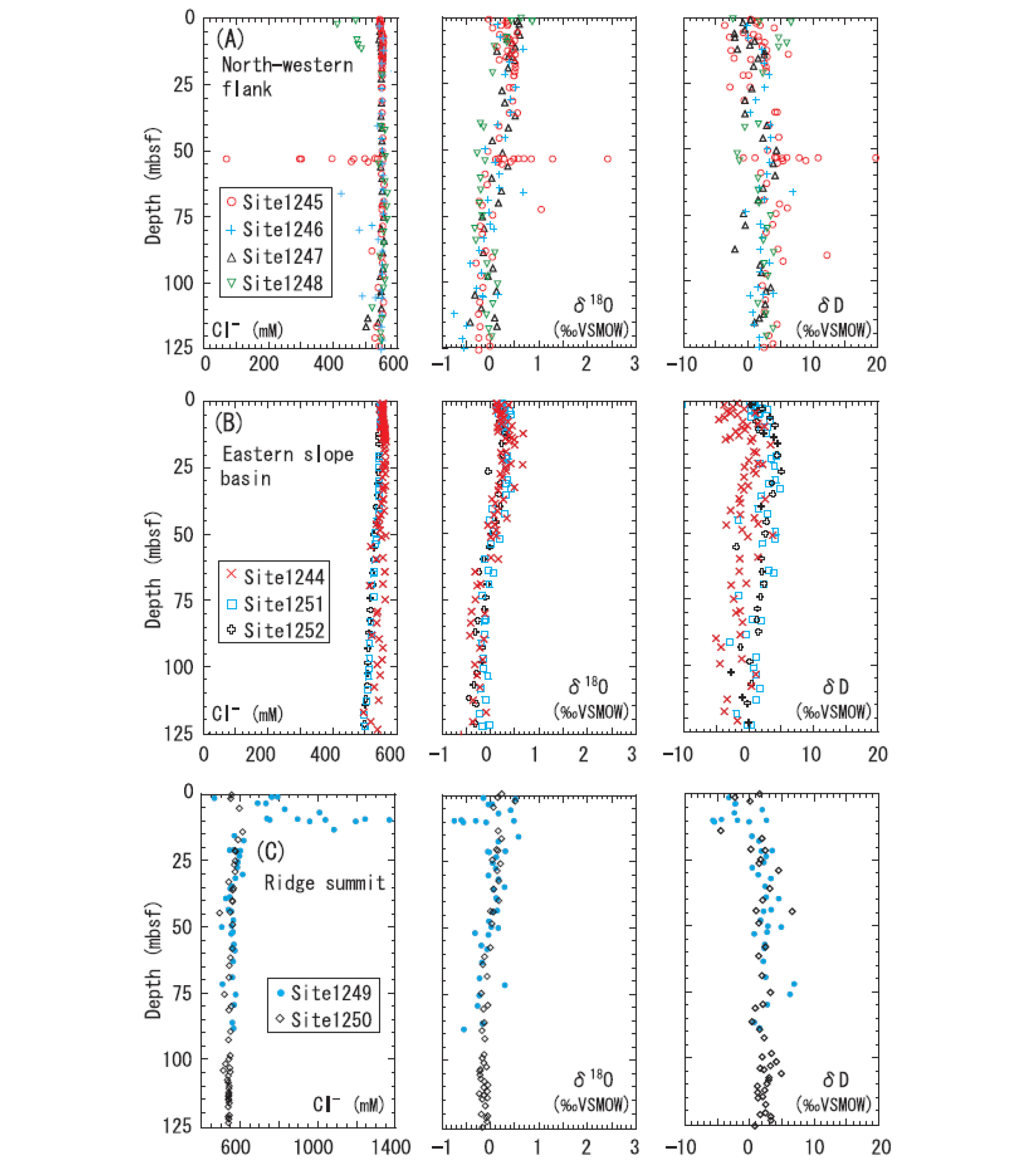
퇴적층 내 염소이온의 농도는 하이드레이트가 포함된 퇴적층의 특징을 보여주는 귀중한 지구화학적 지표라 할 수 있다. 해저 퇴적물 사이의 공극에 포함되어있는 물은 염소이온을 포함하고 있다. 퇴적층 내에서 천연가스 하이드레이트가 생성(Formation)될 때 염분은 하이드레이트 생성 반응에서 배제되기 때문에, 일반적으로 해수의 염분 농도는 국부적으로 증가하는 형태를 보인다. 하지만 자연계에서의 염소이온 농도 변화에 대한 변화는 굉장히 복잡하게 발생하며, 퇴적층 내 하이드레이트 부존 지역의 염소이온은 때때로 비정상적으로 낮거나 높게 관찰된다. DSDP(Deep Sea Drilling Project) Legs 66, 67, 76, 84의 사이트, ODP (Ocean Drilling Program) Legs 122, 146, 164의 사이트와 같은 곳에서는 하이드레이트 발견과 함께 낮은 염소이온 농도가 관찰됨에 따라서, 초기에는 퇴적층 내 하이드레이트의 낮은 염소이온 농도의 특성은 하이드레이트 부존을 의미하는 간접적인 방법으로 여겨지고는 했다(Seol and Lee, 2013). 이러한 염소이온의 감소 현상은 하이드레이트 샘플의 시추 및 회수 과정에서 일부의 하이드레이트가 해리되면서 해수의 염분 농도 감소로 나타난 것이라 여겨지고 있다. 하지만 Oregon 지역의 천연가스 하이드레이트, 울릉분지 천연가스 하이드레이트의 경우에는 이와는 반대로, 공극 사이의 해수 내 염분 농도가 비정상적으로 높은 것을 확인할 수 있었다. 이러한 반대 현상 발견 덕분에 퇴적층 내 하이드레이트 생성을 통한 염소이온 농도에 대한 모델 확립과 계산에 대한 연구가 활발하게 진행되었으며, 몇몇의 결과를 통해 국부적으로 하이드레이트 매장 퇴적층 내 염소이온 농도의 증가현상은 자유가스(Free Gas)로부터 생성된 하이드레이트에 대해서 지배적으로 발생함을 확인하였다.
동위원소 분석 역시, 간접적인 퇴적층 내 하이드레이트의 부존을 알려주는 지구 화학적 지표이다(Fig. 6). 일반적으로 가스 하이드레이트는 중수동위원소(Heavy Water Isotope)가 우선적으로 풍부한 것으로 알려져 있기 때문에, 산소(δ18O)와 중수소(δD) 동위원소의 농도의 값은 하이드레이트 매장을 설명해주는 지구화학적 지표뿐만 아니라, 하이드레이트 내 천연가스의 양을 간접적으로 알 수 있는 정보를 제공해주기도 한다(Tomaru et al.., 2006). Fig. 6은 ODP Leg 204 지역 해저면으로부터 125 m 깊이 지점까지 채취된 시료(Sample)의 공극수(Pore Water)에 포함된 염소이온, 산소(δ18O)와 중수소(δD) 동위원소의 농도를 보여주고 있다(Tomaru et al.., 2006). Fig. 6a의 1245 Site 분석 결과는 염소이온 농도의 변화(약 50 mbsf 지역)를 극명하게 보여주고 있으며, 같은 구역에서 산소(δ18O)와 중수소(δD) 동위원소의 농도 또한 변화된 것을 확인할 수 있다(Tomaru et al.., 2006).
하이드레이트 생성 기원(Origin) 및 분포, 생산기술
생물기원(Biogenic)과 열기원(Thermogenic) 하이드레이트
퇴적층 내 가스 하이드레이트의 구성 성분은 대부분 천연가스가 포함된다. 또한, 이러한 퇴적층 내 부존하게 되는 천연가스 성분의 대부분은 가장 단순한 탄화수소(Hydro Carbon) 물질에 해당하는 메탄이다. 천연가스의 생성 기원은 마그마 또는 열수작용에 의해 생성되기도 하지만, 대부분은 미생물에 의한 혐기성분해 또는 유기물 등 케로젠의 열분해 과정에 의해 생성된다. 이 과정에서 생성된 천연가스가 낮은 온도와 높은 압력의 조건에서 물 분자와 만나게 되어 생성되는 것이 천연가스 하이드레이트이며, 이에 따라 천연가스 하이드레이트의 생성 기원(Origin)은 생물기원(Biogenic)과 열기원(Thermogenic)으로 크게 구분하고 있다(Sloan and Koh, 2008).
생물기원 하이드레이트의 경우, 퇴적층 내 포함되어 있는 유기물을 활용한 미생물의 혐기성 메탄생성반응(Methanogenesis Process)에 의해 만들어지게 된다. 미생물의 혐기성 분해 반응을 통해 생성된 가스는 대부분 메탄(약 99% 이상)에 해당하며, 이를 통해 만들어지게 되는 가스 하이드레이트 구조는 대부분 구조 I의 형태를 지니고 있다. 퇴적층 내에서 생성된 메탄가스는 일반적으로 그 자리에서 바로 하이드레이트 형성으로 이어지는 경우가 많으며, 때때로 매우 느린 속도로 퇴적층 내에서 전달(Migration)되어 하이드레이트 형성되는 경우도 존재한다. 이에 따라 생물기원 하이드레이트는 퇴적층 내에서 광범위하게 분포되어 있는 경우가 대부분이며, 전 세계에서 발견되는 대부분의 하이드레이트는 생물기원에 의한 하이드레이트라고 알려져 있다. 퇴적층 내 미생물에 의한 황산염-메탄 환원 경계(Sulfate-Methane Reduction Interface, SMI)에서 메탄이 소모되는 경우도 존재하는 만큼, SMI를 생물기원 하이드레이트가 부존할 수 있는 최상단경계면으로 여기는 경우도 있다(Sloan and Koh, 2008).
이에 반해 열기원 하이드레이트는 높은 온도와 높은 압력 조건에서 퇴적층에 매립된 유기물의 열분해 작용을 통해 생성된 메탄, 에탄, 프로판, 부탄 등의 다양한 탄화수소를 포함하는 천연가스에 의해 만들어진 가스 하이드레이트를 일컫는다. 하지만 열기원에 의한 천연가스 생성은 높은 온도의 조건에서 보통 발생하기 때문에, 하이드레이트 생성을 위한 열역학적 조건을 만족하지 못하여 충분히 퇴적층 내에서 전달되어 상부까지 이동해야 한다. 이에 따라 단층(Fault) 지역을 따라 빠르게 퇴적층 상부까지 전달된 천연가스가 하이드레이트가 생성되기에 충분한 낮은 온도와 높은 압력의 조건에 도달하게 되었을 때, 하이드레이트 생성이 풍부하게 이루어지며 국부적으로 부존하는 성격을 보이고 있다. 그 결과 거대한 하이드레이트 덩어리(Massive Gas Hydrate)의 형태를 일반적으로 보이는 경우가 많으며, 열기원에 의해 분해된 천연가스로부터 생성되는 특징 때문에 멕시코만, 카스피해, 캐나다 서부 해안 등의 특정한 곳에서 발견되고 있다. 또한, 천연가스의 구성 성분이 메탄과 그 이상의 탄화수소를 포함하고 있어 구조 I, 구조 II, 구조 H가 모두 발견될 수 있는 것으로 알려져 있다. 알래스카 지역의 북부 사면에서 발견된 하이드레이트 같은 경우는 열기원과 생물기원 하이드레이트가 공존하고 있음이 확인되었다(Sloan and Koh, 2008).
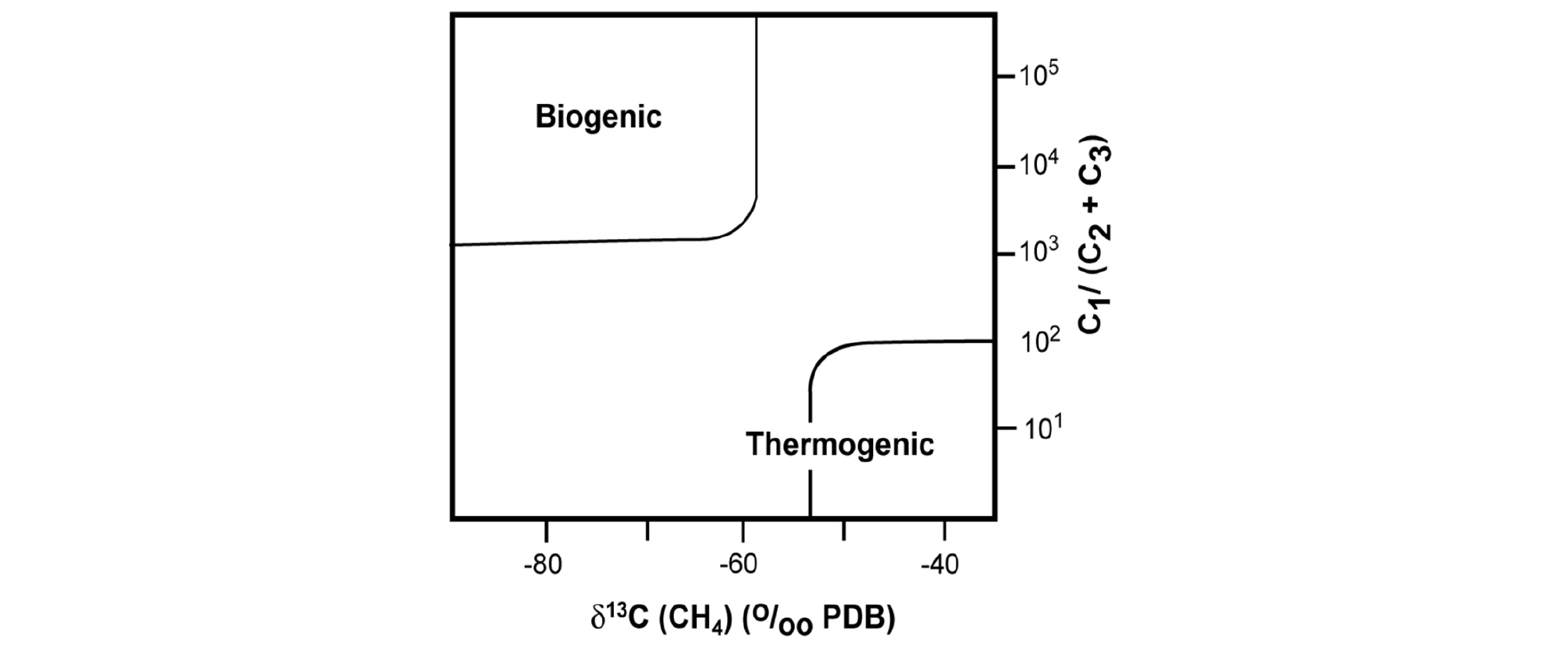
하이드레이트의 생성 기원은 탄소동위원소비율(δ13C)을 확인하거나, 탄화수소 가스 비(Hydro Carbon Ratio, R = C1 / [C2+C3])를 통해 구분할 수 있다(Fig. 7). 생물기원 하이드레이트는 보통 99% 이상 메탄으로 구성되어, 탄화수소 가스 비는 100보다 큰 값을 가지는 경우가 대부분이다. 이에 반해 열기원 하이드레이트의 경우, 탄화수소 가스 비의 값이 상당히 작은 경향을 보인다. 탄소동위원소비율(δ13C)은 Pee Dee Belemnite(PDB)를 기준(Standard)으로 시료(Sample)의 13C와 12C 비율을 천분율(Part Per Thousand, PPT)로 측정하는 값을 말하며, 식 (2)와 같이 계산가능하다(Sloan and Koh, 2008).
| $$\delta^{13}C=\left(\frac{{\left({\displaystyle\frac{{}^{13}C}{{}^{12}C}}\right)}_{sample}}{{\left({\displaystyle\frac{{}^{13}C}{{}^{12}C}}\right)}_{sample}}-1\right)\times1000\%_0$$ | (2) |
미생물에 의한 혐기성 분해 과정을 통한 메탄생성 과정은 상대적으로 가벼운 탄소동위원소비율(δ13C)을 가지며, -90 ∼ -60‰정도의 값을 나타내고 있다. 반면에 열기원 하이드레이트의 경우 다소 무거운 탄소동위원소비율(δ13C)을 가지며, -60 ∼ -30‰정도의 값을 보이고 있다. 탄소동위원소비율과 탄화수소 가스 비를 같은 그래프 상에서 표현하게 될 경우, Fig. 7과 같은 형태의 하이드레이트 분포도를 나타내게 되며, 2007년 발견된 우리나라 울릉분지 지역의 동해 천연가스 하이드레이트의 경우는 99% 이상의 가스가 메탄으로 구성된 생물기원 하이드레이트임이 밝혀진바 있다(Claypool and Kvenvolden, 1983; Sloan and Koh, 2008; Ryu et al.., 2013).
하이드레이트 분포와 매장량
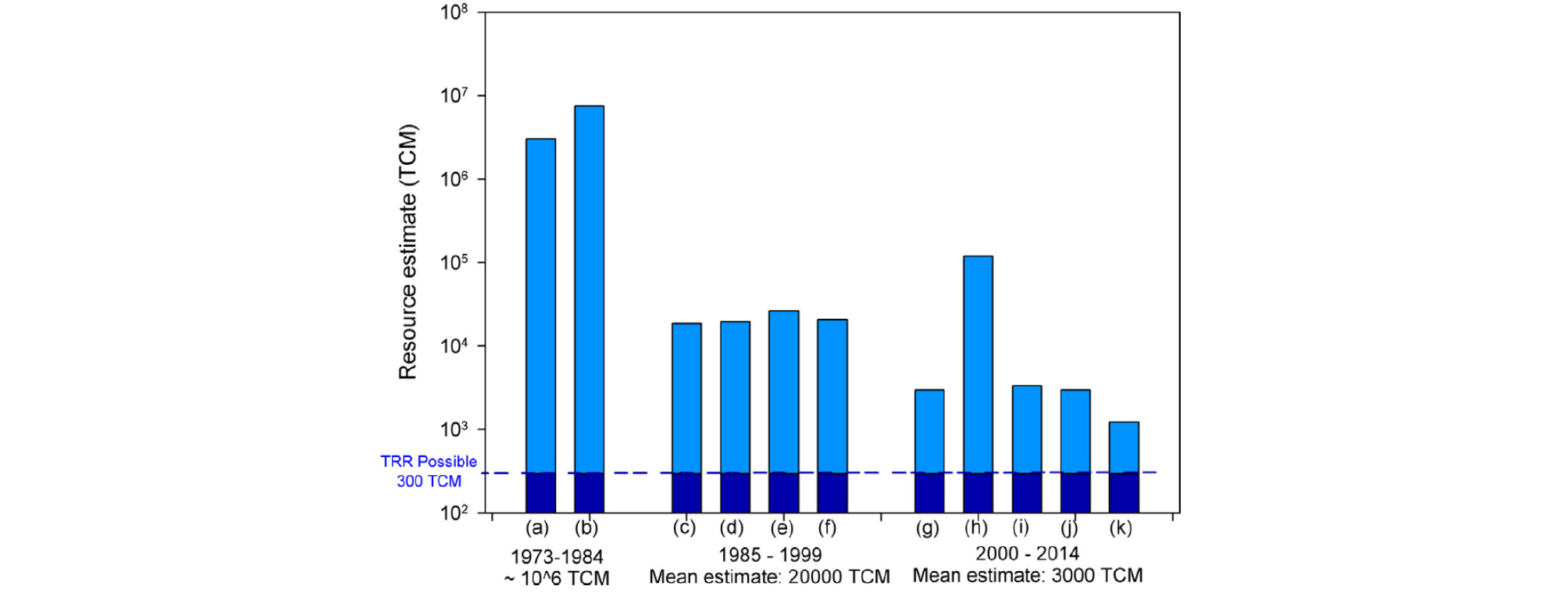
석유 개발 과정에서의 문제점으로 인식되어오던 가스 하이드레이트의 자연계 존재 발표가 Makogon(1965)에 의해 이루어진 뒤, 하이드레이트에 대한 연구는 전환점을 맞이하기에 이르게 된다. 미래 에너지 자원으로서의 가스 하이드레이트에 대한 인식이 대두되면서, 1970년대 후반부터 본격적으로 심해시추 프로그램(Deep Sea Drilling Project, DSDP)이 진행되었으며, 전 세계 해저의 상당한 부분에서 천연가스 하이드레이트가 광범위하게 부존되어 있다고 확인되었다(Collett and Ginsburg, 1998; Klauda and Sandler, 2005). 이러한 자연계 하이드레이트 발견 이후 천연가스 하이드레이트 내부에 포함되는 에너지원의 양에 대한 관심이 증대되어 이에 관한 활발한 연구가 수행되었다(Fig. 8). 1975년, Trofimuk et al..(1975)은 하이드레이트가 존재할 수 있는 낮은 온도와 높은 압력의 조건이 만족될 경우 하이드레이트가 존재한다고 가정하여, 표준온도 및 압력(Standard Temperature and Pressure, STP) 상태에서의 하이드레이트 내 메탄양을 산출하였으며 그 양은 3053 ✕ 1015 m3에 이른다. 2002년, Soloviev(2002)는 메탄의 유무, 공극의 제한조건, 유기물 함량 등의 여러 가지 요소들을 고려하여 최소치의 하이드레이트 내 메탄양을 유추하기에 이르렀으며 그 양은 0.2 ✕ 1015 m3를 나타낸다. 1970년대부터 지속적으로 하이드레이트 내 메탄가스의 매장량을 예측하고 있으며, 그 예측 결과는 꾸준히 감소하고 있다(Fig. 9). 그 결과 1990년 대에는 평균적으로 하이드레이트 내 메탄가스의 양은 20,000 TCM(Trillion Cubic Meters) 정도로, 2010년 대에는 3,000 TCM으로 감소된 예측 결과를 보여주고 있다. 하지만, 이 양은 기존의 천연가스 매장양(약 400 TCM)과 셰일가스(약 450 TCM)에 비하면, 여전히 많은 양으로 예측되며 미래 에너지원으로의 하이드레이트 생산 기법 개발, 시험 생산에 대한 관심을 불러일으키고 있다(Trofimuk et al.., 1975; Kvenvolden, 1988; Macdonald, 1990a; Kvenvolden, 1999; Soloviev, 2002; Milkov, 2004; Klauda and Sandler, 2005; Boswell and Collett, 2011).
하이드레이트 생산기술 및 현황
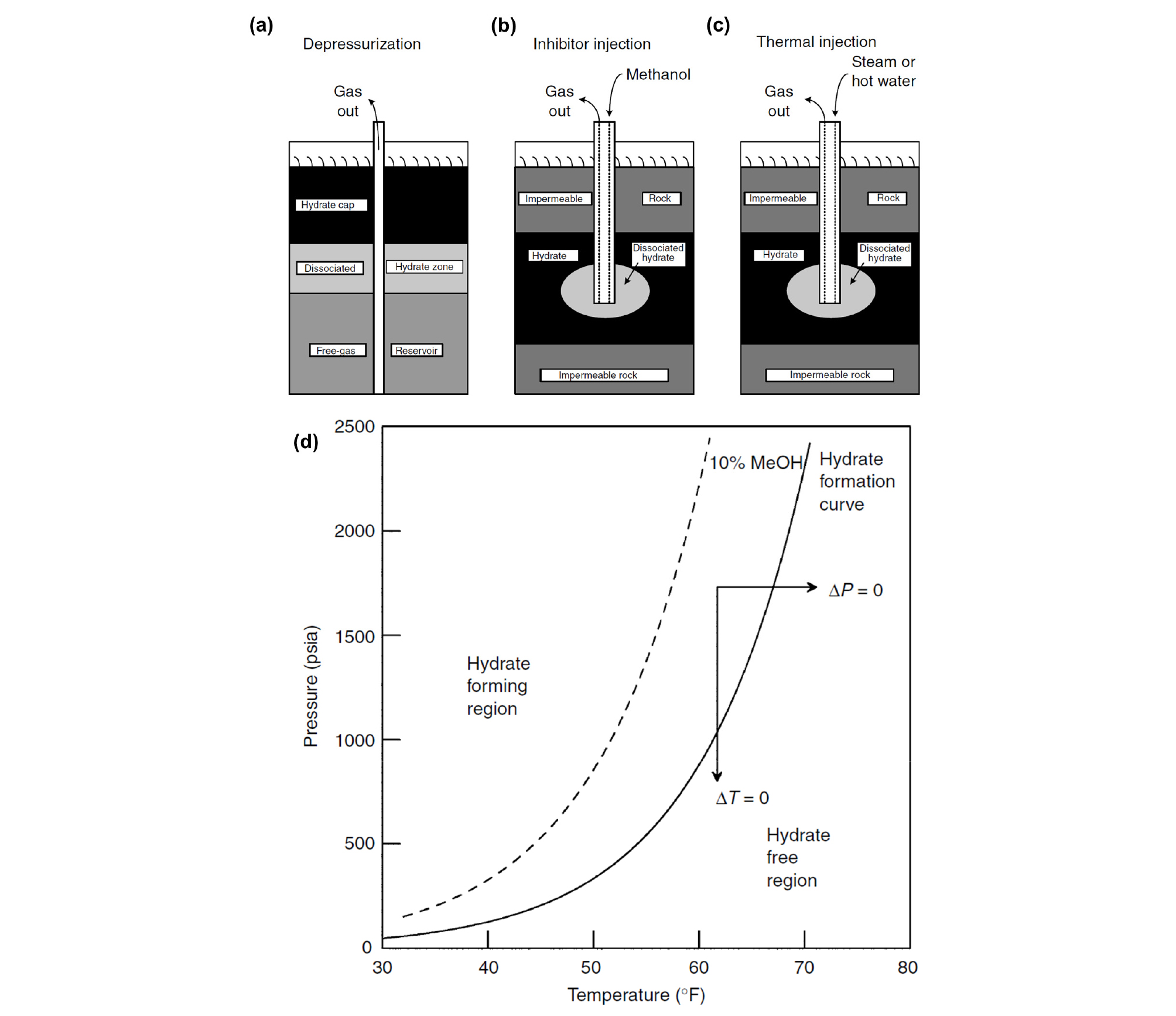
가스 하이드레이트 내부에 포집되어 있는 천연가스는 기본적으로 기존의 천연가스와는 매장된 형태가 다르다고 볼 수 있다. 가스 분자는 물 분자 사이의 수소 결합으로 구성된 동공 내에 반데르발스 상호작용에 안정되게 포집된 상태이며, 이를 에너지원으로 회수하기 위해서는 하이드레이트의 해리(Dissociation)을 필요로 하고 있다(Holder et al.., 1982; Handa, 1986; Makogon, 1997; Sloan and Koh, 2008). 이에 따라 하이드레이트의 해리를 위해서는 하이드레이트 매장지의 온도 및 압력 조건을 하이드레이트 상평형선도 외의 영역으로 이동시킬 필요가 있으며, 생산기술은 이 방법에 따라 크게 세 가지로 나뉘게 된다(Fig. 10).
열자극법(Thermal Stimulation)은 하이드레이트가 매장된 퇴적층의 온도 조건에 에너지를 가하여, 하이드레이트를 해리시키는 방법이다. 열자극법에는 열수주입법(Hot Water Injection) 또는 전기가열법(Electric Heating) 등이 있으며, 하이드레이트와 물, 퇴적층의 열에 관한 물리적 특성을 고려하여 자세한 매장지의 조건을 확인해야만 한다. 하이드레이트가 포함된 퇴적층의 비열, 열전도도, 열확산도와 같은 열에 관한 물리적 특성은 하이드레이트 포화도, 공극률 등에 의존하기 때문에, 매장지의 조건이 바뀌어 감에 따라 같은 열자극법을 생산기술로 활용해도 적절한 전략을 세우는 것이 필요하다. 또한, 하이드레이트의 해리 과정 중에는 물의 어는점보다 낮은 특정 온도 영역(약 250 ∼ 270 K)에서 하이드레이트 자기보존효과(Self-Preservation Effect)가 발생하게 된다. 이 경우 비정상적으로 하이드레이트 해리가 느려지게 되는 현상이 발생하게 되며, 이는 하이드레이트 해리 과정 중 발생한 흡열반응에 의해 과냉각수층이 재빙결되어 얼음막이 형성되어 하이드레이트의 추가적인 해리를 막아주는 효과를 일컫는다. 이러한 자기보존효과는 하이드레이트를 이용한 가스 수송 분야에서는 유용하게 사용될 수 있지만, 천연가스를 회수하기 위한 에너지원으로서의 천연가스 하이드레이트 분야에서는 잠재적인 걸림돌이 될 수 있는 현상인 만큼, 이에 대한 고려도 반드시 필요하다(Chong et al.., 2016).
감압법(Depressurization)은 하이드레이트가 매장된 퇴적층의 압력 조건을 하이드레이트 상평형선도 외의 영역까지 이동시키는 방법으로, 열자극법에 비하여 필요한 에너지의 관점에서 더 유리한 방법이라고 알려져 있다. 현재까지 육상과 해상에서의 천연가스 하이드레이트 시험 생산에서 모두 적용된 유일한 생산기법으로 알려져 있다. 열자극법과 마찬가지로 하이드레이트 해리 과정 중, 자기보존효과에 의한 비정상적인 하이드레이트 해리 현상을 발생시킬 수도 있는 만큼 압력의 감압속도나 목표 압력 등 공정변수에서의 다양한 모사실험과 연구가 필요할 것으로 여겨진다(Chong et al.., 2016; Gil et al.., 2017).
억제제 주입법(Inhibitor Injection)은 알코올(Alcohol)과 같은 하이드레이트 생성을 방해하는 화학물질을 투입시키는 법으로, 하이드레이트 상평형선도를 더 높은 압력과 낮은 온도의 영역으로 이동시켜주는 방법을 통한 하이드레이트 해리 현상의 응용이라 할 수 있다. 유송관에서 하이드레이트 생성으로 인한 흐름 방해를 막기 위해 투입되는 방법과 동일하지만, 아직 상업적으로 억제제 주입법을 통하여 천연가스 하이드레이트를 생산하는 방법에 대한 자세한 연구와 시험 도입에는 의문점이 따르고 있다. 이에 따라 억제제 주입법의 적용은 감압법 또는 열자극법과의 혼합 사용을 통한 동반상승효과(Synergy)의 기대를 목표로 한다(Chong et al.., 2016).
앞선 세 가지의 하이드레이트 생산기법은 모두 하이드레이트 해리를 전제로 이루어지는 만큼, 심해저 환경과 퇴적층의 변화가 야기될 수 있다는 단점을 가지고 있다. 이에 따라, 최근의 연구 결과로는 이산화탄소를 주입하여 하이드레이트를 생산하는 방법이 시도되고 있다(Chong et al.., 2016). 이산화탄소 하이드레이트가 가지고 있는 열역학적 상평형 조건의 안정성이 메탄 하이드레이트보다 안정적인 조건을 활용한 방법으로, 하이드레이트 구조는 그대로 유지하며 메탄과 이산화탄소의 맞교환 작용을 통해 이루어지게 되어 맞교환기법 또는 치환기법이라고 부르고 있다. 온실가스로 여겨지는 이산화탄소를 처리하며 동시에 에너지원을 회수하는 만큼 장점을 가지고 있는 것으로 판단되어 기술적인 가치가 뛰어나다 할 수 있지만, 이산화탄소 주입을 위한 시설, 이산화탄소 하이드레이트의 생성 속도 등 다양한 해결 과제를 아직 마주하고 있다(Holder et al.., 1982; Collett and Ginsburg, 1998; Svandal et al.., 2006; Kvamme et al.., 2012; Vafaei et al.., 2012; Daigle et al.. 2014; Oyama and Masutani, 2017; Wan et al., 2018).
앞서 언급한 네 가지의 하이드레이트 생산기법을 활용하여, Table 4와 같이 천연가스 하이드레이트의 시험생산(Field Trials)이 여러 차례 진행되어 왔다. 감압법의 경우 육상과 해상의 하이드레이트 생산에 모두 성공한 유일한 기법이며, 이산화탄소 주입을 통한 맞교환기법의 경우 알라스카 지역에서 그 가능성을 확인하였다. 현재까지는 미국, 캐나다, 일본 등이 하이드레이트 생산을 위한 기술개발에 몰두하고 있으며 시험생산 또한 앞서고 있는 시점에, 중국 또한 최근에 하이드레이트 생산을 위한 다양한 연구가 수행 중이다. 해외의 국가들은 2020 ∼ 2030년까지 상업적 생산을 목표로 계속 연구가 수행 중이며, 국내의 경우 동해 울릉분지의 천연가스 하이드레이트 개발을 목표로 지속적인 노력이 진행 중인 것으로 알려져 있다(Huh and Lee, 2017; Oyama and Masutani, 2017; Wan et al., 2018)).
Table 4. Summary of NGH field production test (Chong et al., 2016; Oyama and Masutani, 2017; Wan et al., 2018).
하이드레이트의 지구 환경적 영향
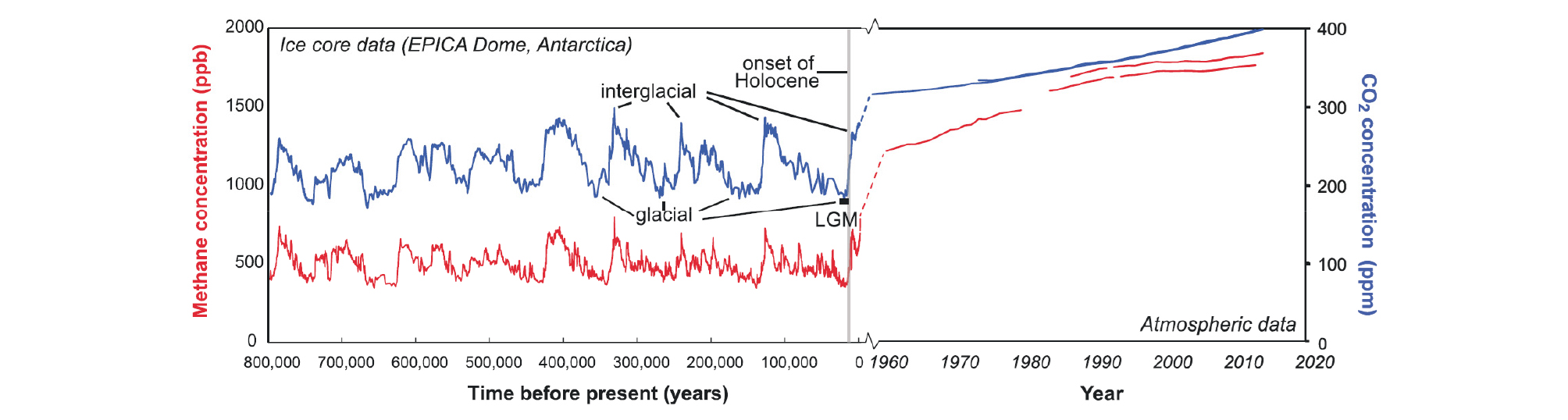
지구 온난화에 대한 논란은 학계에서도 여전히 지속적으로 이루어지고 있지만, 이에 기여하는 이산화탄소와 같은 온실가스 농도의 꾸준한 증가는 현실로 벌어지고 있는 사실이다. 2013년 IPCC(Intergovernmantal Panel on Climate Change)의 발표에 따르며, 메탄은 이산화탄소에 비해 20년간 대기에 머물시, 약 84배 정도 지구 온난화에 더 영향력을 끼치는 물질로 발표되었다. 대기 중의 이산화탄소 농도는 약 400 ppm으로 1.83 ppm 정도의 메탄에 비하여 약 220배 이상에 달하기는 하지만, 시간이 지남에 따라 이산화탄소와 메탄의 대기 중 농도는 지속적인 증가형태를 보여주고 있다(Fig. 11). 지구 온난화가 온실가스에 상당히 영향을 받는다는 설을 고려하였을 때, 지구 대기에 커다란 영향을 끼칠 메탄이 다량 함유된 천연가스 하이드레이트는 지구 환경에 커다란 영향을 미칠 가능성을 내포하고 있다(MacDonald, 1990b; Bohannon, 2008; Mascarelli, 2009; Whiteman et al., 2013; Ruppel and Kesslers, 2017).
지구 온난화에 의한 지구 전체적인 온도 상승은 해수의 온도 상승도 이끌며, 이는 낮은 온도와 높은 압력의 조건에서 안정되게 유지되는 퇴적층 내 천연가스 하이드레이트의 상태에도 영향을 끼칠 수 있게 된다. 이에 따라 육상 및 해상의 하이드레이트 모두 지구 온난화에 의한 온도 상승 효과로 안정성에 영향을 받게 되며, 이를 통해 메탄 가스의 대기 방출이 일부 발생할 것으로 예측된다. 이에 따라 방출된 메탄 가스는 추가적인 온난화에 기여하여 지구 온도의 상승을 추가적으로 유발하며, 지속적인 온도 상승과 하이드레이트 안정성 변화의 영향으로 지구 온난화가 폭발적으로 가속화될 것이라는 가설이 제시되었다. 이에 관한 가설의 도입으로 수리 모델을 활용한 지구 온도 변화와 하이드레이트로부터 방출된 메탄에 관한 이론이 연구되고 있으며, 이를 심도 있게 연구하기 위하여 퇴적층 내 하이드레이트의 안정성 및 깊이, 메탄의 방출에 따라 대기에 도달하기까지의 과정, 해수와 퇴적층에서의 메탄 흡수(Methane Sink) 등 다양한 요소를 고려해야 된다고 평가된다. 하지만 아직까지 지구 온난화 과정을 통해 가스 하이드레이트 해리가 발생하고, 메탄의 방출에 의한 대기에의 영향에 대한 직접적인 근거는 밝혀지지 않았다고 판단되는 만큼, 심도 있는 추가 연구와 논의가 필요하다 할 수 있다(MacDonald, 1990b; Bohannon, 2008; Mascarelli, 2009; Whiteman et al., 2013; Ruppel and Kesslers, 2017).
결론
본 총설에서는 미래 에너지로서의 가스 하이드레이트를 제대로 이해하기 위해서, 가스 하이드레이트의 구조, 가스 하이드레이트의 물리/화학적 특성, 하이드레이트의 생성 기원과 전 세계적인 분포, 매장량과 생산 기법, 하이드레이트의 지구화학적 영향에 대해 논의하였다. 1810년 경의 가스 하이드레이트의 최초 발견 이후로, 가스 하이드레이트에 관한 물리/화학적 특성에 대한 연구는 방대하게 진행되어 왔다. 그 결과 가스 하이드레이트 동공 내에 포집되는 객체 분자의 종류와 구성 형태에 따라 구조 I, 구조 II, 구조 H 등의 하이드레이트가 형성될 수 있음을 확인하였으며, 자연계에서 발견되는 하이드레이트는 대부분 구조 I, 간혹 구조 II와 H의 하이드레이트도 발견된다는 사실을 알 수 있다. 가스 하이드레이트의 구조가 바뀌어도 그 성분은 약 80% 이상의 물과 나머지의 객체 분자로 구성되어 하이드레이트의 구성 성분 비율에는 큰 변화가 없지만, 하이드레이트 구조의 변화에 따라 상평형 조건이나 하이드레이트의 물성 변화가 야기된다. 이에 따라, 하이드레이트 기초 물성과 구조의 이해는 안정적인 에너지개발을 위한 하이드레이트 응용 기술개발에 필수적이라 할 수 있다.
안정적인 에너지개발을 위해 고려해야 할 퇴적층 내 매장된 하이드레이트의 독특한 물리/화학적 특성으로는 하이드레이트의 상평형, 해리 엔탈피, 열전도도, 비열, 열확산도, 유체투과율 등이 있으며, 감압법이나 열자극법 등의 하이드레이트 해리를 통한 에너지 회수에 있어 필수적으로 이해가 필요한 하이드레이트의 특성이다. 자연계에 매장되어 있는 하이드레이트를 발견하기 위해서는 퇴적층 내 하이드레이트가 나타내는 독특한 물리/화학적 지표를 활용할 필요성이 있으며, 밀도 차이에 의한 탄성파의 속도 변화, 하이드레이트의 전기적 특성을 활용한 비저항탐사, 하이드레이트 매장지의 염소이온 농도 변화 등이 예가 될 수 있다.
전 세계 바다의 대부분의 하이드레이트는 생물 기원에 의해 생성된 구조 I 하이드레이트로 알려져 있으며, 카스피해나 멕시코만 지역의 몇몇 하이드레이트는 구조 II와 구조 H 하이드레이트가 동시에 발견되는 열기원에 의한 하이드레이트로 밝혀졌다. 전 세계의 하이드레이트 분포와 하이드레이트 내 천연가스의 매장량 예측은 생물기원에 의한 구조 I 하이드레이트 기반인 경우가 많은 만큼, 정확한 하이드레이트 분포 및 에너지원으로서의 가치를 판단하기 위해서는 열기원 하이드레이트에 대한 자세한 이해를 바탕으로 이루어져야 할 것으로 판단된다. 하이드레이트 생산기법은 하이드레이트 해리를 기반으로 한 감압법, 열자극법, 억제제 주입법과 심해저 하이드레이트 구조를 그대로 유지하는 맞교환기법이 있으며, 감압법이 현재까지 해상 및 육상의 하이드레이트에 대해 모두 시험생산에 적용된 유일한 기법이다.
마지막으로 에너지원으로의 하이드레이트 뿐만 아니라 하이드레이트의 해리를 통한 천연가스 배출 시 발생할 수 있는 지구화학적 환경 영향에 대한 요소도 고찰하였으며, 하이드레이트 내의 천연가스 배출은 지구온난화 가속 및 추가적인 온실가스 배출로 이어질 가능성이 있음을 확인하였다. 하지만 아직까지 지구 온난화 과정을 통해 가스 하이드레이트 해리가 발생하고, 메탄 가스의 방출에 의한 대기에의 직접 영향에 대한 직접적인 근거는 밝혀지지 않았다고 판단되는 만큼, 추가적인 논의와 관심이 필요할 것으로 판단된다.