서론
재료 및 방법
연구지역
시료채취 및 분석
수질시료 채취 및 분석
메탄가스 채취 및 분석
연구 결과 및 고찰
수질분석
메탄 flux 산정
수질특성과 메탄 flux의 상관관계 해석
결론
Nomenclatures
서론
최근 각 국가에서는 지구온난화의 원인인 대기 중 온실가스의 증가 가속화를 지연하기 위하여 온실가스를 감축하는 노력을 기울이고 있다. 온실가스 중 이산화탄소 다음으로 지구온난화에 기여한다고 알려진 메탄은 이산화탄소보다 23배의 온실효과(Greenhouse effect)를 가지고 있기 때문에 효과적인 온실가스 감축을 위해 메탄의 저감에 대한 연구가 수행되고 있다(Pangala et al., 2010; Wieczorek et al., 2011; Park et al., 2016).
전체 인위적 메탄 발생원의 비율 중 에너지 부문은 28.65%를 차지하고, 폐기물 부문은 20.61%를 차지하는데(Karakurt et al., 2012) 광산지역에서 발생하는 메탄의 경우 두 부문 모두와 관련되어 있다. 광산지역에서 발생하는 메탄은 채탄 대상인 석탄층으로부터의 방출과 광산배수 처리시설 중 소택지로부터 방출 될 가능성이 있다.
첫째로 광산 폭발 사고도 일으키는 많은 양의 메탄가스는 동식물들이 변성 변형되고 생화학적으로 부패되면서 석탄층 내부에 저장되며(Jang, 2012), 지층의 틈(단층, 절리 등)을 통해 직접 대기로 방출되고 있다. 탄광(coal mine)의 탄층에서 방출되는 메탄가스는 갱내에만 국한되지 않고 이동하는 수체에 용해되어 지표수와 지하수에 영향을 미치게 된다. 폐광 후에는 채굴적 내에 수위가 상승하여 수압으로 인해 대기에 방출되는 메탄가스의 양은 줄어들기도 한다(Krause and Pokryszka, 2013). 메탄의 용해도는 매우 낮지만 지표로 방출되는 지하수에 용존된 상태로 2000 m까지 이동하며 배출된다고 알려져 있다(Heilweil et al., 2013). 따라서 광산에서 이동한 수체의 집수지는 메탄을 대기로 방출하는 장소가 될 수 있음을 예상할 수 있다.
둘째로 폐광에서 흘러나오는 광산배수는 주변 수계를 오염시킬 수 있는 용존물질이 많아 처리가 필요하다. 국내의 경우, 대부분의 탄광이 채광을 중지하여 많은 폐탄광이 산재해 있으며 발생되는 광산배수를 정화하기 위해 적합한 처리시설을 조성하고 있다. 광산배수의 정화시설로 초기설치비가 낮고 유지관리의 경제성이 높은 자연정화시설이 주로 적용되고 있다(Jung et al., 2012). 자연정화시설 중 습지를 모사하여 조성한 인공습지인 호기성소택지는 광산배수를 저류시켜 집수지가 되기도 하여 용존메탄을 잠재적으로 함유할 뿐만 아니라 기저의 토양을 이루는 물질은 유기질 퇴비가 복토되어 잠재적 메탄 발생원이 된다. 광산지역의 호기성 소택지와 유사한 ‘습지’는 자연발생원 중에서 70 %를 차지하며 전 지구적 발생량 중 1/3을 차지하는 주요 메탄발생원이다(Cho and Jung, 2017; Kim and Choi, 2011). 또한 시간이 지남에 따라 식물 사체 등의 유기물질이 퇴적되고 있어 메탄 발생 가능성이 높다.
메탄 발생량의 일반적인 통계에서는 용존상태에서 대기로 방출되는 메탄이나 호기성소택지로부터 발생되는 메탄을 고려하지 않고 있어 광산지역에서 발생하는 메탄의 발생량이 집계된 값과 다를 가능성이 있다는 점을 시사하고 있다. 최근 메탄저감의 중요성이 인지되고 있어서 광산지역에서 발생하는 메탄의 정량적인 배출량 산정에 대한 연구가 필요하다.
몇몇의 연구에서 습지의 생지화학적 환경을 메탄 흡수(sink)원으로 작용하도록 조성한다면 효과적인 탄소저장소가 될 것이라는 긍정적인 전망이 있다(Sha et al., 2011; Wu et al., 2017; Whiting and Chanton, 2001). 또한 국내에서도 수질정화용 인공습지에 메탄 저감목적으로 온실가스 저감능을 갖춘 인공습지 조성연구를 보고한 사례가 있다(Ministry of Environment, 2014).
호기성소택지는 메탄발생의 가능성은 높지만 메탄의 산화능력도 잠재하고 있어 메탄 저감을 위한 습지의 기능을 확대한다면 메탄산화의 높은 효율을 기대할 수 있을 것이다. 광산배수의 처리를 위한 시설로서 인공습지의 수는 계속 증가하고 있으며 광산배수는 장기간 광산지역 주변의 환경에 영향을 미쳐 정화시설의 운영이 지속적으로 필요하다. 본 연구는 광산지역의 정화시설에서 발생하는 메탄가스를 저감하기 위한 기초연구로 수행되었다. 이를 위해 광산지역 외의 인공생태습지를 선정하여 수질과 메탄발생량의 측정과 비교를 통해 인공습지 수질특성이 메탄발생에 미치는 영향을 조사하고, 인공습지인 호기성소택지를 대상으로 광산지역 인공습지의 메탄발생량을 산정하였다.
재료 및 방법
연구지역
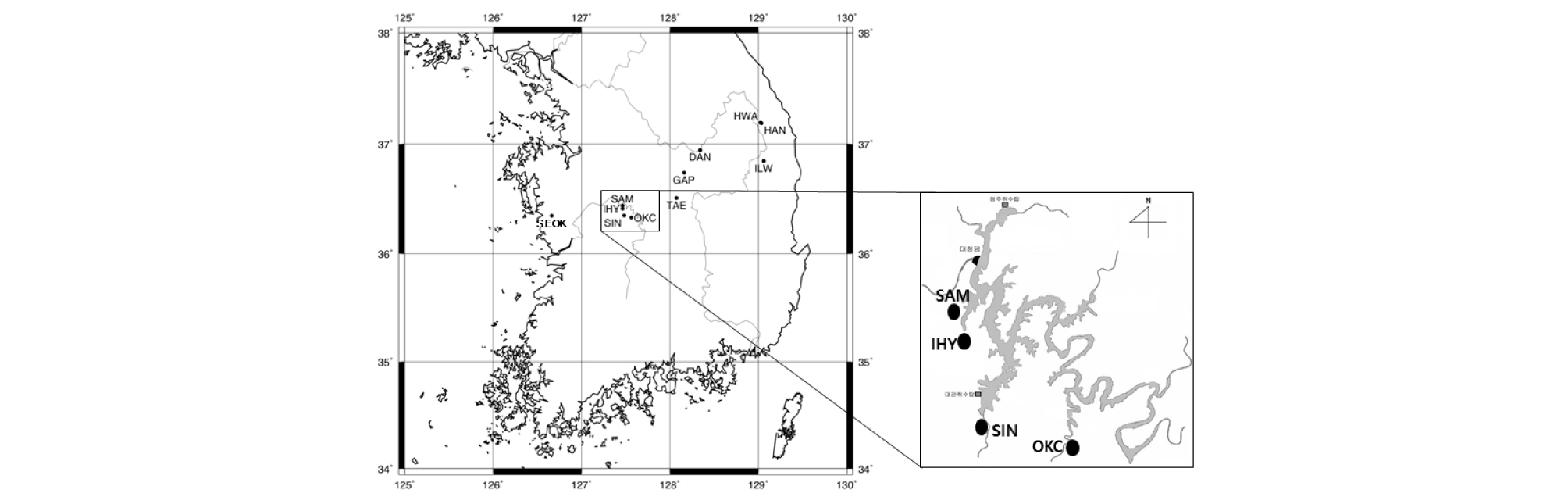
연구대상 지역은 강원도, 충청도, 경상도 지역에 소재한 폐탄광의 수질정화시설 7곳(단양, 갑정, 한양, 일월, 황지유창, 석공신성, 태백)과 옥천소재와 대청호 주변의 인공생태습지 4곳(옥천, 신상동, 삼정동, 이현동)을 선정하였다(Fig. 1). 본 연구대상 지역은 접근이 용이한 광산배수 자연정화시설로 대략 위도 36°에서 37° 사이에 분포하는 정화시설을 대상으로 선정하였다. 인공생태습지는 광산의 영향을 받지 않는 지역으로 광산지역과 비교할 수 있는 곳으로 선정하였다. 일반 인공생태습지의 메탄 발생량 및 계절별 특성을 파악하기 위하여 2개월 간격으로 메탄가스를 채취하였다.
연구지역 폐탄광의 수질정화시설 중 호기성소택지는 전 단계에서 정화한 후 남은 미량의 중금속을 식물, 퇴비와의 흡착과 이온교환 또는 부유물질의 침전 등의 과정을 통해 수질을 정화한다. 일반적으로 유기질 퇴비를 복토하고 수심은 대략 0.3 m로 얕게 조성하며, 부들 등의 수생식물을 식재한다. 또한, 인공생태습지는 녹조문제와 강우 시 하천으로 유입될 수 있는 농경지, 도로, 농지 등에서 발생한 비점오염원으로 오염된 수질을 정화하기 위한 시설이다. 각 생태습지에는 창포, 부들, 갈대 등의 수생식물들이 식재되어 있고, 식물에 의한 정화작용을 기대할 수 있다. 연구지역인 대청호 주변에 조성된 인공생태습지는 침강 저류지와 다단의 인공습지로 구성되어 있으며 평균 수심은 0.5 m로 조성되었다.
시료채취 및 분석
수질시료 채취 및 분석
습지의 수질을 분석하기 위해 수면의 약 10 cm 깊이까지 플라스틱 비이커를 이용해 채취하고 현장에서 휴대용 측정기(HQ40d, HACH)를 이용하여 각 전극으로 온도, 수소이온농도(pH), 용존산소함량(DO), 산화환원전위(ORP), 전기전도도(EC)를 측정하였다. 또한 수질 분석용 시료는 현장에서 0.45 µm 필터(Whatman)로 여과하여 음이온 분석용 시료는 50 ml conical tube에 담았다. 또한 2가철 분석용 시료에는 염산, 양이온 분석용 시료에는 질산을 처리한 후 50 ml conical tube에 각각 담고 실험실로 운반하여 4°C로 냉장 보관하였다. 용존 유기탄소(TOC) 분석용 시료는 필터링하여 40 ml 유리병에 headspace없이 채취하였다. 유기탄소는 메탄의 발생원으로 수질의 TOC는 습지의 유기물질 지표로써 분석하였다. 수질 분석기기로 양이온은 유도결합 플라즈마 발광광도계(ICP-OES, Ultima2, Horiba), 음이온은 이온 크로마토그래프(IC, Metrohm), 용존유기탄소는 TOC analyzer (TOC-L CPH, Shimadzu corp.), 2가철은 UV-VIS 분광광도기(UV-Visable spectrometer, HACH)를 이용하였다.
메탄가스 채취 및 분석
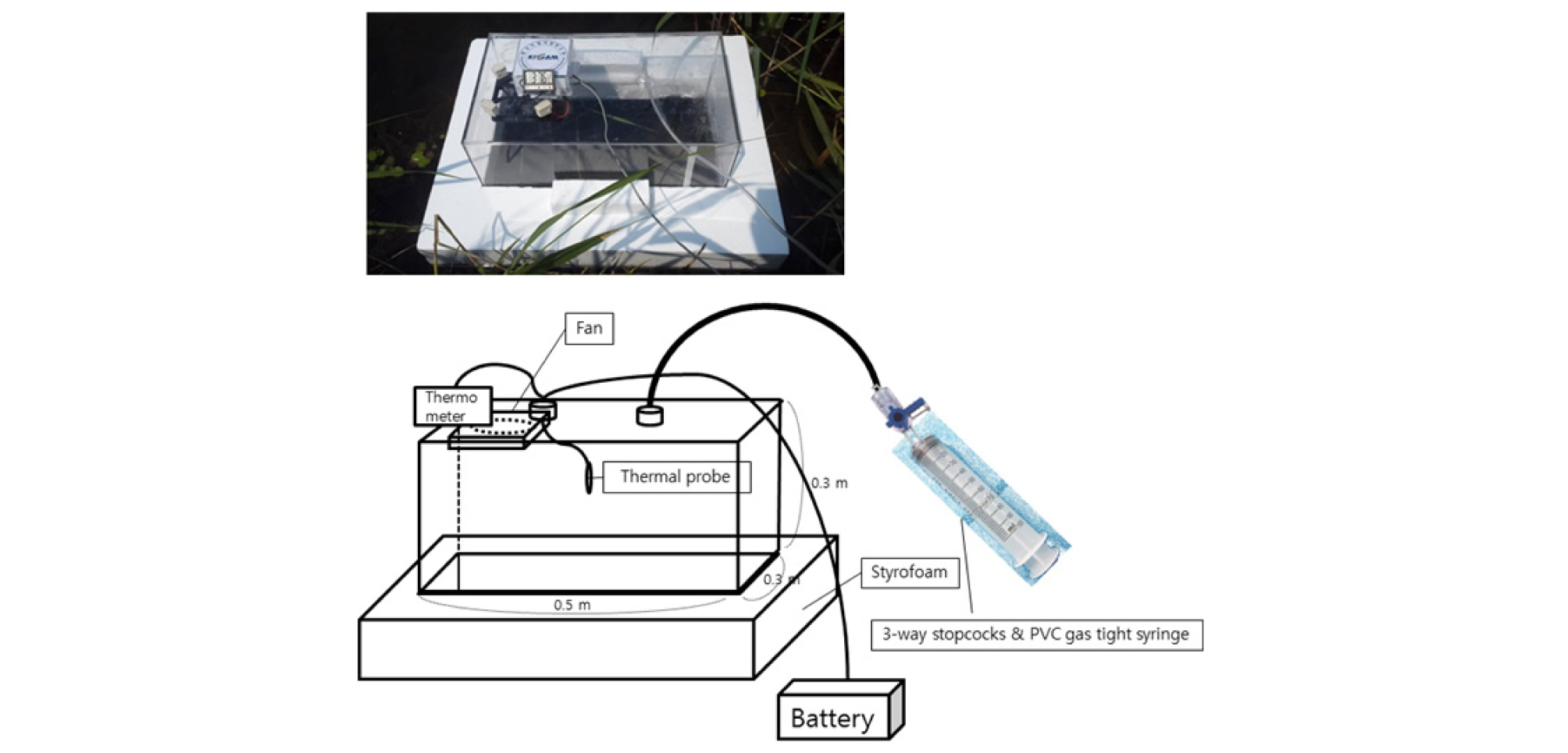
매질 표면으로부터 배출되는 가스상의 유기화합물을 측정하는 방법은 직접 측정, 간접 측정, 이론적 모사가 있으며 플럭스 챔버법(flux chamber method)은 대표적인 직접 측정법으로써, 오염된 토양이나 수표면으로부터 발산되는 가스의 배출량을 측정할 수 있는 기법이다(Jeong et al., 2016). 본 연구의 대상지역인 광산지역과 인공생태습지 지역은 접근이 용이하기 때문에 챔버법을 채택하였다. 연구지역의 조건에 맞게 수면에서 방출되는 메탄을 측정할 수 있도록 부력을 갖춘 폐쇄형 챔버를 제작하였다(Fig. 2). 챔버는 가로 0.3 m, 세로 0.5 m, 높이 0.3 m의 투명한 아크릴소재로 제작하고 상부에 공기를 채취할 수 있는 튜브와 챔버 내부의 공기를 균질하게 하기 위한 팬(fan)을 설치하였다. 상부에 연결된 튜브 주변에 온도계를 설치하여 시료채취 시점의 챔버 내부 온도를 측정하였다. 챔버를 수면에 띄우기 위해 스티로폼을 챔버 주변에 둘러 부력을 주었다. 식재된 식물의 영향으로 인한 챔버내 공기조성 변화를 최소화하기 위해 가스 포집 시 최대한 챔버 내에 식물이 위치하지 않도록 하였다. 챔버를 일정시간 수면 위에 띄워 headspace에 모인 공기를 챔버 상부 연결된 관을 통해 100 ml 주사기를 이용하여 채취하였다. 관과 연결된 주사기는 3-way stopcocks로 연결하여 관 속의 공기흐름을 제어했다. Butyl rubber stopper와 crimp로 밀봉하여 미리 질소기체로 충전한 60 ml vial에 시간별로 채취한 공기를 주사하여 운반했다.
메탄가스의 분석은 가스크로마토그래프(Gas chromatography-flame ionization detector, GC-FID, Agilent)를 이용하였다. 분석 조건은 Table 1에 정리하였다. 현장시료를 분석하기 전에 고농도의 표준가스를 5, 10, 50, 100, 250 mg/L의 다섯 단계로 희석하여 농도별 표준가스를 제작하고, 이를 GC로 농도 측정을 하여 작성한 검정곡선의 결정계수가 0.99 이상일 때 기기분석을 수행하였다.
Table 1. Analytical condition of gas chromatography for methane
| Instruments | GC-FID : 6890 Series (Agilent) |
| Column | Metal packed GC column (stainless steel column, 1/8 inch, ×2 m) |
| Carrier gas | Helium Gas (%) ml/min |
| Oven (initial) | 70°C |
| Oven (end) | 225°C |
| Inlet | 200°C |
| Detector | 250°C |
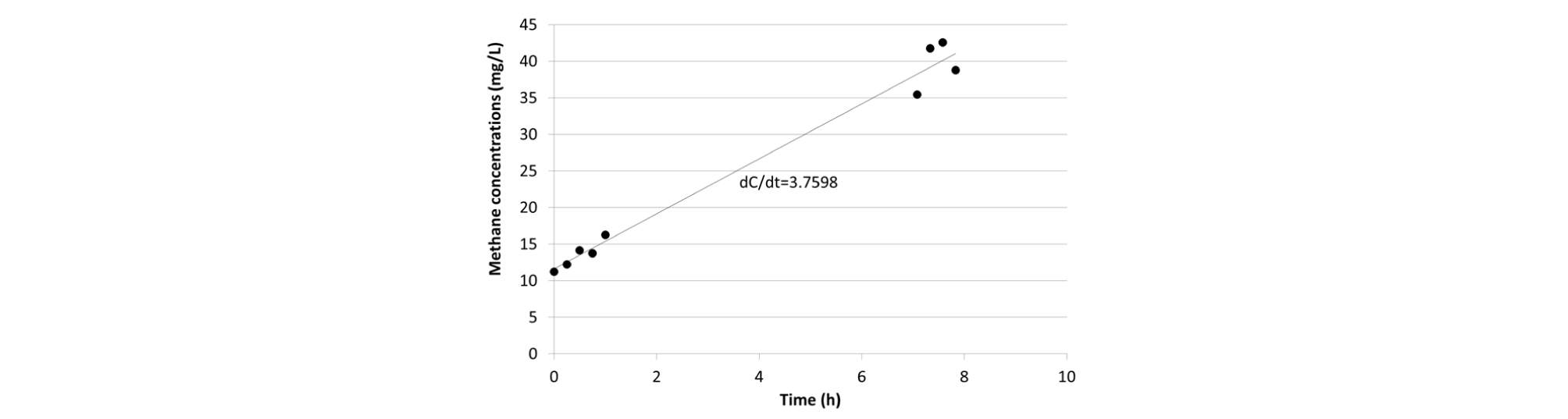
폐쇄형 챔버법에서 메탄의 플럭스(flux)를 산정하는 방식은 시간에 따른 챔버 내부의 농도변화율(dC/dt)을 이용하는 방법과 챔버 내부가 평형상태에 도달한 이후의 농도 값으로 계산하는 평형농도 방식이 있다(Jeong et al., 2016). 실제 자연환경에서 메탄의 장시간 포집 결과는 챔버 내부가 평형상태에 도달하지 못하고 시간대별로 상이한 메탄 발생이 관찰되었다(Fig. 3). 또한 장시간의 메탄을 포집한 결과, 전체 메탄 농도의 증가율(dC/dt=3.7598)이 단시간 측정한 농도 증가율(dC/dt=4.664)보다 낮아 메탄 발생량 측정에 오차를 증가시켰다. 인공습지에서 발생하는 메탄이 환경의 변화에 민감하게 영향을 받기 때문에 장기간 수면의 메탄가스 포집 시 오차가 증가한 것으로 판단된다. 따라서 본 연구에서는 한 시간 동안의 챔버 내부 메탄의 농도 변화율을 이용하는 방법을 채택하였다. 또한, 메탄이 발생할 경우 시간에 따라 챔버 내의 농도가 증가하여 내부 농도의 변화는 증가추세를 유지하고 있다고 가정하였다. 그리고 단순회귀분석법을 사용하여 식 (1)을 통해 메탄 flux를 도출하였다. 자연환경에서 메탄의 농도는 일정하게 증가하지 않으며 샘플링 당시 누출 등의 오류로 인하여 일정한 직선이 도출되지 않을 수 있다. 오류의 발생 가능성을 감안하여 메탄농도들의 회귀분석의 결정계수 값이 0.8 이상일 때를 선형성이 높은 것으로 판단하였다. 챔버 내에서 점차적으로 증가하는 메탄의 농도를 측정하기 위해 1시간 내에 일정한 간격으로 4-5회 채취하였다.
| $$F=\rho\left[\frac VA\right]\;\left[\frac{\triangle C}{\triangle t}\right]\;\left[\frac{273}{(T+273)}\right]$$ | (1) |
수집한 시료의 수질분석 자료와 메탄가스분석 자료를 이용하여 인공습지에서 발생하는 메탄과 수질의 이화학적 특성의 관련성을 파악하고자 하였으며, XLSTAT을 이용해 주성분 분석(Principal component analysis, PCA)을 수행하였다.
연구 결과 및 고찰
수질분석
광산지역 호기성 소택지의 수질을 분석한 결과는 Table 2에 나타냈다. 2017년 7월부터 2018년 6월까지 수온은 16.8~32.1°C 였으며 가을에 접어들면서 측정한 태백광산과 일월광산 지역의 수온은 20°C이하로 측정되었다. 호기성 소택지의 전반적인 pH는 6.5~7.5로 중성을 띠며, 일월에서는 pH 4.4로 산성을 띠었다. 연구대상 광산 지역 중 일월을 제외한 곳에서의 ORP는 혐기성 상태로 나타났다. DO는 연구지역마다 다양하게 나타났다(0.39~10.60 mg/L). 전기전도도(EC)는 227.0 µS/cm~2.3 mS/cm로 측정되었는데 EC의 경우는 메탄의 발생량과 상관성이 낮다는 연구도 있다(Kim and Na, 2013). 산성의 광산배수는 대체적으로 낮은 함량(<10 mg/L)의 TOC가 존재한다고 알려져 있다(Kolmert and Johnson, 2001; Neculita et al., 2007). TOC는 황지유창에서만 59.30 mg/L로 이 곳을 제외한 다른 연구지역에서는 2~8 mg/L 사이의 값을 보인다. 수질에서 나타난 비교적 높은 TOC함량은 지역특성상 수체 아래에 유기탄소원인 유기물질이 비교적 풍부하게 존재하거나 광산배수 이외의 유기탄소를 함유한 다른 유입물질이 있었을 것으로 판단된다. 혐기환경에서 메탄의 생성보다 앞서 환원되는 전자수용체인 황산염 및 질산염의 농도를 데이터 분석에 이용하였다. 질산염의 농도는 낮고(0.00~3.10 mg/L) 연구지역별로 차이가 적어 전자수용체로 이용되는 경우 그 영향이 작다고 판단하였다. 황산염 함량이 가장 낮은 곳은 석공신성(16.22 mg/L)이고 나머지 지역은 252.97~1529.02 mg/L 범위로 높은 농도를 나타냈다. 분석 결과는 지역마다 다양하게 나타났으며 광산배수의 특징을 잘 보여준다(Younger and Mayes, 2015).
Table 2. Water quality of the aerobic wetlands in mine area
인공생태습지는 호기성소택지와 비슷한 환경조성을 이루지만 수질의 차이로 인해 메탄의 발생특성 차이가 있을 수 있다고 예상되었다. 호기성소택지와 비교를 위해 인공생태습지에서 측정한 수질분석 결과는 Table 3에 나타냈다. 인공생태습지의 pH는 호기성 소택지보다 전반적으로 높은 pH를 보이며 그 범위는 pH 6.46~9.98이다. 호기성소택지와 달리 인공생태습지는 모두 호기성조건(ORP>0 mV)을 나타낸다. 수온은 겨울로 접어들면서(11월) 봄이 되기 전까지 15°C 이하로 낮아지는 것을 볼 수 있다. 인공생태습지에서는 용존산소량 공급 및 수온을 균등하게 유도하기 위한 폭기 시설의 작용으로 지표수는 10 mg/L 이상의 높은 DO(4.66~16.95 mg/L)를 나타내며 전체적으로 호기성 소택지보다 높은 편이다. 인공생태습지에서는 7월경 채수한 시료에서 높은 TOC함량(31.83~64.90 mg/L)을 보이고, 그 이후의 계절에는 광산지역의 수질과 유사하게 10 mg/L 이하로 나타난다(3.73~9.88 mg/L). 여름철에 다소 높은 TOC농도를 보이는 이유는 풍부한 강우로 인해 많은 물이 유입되면서 유기오염물질의 유입이 동반되고 높은 기온에서 식물생육이 왕성하기 때문으로 판단된다. TOC와 수온은 계절변화에 따라 큰 변동을 보였다. 황산염과 질산염 분석 결과, 광산지역의 수질과 달리 황산염함량이 낮고(2.81~87.48 mg/L) 질산염의 농도는 비교적 높게 나타났다(0.00~82.00 mg/L). 삼정동과 이현동에서 옥천과 신상동에 비해 대체적으로 낮은 황산염과 질산염의 함량이 측정되었다. 옥천과 신상동의 경우, 12월에 높은 질산염이온의 농도를 보였다. 이는 탈질화 현상의 적절한 온도 범위는 20-25°C로 15°C이하에서 확산비율과 미생물의 활동의 감소로 인하여 탈질화의 비율이 감소했기 때문으로 판단된다(O’Geen et al., 2010). 이현동의 경우 다른 지역보다 수심이 매우 얕아(대략 0.1m 내외) 메탄이 발생하게 된다면 메탄의 이동과정 중 수체의 영향을 제일 적게 받을 것으로 판단된다.
Table 3. Monthly physico-chemical properties of wetland water in constructed ecological wetlands from July to June during a year (Dash indicates no sample, O.R.: over range).
메탄 flux 산정
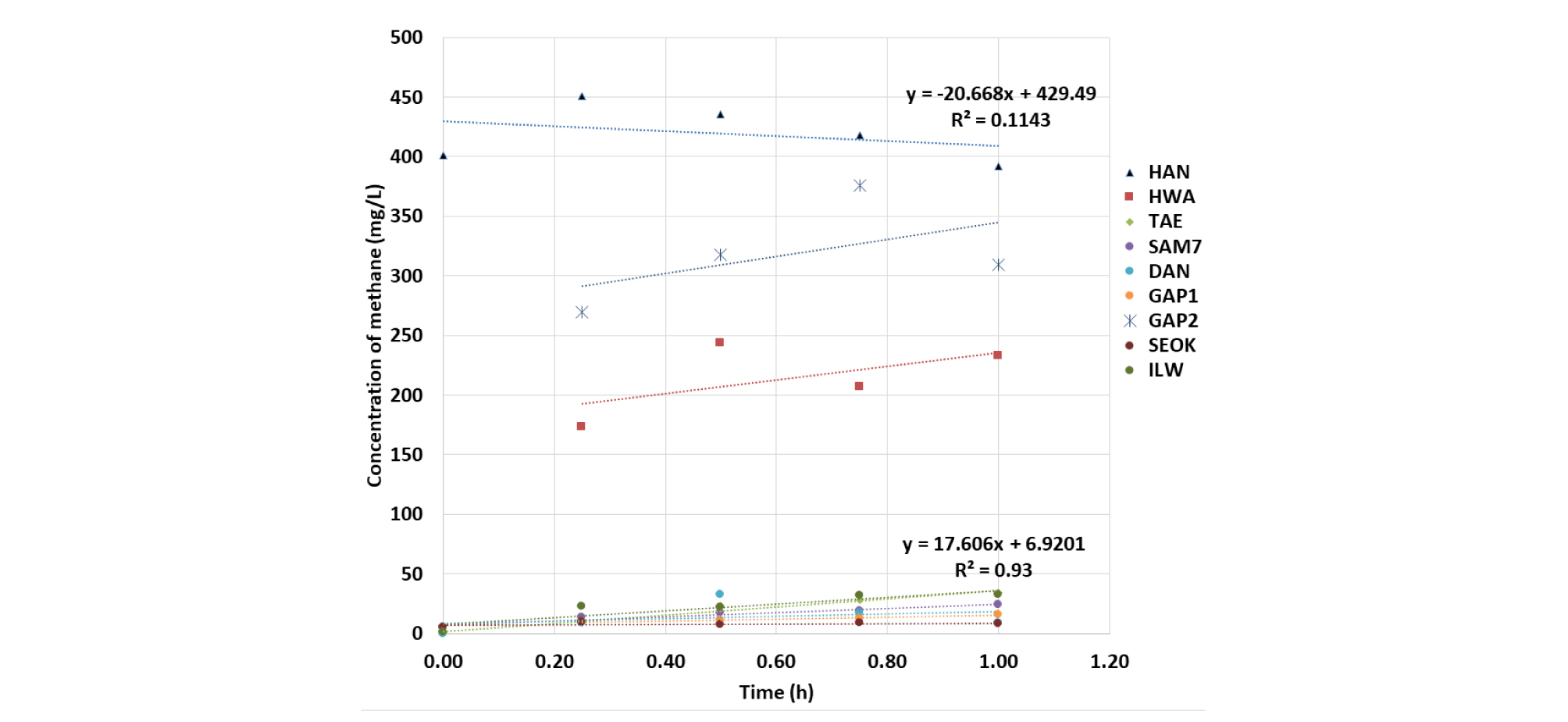
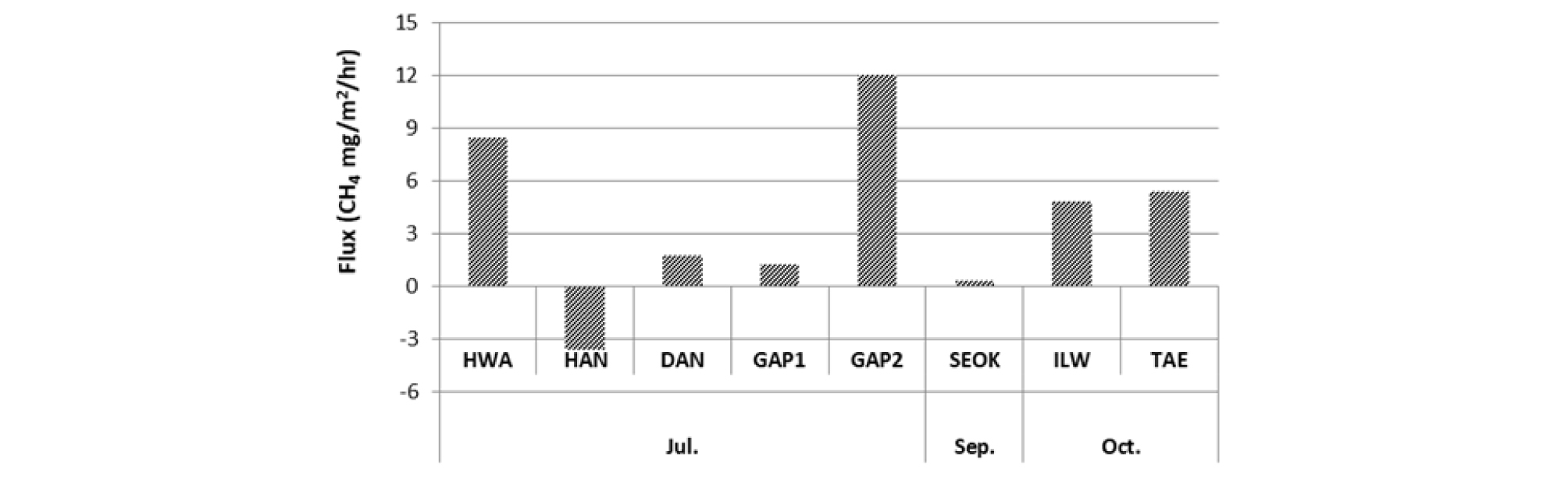
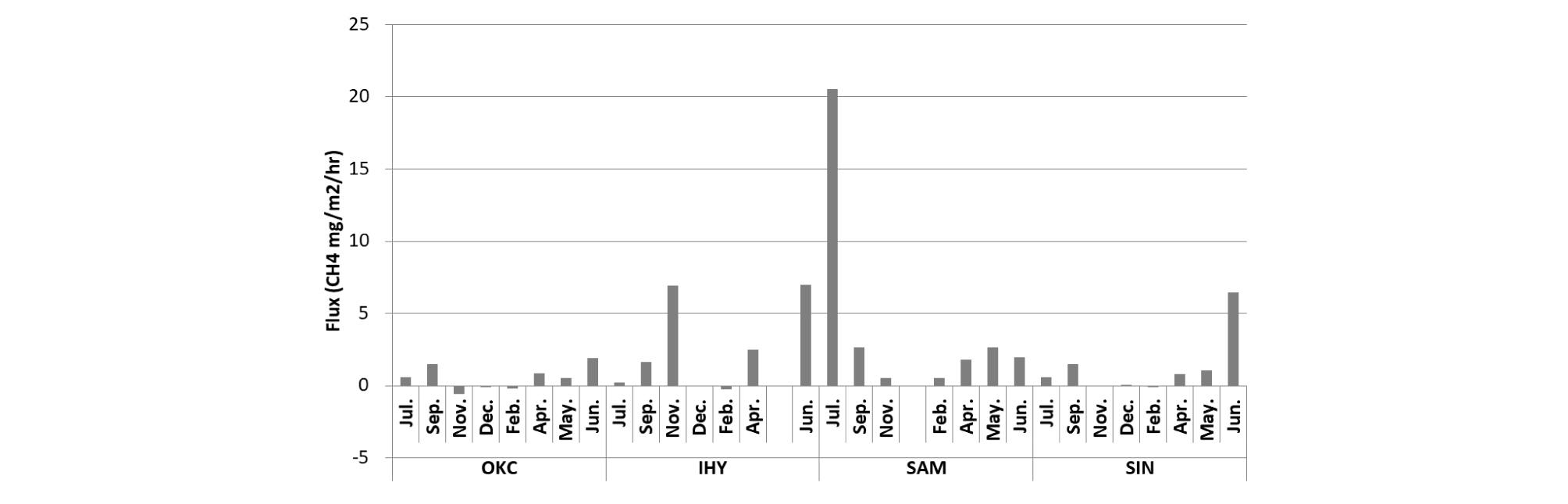
Fig. 4에는 연구지역 중 광산지역소택지에서 측정한 시간별 메탄 농도를 나타냈다. 한양(HAN)의 경우 다른 지역에서 측정되는 메탄 농도의 양상과 달리 메탄 포집 초반에 높은 메탄 농도가 측정되고 서서히 감소하는 경향을 보여 뚜렷하게 감소하는 flux가 나타났다. 인공생태습지인 삼정동에서 측정한 메탄의 농도와 비교할 때 확연히 다른 flux의 양상을 나타낸다. 이 결과는 표면의 메탄을 측정하는 챔버법을 통해 대기로 발생하는 메탄과 대기에서 수면으로 흡수되는 메탄을 동시에 측정할 수 없는 한계 때문으로 판단된다(Nazaries et al., 2013). 평균적인 메탄의 농도는 한양, 갑정2, 황지유창 순으로 세 곳이 다른 연구지역보다 상위를 차지하였다. 세 곳은 같은 계절에 측정하여 계절적 변화에 의한 차이는 적을 것으로 판단된다. 인공생태습지의 계절별 변화를 관찰한 결과, 여름철 및 가을철에 대체적으로 높은 메탄 flux를 나타내어, 여름철에 활성화된 미생물과 퇴적된 유기물질로 인하여 가을철에 메탄 생성 활동이 활발하며 겨울철의 낮은 온도로 인해 미생물의 활성도가 떨어질 것으로 판단된다. 이현동의 경우는 11월에 다른 지역과 달리 유일하게 메탄이 발생하여 높은 flux값을 보여주는데, 이곳은 수심이 매우 얕고(약 0.05 m) 다른 인공생태습지에 비하여 수풀이 무성하게 우거져 기저 토양에서 발생한 메탄이 수체의 영향을 거의 받지 않고 방출되거나 식생을 통해 방출된 메탄이 많을 것으로 판단된다.
호기성 소택지에서 지역에 따라 측정된 메탄의 농도는 다양하다(10~450 mg/L). 인공생태습지(-0.6~20.5 CH4 mg/m2/hr)와 광산지역의 호기성소택지(-3.6~12.0 CH4 mg/m2/hr)에서 다양한 메탄 flux가 산출되었다(Figs. 5 and 6). 유럽의 자유수면 인공습지에서 산출된 메탄 flux는 대략 1.21~14.58 CH4 mg/m2/hr로 보고되었으며(Søvik, A. K. et al., 2006), 본 연구의 결과도 이와 유사한 범위를 나타냈다. 국내의 내륙습지 메탄 flux 산정연구는 많지 않은 실정이나 Kim and Na (2013)의 내륙습지에서 측정한 메탄 flux는 0.155±0.29 CH4 mg/m2/hr로 산정되어, 본 연구에서 더 높은 메탄 flux가 산출된 것으로 나타났다. 기존 문헌에서 챔버법으로 측정한 메탄 flux를 본 연구와 비교한 결과(Table 4), 폐수처리장에서 습지보다 높은 메탄 flux가 산출되며 갯벌과 토양에서 방출되는 메탄 flux는 습지에서 측정된 것보다 낮은 범위를 나타냈다. 이탄지는 습지보다 높은 평균값을 보이며 습지의 경우 그 종류와 위치에 따라 다양한 메탄 flux범위를 나타내는 것을 확인할 수 있다.
Table 4. Comparison of methane flux from kinds of site (flux units: CH4 mg/m2/hr).
수질특성과 메탄 flux의 상관관계 해석
연구대상 지역의 수질과 메탄 flux를 산출하여 그 상관 정도를 분석하고자 하였다. 계절에 따라 수온이 높은 여름, 가을철에 메탄 flux는 높게 나타났으며 10~15°C 이하인 겨울철의 메탄 flux가 적게 나타난 것은 수온과 메탄 flux사이의 연관성이 있는 것으로 보인다. 기존의 연구에서 수온은 중요한 메탄발생량의 지시자로 15°C 이상에서 온도와 메탄발생량이 비례하고(Maucieri et al., 2017, Kim and Na, 2013), 대략 10°C의 낮은 온도에서 메탄발생량과의 상관성은 낮았으며 발생하는 메탄의 양 또한 미미하며, 15~18°C 범위 미만의 수온은 미생물활동으로 생성되는 메탄이 제한적으로 발생하는 임계값(threshold)으로 알려져 있다(Groh et al., 2015). 또한 Rask et al.(2002)은 메탄의 발생은 15~30°C에서 온도와 양(+)의 상관성을 보였으나, 온도가 10°C 미만에는 상관성을 잘 보이지 않는 것으로 보고하였다. 이는 상온에서 활발히 작용하는 메탄을 생성하는 미생물의 활성도가 낮은 온도에서 떨어지기 때문으로 판단된다. 연구대상 광산지역 중 황지유창과 여름철 인공생태습지의 경우 다른 연구대상 지역에 비해 높은 TOC농도가 측정되었다. TOC는 메탄을 생성하는 미생물의 탄소원이 될 수 있으며 미생물이 분해하는 유기탄소의 양과 메탄 flux는 양(+)의 상관관계를 가진다고 알려져 있다(Maucieri et al., 2017). 광산지역의 수질 특성 중 하나인 황산염의 높은 농도는 연구대상 광산지역 대부분에서 뚜렷하게 보인다. Fig. 4에서 평균 메탄 농도가 높은 세 곳의 황산염 농도를 비교한 결과, 평균 메탄 농도가 높을수록 황산염의 농도는 낮아진다. 이 황산염은 미생물의 반응에서 메탄생성균이 기질을 이용하는 것 보다 황산염환원균이 기질을 이용할 때 먼저 이용되는 이온으로 황산염의 농도가 높을수록 메탄 생성을 완화할 수 있는 것으로 알려져 있다(Li et al., 2017). 전체 연구대상지역에서 측정된 황산염 농도와 메탄 발생량이 절대적인 음의 상관관계를 보이지 않았다. 광산지역의 정화시설에서 발생하는 황산염환원 반응을 연구한 결과 중에 광산배수 정화시설에서 황산염이 환원되지 않는 것으로 나타난 연구도 있어(Ji and Kim, 2003) 메탄 발생량과 황산염 농도는 반비례하지 않는 것으로 판단된다. 또한 황산염 환원반응이 일어나지 않는 경우, 소택지 기저 토양에서 환원되어 대기로 발생하는 메탄의 양은 적을 것으로 예상되며 이 때 발생하는 메탄의 기원이 갱내수일 가능성이 있다.
현장자료와 분석데이터를 이용해 인공습지 수질의 이화학적 특성과 표면에서 발생하는 메탄 flux의 특성을 다각적으로 분석하기 위하여 XLSTAT2018(Addinsoft, USA)을 이용한 주성분 분석(Principal component analysis, PCA)을 실시한 결과는 Fig. 7과 같았다. 제 1주성분 (F1)과 제 2 주성분 (F2)은 각각 총 변동의 27.25%와 18.12%를 설명하여 총 변동의 45.37%를 설명하였다. 각 인자들의 요인부하량은 Table 5에 나타냈다. F1은 황산염, EC와 큰 양의 연관성이 있고, F2는 메탄 flux, 수온, TOC, DO와 큰 양의 연관성이 있는 것으로 나타났다. F1에서 여름철 인공생태습지 및 광산지역소택지 시료들은 양의방향에 위치한 메탄 flux, TOC, 수온, 철 이온, 황산염, EC가 분포하였고, 음의 방향에 위치한 봄, 가을철 및 겨울철 인공생태습지 시료들은 현장에서 측정한 수질 중 DO, ORP, pH와 질산염의 특성에 위치하였다. F2에서 양의 방향에 위치한 시료들은 겨울철 측정한 시료를 제외한 대부분 인공생태습지시료들로 현장수질측정 자료 중 DO, ORP, pH와 메탄 flux, TOC, 수온이 분포하였다. 그리고 음의 방향에 위치한 겨울철 인공생태습지 및 광산지역소택지의 시료들은 수질의 이화학적 특성 중 황산염, 질산염과 EC와 함께 분포하였다. 광산지역소택지의 시료의 경우 높은 황산염 농도를 띠며 높은 상관성을 보였으나 메탄 flux와 같은 그룹에 위치하지 않아 상관성 분석에 한계를 보였다. 이는 기존문헌의 연구결과에 따라 광산지역소택지에서 황산염의 환원에 의해 메탄 생성 및 대기로의 발생량이 감소한다면 더 많은 광산지역소택지의 시료만을 이용하여 상관성 분석을 통해 유의미한 결과가 나올 것으로 예상된다. 겨울철 인공생태습지와 겨울철에 상대적으로 높은 질산염의 농도는 높은 상관성을 보이며 겨울철 탈질반응이 낮게 나타난 것을 의미한다. 주로 탈질세균에 의한 탈질반응은 수온에 영향을 받는 것으로 알려져 있으며(Bachand and Horne, 2000), 겨울철 인공생태습지에서 탈질반응이 낮게 나타난 것은 약 15°C 이하의 낮은 수온에 영향을 받은 것으로 볼 수 있다. 이와 같이 PCA 분석 결과, 광산지역소택지의 수질은 황산염과 뚜렷한 관련성을 보였으며, 인공생태습지의 경우 여름철에는 메탄 flux, TOC, 수온과 관련성이 있어 보이며 겨울철에는 질산염과의 높은 관련성을 보인다.
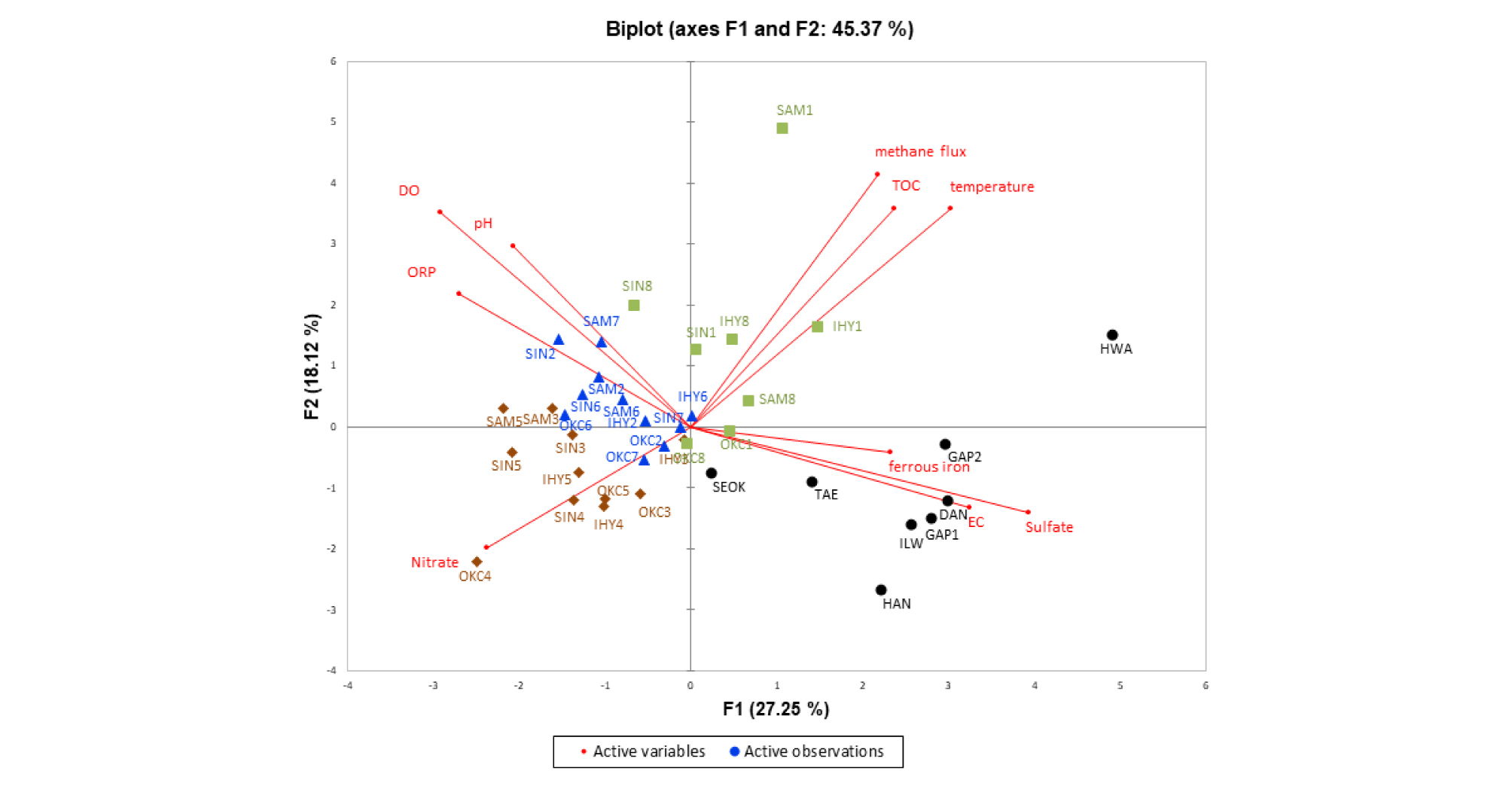
Fig. 7.
A principal component analysis biplot diagram showing the correlation between each observation points and variables (The seasonal differences of each sampling point were depicted using different colors and numbers: the green squares, brown diamonds, and blue triangles indicate non-mine site samples collected in summer, winter, and spring/autumn seasons, respectively. The black circles indicate mine site samples collected throughout the year).
Table 5. Figure of factor loadings used through PCA analysis
| F1 | F2 | |
| Methane flux | 0.410 | 0.637 |
| Temperature | 0.572 | 0.550 |
| pH | -0.389 | 0.457 |
| EC | 0.613 | -0.203 |
| DO | -0.550 | 0.541 |
| ORP | -0.510 | 0.334 |
| TOC | 0.447 | 0.551 |
| Nitrate | -0.448 | -0.306 |
| Ferrous iron | 0.439 | -0.064 |
| Sulfate | 0.741 | -0.217 |
결론
본 연구는 광산지역의 호기성 소택지에서 발생하는 메탄의 양과 거동특성을 파악하기 위해 메탄 발생량을 측정하고 수질분석을 수행하였다.
메탄의 발생량을 측정한 결과, 광산지역의 인공습지마다 다양한 범위(10~450 mg/L)의 메탄이 발생하는 것을 확인하였다. 광산지역의 수질은 다량의 황산염(100 mg/L이상)을 함유하였고 일반 인공생태습지와 비교하여 구분되는 특성을 보였다. 또한 여름철의 인공생태습지에서 수질의 TOC 농도와 온도 등이 메탄 flux와 연관성이 있음을 확인할 수 있었다.
메탄 flux산정 결과, 기존연구에서 확인되는 15°C 이하의 낮은 온도에서 메탄의 발생이 일어나지 않았다. 또한 광산지역 호기성소택지에서 유럽의 자유수면 인공습지에서 측정된 메탄 flux의 범위와(1.21~14.58 CH4 mg/m2/hr) 유사한 메탄 flux(-3.6~12.0 CH4 mg/m2/hr)를 나타내고 있음을 확인하였다.
PCA 분석 결과, 광산지역 호기성 소택지는 황산염과 뚜렷한 상관성을 보이며, 인공생태습지는 여름철에는 메탄 flux, TOC, 수온과 겨울철에는 질산염과의 높은 상관성을 보인다. 미생물의 활동으로 인한 메탄의 발생과 수질의 특성변화는 계절별 온도에 영향을 받는다.
본 연구를 통하여 광산지역소택지에서 발생하는 메탄의 기원에 대해 정량적으로 분석하는데 한계가 있다. 따라서 향후, 광산지역 및 인공생태습지에서 발생하는 메탄의 특성과 기원에 대한 연구를 위해 발생의 원인이 되는 기질 및 기질을 이용하는 미생물에 대한 정량적인 연구가 선행되어야할 것으로 판단된다.