서론
실험방법
시료채취 및 특성 조사
토착 미생물 분리 및 동정
W 거동에 미치는 미생물 영향
결과 및 토의
토양 시료의 물리화학적 특성
토착 미생물 분리 및 동정
W 거동에 미치는 미생물 영향
결론
서론
환경지구화학적으로 독성 (준)금속원소는 자연 용존상태에서 대부분 +2가의 산화수를 갖는 금속(예를 들면, Cd, Cu, Pb, Zn, Ni 등)과 두 개 이상의 산화수로 나타나는 금속 및 준금속(예를 들면, As, Cr, Se, Sb 등)으로 나눌 수 있다. 후자는 용존상태에서 단일 이온이 아닌 산소와 결합한 산화음이온 상태로 주로 존재한다. 예를 들어, 비소는 산화상태에서 H2AsO4- 및 HAsO42-, 환원상태에서 H3AsO30 및 H2AsO3-로 주로 존재한다. 또한 다양한 산화수로 존재하므로 산화환원전위에 민감하게 반응하며, Fe 또는 Mn과 마찬가지로, 같은 원소임에도 불구하고 그 산화수에 따라 지구화학적 거동이 확연히 달라진다.
그간 이화적(dissimilatory) 또는 해독성(detoxifying) 기제에 의하여 Fe, Mn, SO42-를 비롯한 As, Cr, U, Se, Tc 등 자연상태에서 두 개 이상의 산화수를 갖는 원소의 산화환원전위를 변화시키는 미생물에 관한 지구미생물학적 연구가 매우 증가하였다. 최근에는 Sb가 국제적으로 많은 주목을 받고 있으며(Filella et al., 2002a,b, 2007; Oorts et al., 2008; Qi et al., 2008), 이와 더불어 미생물에 의한 Sb 산화수 변화에 관한 연구도 시작되었다(Li et al., 2013; Abin and Hollibaugh, 2014; Nguyen and Lee, 2014, 2015, Joo et al., 2016).
텅스텐(W) 역시 용존 상태에서 다양한 산화수를 갖는 원소이다. 연구가 많이 이루어진 As 및 Sb 등과는 달리 W에 대한 지구미생물학적 연구는 국내는 물론 국제적으로도 수행된 바 없다. 두 개 이상의 산화환원전위를 갖는 원소 중 미생물학적 과정과 연관되어 아직 본격적으로 연구되지 않은 것으로 Mo 및 W만 남아 있음을 고려할 때, 이들 원소에 대한 지구미생물학적 연구가 필요하다.
W는 주기율표에서 Cr, Mo와 함께 6족에 속한다. 고밀도, 가장 높은 녹는점(3,410°C), 강한 내식성을 지니므로 다른 금속이나 탄소와 결합할 경우 경도, 내구성, 내식성을 증가시킨다. 또한 양호한 전기전도도 및 열전도도, 낮은 열팽창률 등의 특징으로 인해 특수강 및 초경합금 원료, 연마재, 필라멘트, 전극, 페인트, X선 튜브, 공업용 촉매 등 많은 제품의 중요한 성분으로 이용되고 있다(Werner et al., 1998). 과거 군사용으로 많이 사용되었으나 전쟁이 거의 없는 최근에는 철강산업에 주로 이용이 되고 있으므로, 철강경기와 밀접한 관계를 보이며 그 수요가 변화한다. 전 세계적으로 W는 매년 61,000톤이 생산되고 있으며, 이 중 33,000톤이 금속산업 및 화학산업에 이용되고 있다(Shedd, 2015). W는 지리적으로 넓게 분포하지만 세계 W 매장량 1위인 중국의 생산과 수출에 의해 W의 공급이 좌우된다(Shedd, 2011, 2015). W의 주된 광석은 회중석(CaWO4)과 철망간중석((Fe,Mn)WO4)이며 이외에도 Sn, Mo, Cu, Pb, Zn, Bi 등 다른 금속을 채굴할 때 부산물로 회수되기도 한다(Werner, 1998).
W는 지각 내 존재하는 원소 중 54번째로 많은 원소로서(Krauskopf, 1972), 지각 내 평균 농도는 1.3 mg/kg, 암석권 내 평균 함량은 0.2~2.4 mg/kg이다(Koutsospyros et al., 2006; Senesi et al., 1988; Strigul et al., 2005). 토양 내 존재하는 W의 농도 조사는 매우 국지적 규모로만 진행되었다. 유럽연합(EU)은 토양 내 W 농도가 0.5~8.3 mg/kg, 표토 내 농도는 0.7~2.7 mg/kg라고 보고한 바 있다(Senesi et al., 1988, 1999). 뉴질랜드, 호주, 미국 등 일부 지역의 토양에서 높은 농도의 W가 보고된 적도 있으나, 이는 광산활동에 의한 오염이나 군부대 지역 오염 등에 의한 것이다(Senesi et al., 1988, 1999).
생태계 내 W의 자연기원 오염은 자연적으로 생성된 W 광물이 용해됨에 따라 발생하며(Strigul, 2010), 인위적인 오염은 광산활동, 산업활동, 군사시설 운영 등 인간활동에 의해 발생한다(Koutsospyros et al., 2006). 최근 Pb로 만들던 탄알을 W로 만드는 경우가 있는데 이는 W가 유해원소인 Pb보다 무독성이고 친환경적인 물질이기 때문이다(Brewer et al., 2003; De Francisco et al., 2003). 그러나 W의 환경학적 생태독성 연구는 정밀하게 수행된 바 없으며, 특히 W의 잠재적인 환경 영향 조사는 반드시 필요하다. 일부 연구에 따르면 W 화합물은 사람과 동식물에게 생물학적 악영향을 미칠 수 있으며, W의 독성은 W 화합물의 화학적 형태 및 노출 경로에 따른다(Adamakis et al., 2012; Lagarde and Leroy, 2002; Strigul, 2010; Strigul et al., 2005, 2010). Koutsospyros et al.(2006)은 미국 네바다 주의 Fallon에 거주하는 많은 주민들이 백혈병에 걸린 원인이 식수 등에 다량 함유된 W에 기인하였을 가능성이 있는 것으로 예측한 바 있다. 현재까지는 백혈병 발병과 관련한 W의 직접적 영향이 밝혀진 것은 아니나 W 이외의 다른 원인 또한 찾지 못하였으므로 백혈병의 발병에 직 · 간접적으로 W가 영향을 미쳤을 것으로 예측하였다.
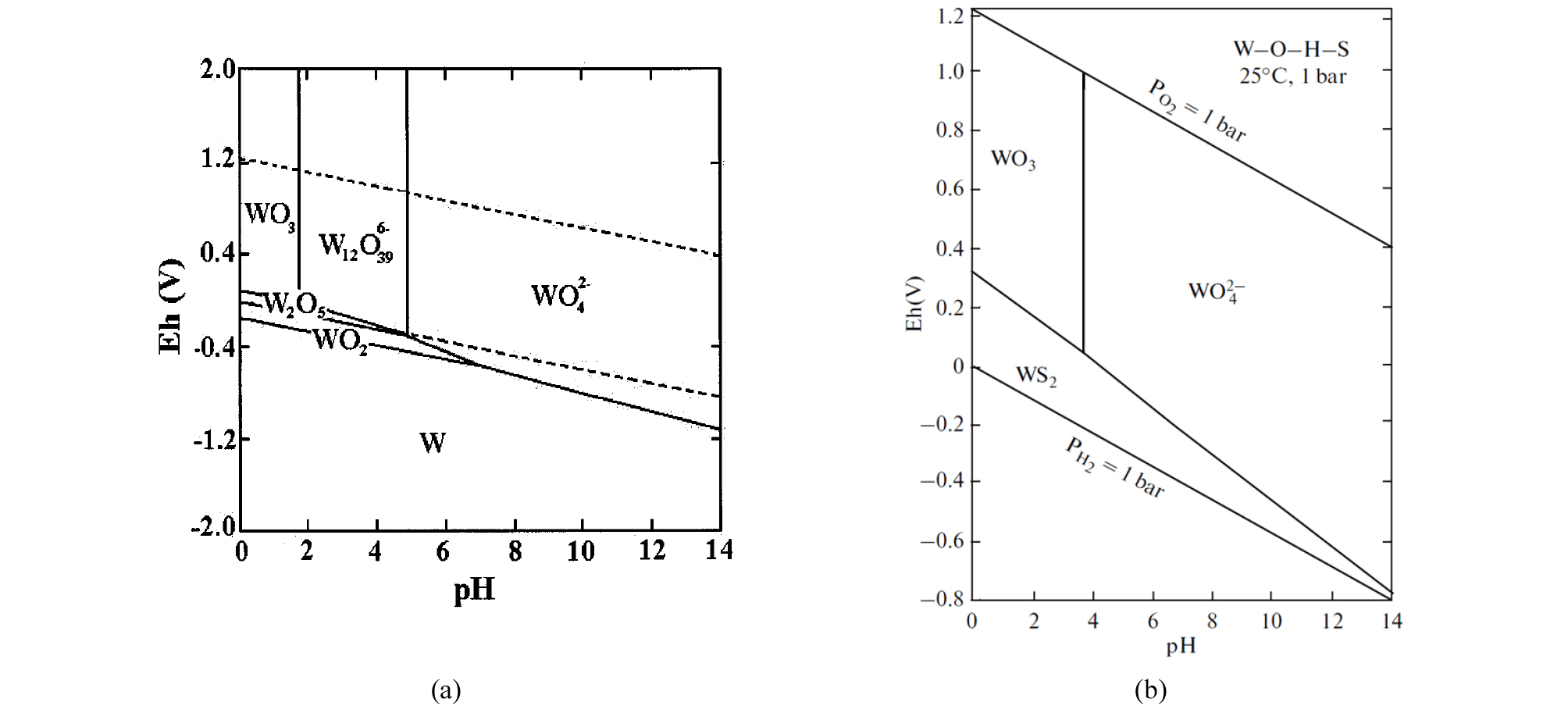
지각 내 존재하는 W 이온은 주로 +6가와 +4가의 두 개의 산화수를 지니며, +6가의 경우 WO42-, WO3, +4가의 경우 WO2, WS2를 주로 형성한다(Fig. 1; Anik and Osseo-Asare, 2002; Ryzhenko, 2010). 이들 산화수 이외에도 +5, +3, +2, -2가 등 다양한 산화수의 W가 존재하지만, 이들은 주로 화합물로 존재한다. 따라서 자연 환경에서 용존 상태의 W 이온은 +6가의 산화수를 지니며 대부분 WO42-로 존재한다고 할 수 있다. 용존 상태로 이동하는 WO42-가 환원되어 WO2 또는 WS2로 변하면 침전하게 되므로 산화환원전위 변화는 W의 이동도에 지대한 영향을 미칠 것이다.
미생물이 As, Cr, Sb 등의 환원에 영향을 미치며 결과적으로 이들 원소의 지구화학적 환경 내 이동도를 조절할 수 있다는 최근의 많은 연구결과가 W 거동에도 동일하게 적용되는지의 여부는 매우 흥미로운 연구 주제이다. 아직 국제적으로도 W 거동에 미치는 미생물의 영향은 전혀 연구된 바 없다. 이 연구의 목표는 W의 산화수를 변화시키는 미생물을 분리하여 W의 이동도에 미치는 영향을 규명하며, 궁극적으로 자연적인 지질매체 내에서의 W의 순환 기제 예측에 그간 알려지지 않았던 정보를 제공하는 것이다.
실험방법
시료채취 및 특성 조사
일반 비오염 지역보다 W가 부화된 지질학적 매질에 W 거동에 영향을 미치는 미생물이 존재할 확률이 높으므로 국내 W 광산 주변 지역의 토양, 퇴적물, 자연수 시료를 채취하여 토착 미생물을 분리하였다. 우리나라의 W 광상 대부분은 하나의 광상에서 Mo와 W가 함께 산출되며, 광석광물의 함량비에 따라 Mo 광상 및 W 광상으로 나뉜다.
조사 지역은 충북 제천시 소재 대화광산과 금성광산, 충남 청양군 소재 청양광산으로서, 대화광산에서 토양, 갱내 퇴적물, 갱내 배수, 지표수, 지하수, 금성광산에서 토양, 하천 퇴적물, 지표수, 광산배수, 청양광산에서 토양시료를 각각 채취하였다. 대화광산은 화강암류와 편마암에 발달한 열수광상이며 철망간중석((Fe,Mn)WO4), 회중석(CaWO4), 휘수연석(MoS2)을 채광하였다. 금성광산은 현재 가행 중이며, 돌로마이트와 석회암에 발달한 접촉교대형 광상으로서 휘수연석, 회중석, 방연석(PbS), 섬아연석(ZnS)이 산출된다. 청양광산은 화강암류와 편마암에 발달한 열극충진형 광상으로서 철망간중석, 휘수연석이 산출되었다(Lee et al., 2007).
토양은 표토와 심토의 구별 없이 30 cm 심도보다 깊게 채취하여 혼합시료로 하였으며, 금성광산 토양의 경우만 15~20 cm 기준으로 포토와 심토로 나누어 채취하였다. 토양 및 퇴적물의 물리화학적 특성 분석을 위한 시료는 35°C에서 96 시간 건조한 후 10 mesh(<2 mm) 이하의 시료를 이용하여 pH 및 작열감량(LOI; loss-on-ignition) 측정, 80 mesh(<0.18 mm) 이하의 시료는 왕수 분해한 후 원소 정량에 사용하였다. 원소 분석은 SPECTRO사의 ICP-OES(SPECTRO GENESIS)를 사용하였다. 한편 토착 미생물을 분리하기 위하여 시료 일부는 건조하지 않은 상태에서 4°C 이하로 보관하였다.
토착 미생물 분리 및 동정
건조되지 않은 토양 및 퇴적물 10 g을 멸균된 5 mM HEPES 용액 300 mL과 함께 세럼병(serum bottle)에 담고 혐기환경을 조성하기 위해 질소(N2)로 30분간 purging하였다. 1 시간 동안 120 rpm에서 진탕한 뒤 침강한 후 상등액 20 mL을 토착 미생물의 접종물(inoculum)로 하여 CDM(chemically defined medium) 배양액 250 mL에 주입하였다. 이후 CDM 배양액의 상등액 20 mL을 새로운 CDM 배양액에 접종한 뒤 약 5일 이후 계대배양을 실시하였으며 이를 4회 증균배양(enrichment culture)하였다. 이때 각 CDM 배양액에는 포도당 10 g/L 및 W(VI) 1,000 mg/L(Na2WO4‧2H2O로서)를 함께 포함하였다. CDM 배양액의 조성은 다음과 같다; 효모추출물(yeast extract) 0.5 g/L, (NH4)2SO4 3.0 g/L, MgSO4·7H2O 0.5 g/L, Na2HPO4 0.5 g/L, NaCl 0.5 g/L.
이후 CDM 배양액으로부터 technical agar(Difco 사)를 이용하여 제조한 고체 CDM 배지에 도말하였으며, 2주 후 발생한 집락(colony)을 크기, 색상, 모양으로 구분하여 분리한 후 각각 계대배양을 수 회 실시함으로써 단일종을 얻었다. 각 집락은 대전광역시 마크로젠 미생물분석센터에 의뢰하여 16S rRNA 유전자 서열분석기법으로 동정(identification)하였다.
W 거동에 미치는 미생물 영향
1,000 mg/L의 W(VI) 및 10 g/L의 포도당이 포함된 250 mL의 CDM 배양액에 분리한 각 토착 미생물을 접종한 후 혐기적 조건에서 3주간 배양을 하였다. 혐기환경 조성을 위해 미생물 주입 후 90분간 질소 가스로 purging하여 산소를 제거하였다. 3주 후 용액을 채취하여 총 용존 W 함량을 분석하였다.
이후 용존 W 함량의 변화가 가장 큰 두 종의 미생물을 선택하여 동일한 조성의 배양액에 각각 접종한 후 약 5일간 반응시키며 주기적으로 용액 시료를 채취하여 pH, 총 용존 W 함량, W(VI) 함량, 미생물 개체수 확인 등을 실시하였다(Table 1). 초기 pH는 모두 7로 조정하였다. W(VI) 이온은 Tomiyasu and Yonehara(1996)가 제안한 방법을 이용하였으며, 이 방법은 산성의 용액 조건에서 Fe(II), 클로르프로마진(chlorpromazine), 과산화수소의 반응을 통해 생성되는 붉은 빛을 UV-vis spectrometer(Shimadzu 사, UV-MINI-1240)를 이용하여 525 nm에서 측정하는 방법이다. 이때 용액에 포함된 W(VI)의 농도가 증가함에 따라 붉은 빛의 형성이 방해를 받기 때문에 이를 이용하여 W(VI)의 농도를 정량할 수 있다. 총 W 이온은 ICP-OES(SPECTRO GENESIS)를 이용하여 분석하였으며, W(IV)는 총 W 함량에서 W(VI)를 뺀 값으로 하였다. 박테리아 개체수 확인은 평판계수법으로 수행하였으며, 평판계수법에서 이용한 고체배지는 용액상의 CDM 배지에 technical agar를 추가하여 제조하였다. 평판계수법은 10-1부터 10-7까지 진행하였다. 모든 실험은 삼중복(triplicate) 실험으로 진행하였다.
Table 1. Experimental design for bacterial redox alteration of dissolved W(VI)
| Set | Bacteria | W(VI) (1,000 mg/L) |
| A | Abiotic sample | ○ |
| B | DS2 (Klebsiella sp. PAMU-1.2) | ○ |
| C | X | |
| D | KSS3 (Uncultured Pantoea sp.) | ○ |
| E | X |
결과 및 토의
토양 시료의 물리화학적 특성
대화, 금성, 청양광산 주변에서 채취한 토양, 퇴적물, 자연수의 물리화학적 특성은 Table 2와 같다. 토양 및 퇴적물의 평균 pH는 6.9, 자연수의 평균 pH는 7.0으로서 중성이다. 금성광산의 모암은 석회암질 암석이며 모든 광산의 주 광석이 회중석, 철망간중석 등 산화광물로서 황화물 함량이 적기 때문에 산성 특징을 나타내지 않는 것으로 보인다.
Table 2. Physicochemical characteristics of the samples from the studied mine areas (units: mg/kg). nd: not determined
각 광산에서 채취한 토양과 퇴적물 시료에서 높은 농도의 W가 존재하는 것을 확인하였다(Table 2). 대화광산에서는 110~113 mg/kg, 금성광산에서는 64~75 mg/kg, 청양광산에서는 74~121 mg/kg의 W가 검출되어 일반적인 표토 평균 1.2 mg/kg(Alloway, 2013)에 비해 매우 높은 함량을 보였다. 한편 물 시료에서는 W가 모두 검출한계 이하로 나타났으나, 대부분의 지표수 및 갱내수에서는 이 광산들에서 함께 산출되는 Mo가 검출되었다.
토착 미생물 분리 및 동정
1,000 mg/L의 높은 함량의 W가 포함된 배양액을 이용하여 총 18종의 토착 미생물을 분리하였다. 주어진 조성의 배양액 조건에서는 모든 물 시료 및 청양광산의 토양으로부터 토착 미생물을 분리할 수 없었으며, 대화광산의 갱내 퇴적물에서는 5종의 미생물을 분리하였으나 동정에 실패하였다. 나머지 13종 미생물의 16s rRNA 유전자 서열분석을 수행하여 Table 3와 같이 동정하였다. 대화광산 시료에서는 Klebsiella 속, 금성광산에서는 Enterobacter 속이 주로 분리되었다.
Table 3. Identification of indigenous bacteria tolerable against 1,000 mg/L of W.
분리한 미생물 중 Klebsiella 속은 혐기환경에서 Fe3+를 환원하며 생장한다는 보고가 있으며(Baldi et al., 2001), Mo6+를 Mo-blue로 환원한 사례도 있다(Halmi et al., 2013). Enterobacter cloacae는 통성(facultative) 혐기성균으로서 고농도의 중금속 오염 토양에서 분리된 적이 있으며(Banerjee et al., 2015), 카드뮴 내성 박테리아로 보고된 바도 있다(Haq et al., 1999).
W 거동에 미치는 미생물 영향
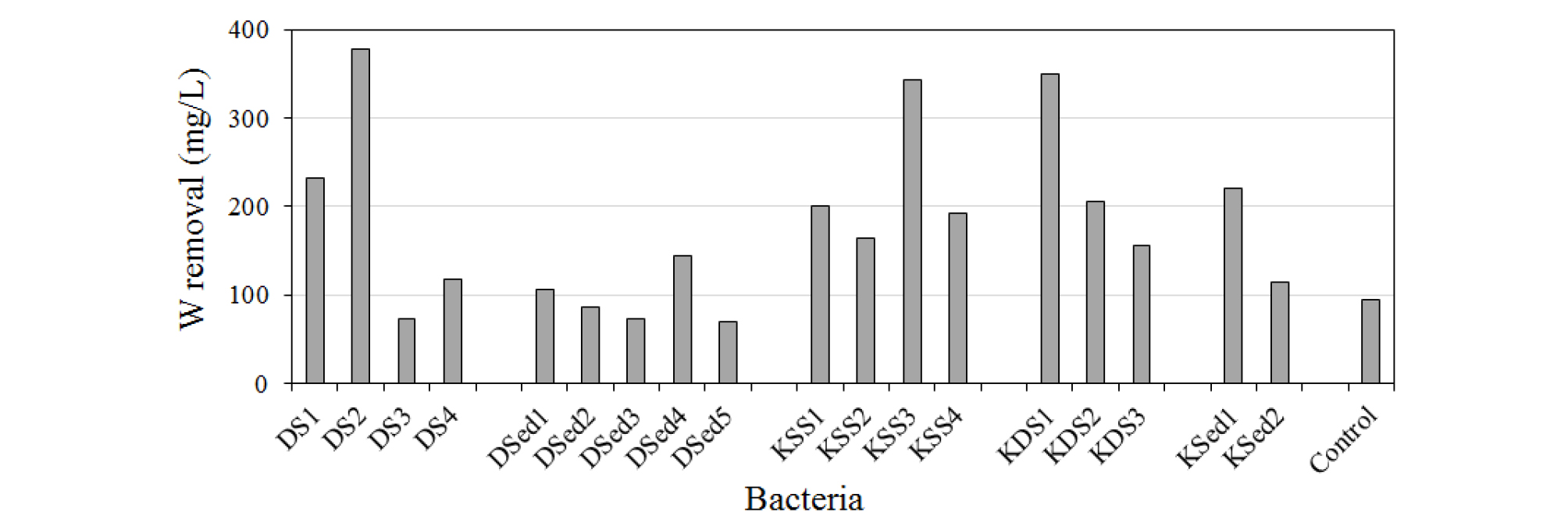
연구 지역 토양 및 퇴적물로부터 분리한 미생물이 용존 W 거동에 미치는 영향을 확인하기 위하여 1,000 mg/L의 W가 함유된 CDM 배양액에 각 미생물을 접종한 후 3주간 혐기성 조건에서 배양하였다. 3주 경과 후 총 용존 W 함량 분석을 실시한 결과는 Fig. 2와 같다. 미생물을 접종하지 않은 비교시료(control)에서 94 mg/L의 W가 제거된 것과 달리 대화 토양, 금성 표토 및 심토, 금성 퇴적물 중 8종의 미생물 시료(DS1, DS2, KSS1, KSS3, KSS4, KDS1, KDS2, KSed1)에서 192~378 mg/L의 많은 양의 W가 감소하였으며, 이를 제외한 나머지 미생물 시료에서는 감소량이 비교시료와 비슷한 수준이었다.
배양 기간 중 용존 W가 감소한 원인은 주입한 W(VI)(WO42-로서)가 혐기성 조건 유지에 의하여 W(IV)(WO2 등으로서)로 환원되어 침전하였기 때문으로 판단한다(WS2로서 침전할 가능성을 배제한 이유는 아래에 기술함). 미생물을 주입하지 않은 비교시료에서도 약 100 mg/L 내외의 W가 감소한 것이 이러한 화학적인 환원성 침전을 나타낸다고 할 수 있다. 따라서 비교시료에 비하여 2배 이상의 용존 W 감소를 유도한 위 8종의 미생물은 환원성 침전 속도를 한층 촉진한 것이다. 이러한 사실은 배양이 종료된 후 미생물학적 용액 내에 육안으로도 관찰되는 콜로이드 및 침전물이 형성된 사실이 뒷받침한다(Fig. 3). 이는 토양, 퇴적물, 지하수 등의 지질학적 매질 내에서 일부 미생물이 용존 W의 지구화학적 거동에 영향을 미쳐 그 이동도를 감소할 수 있음을 나타내는 것이다. 그간 알려진 Cr, Se, Sb 등의 환원과 침전물 생성 및 이에 따른 이동도 변화를 유도하는 미생물학적 작용이 W에도 적용 가능함을 의미한다.
한편 용존 W가 접종한 미생물 표면에 흡착하여 제거되었을 가능성도 있다. 그러나 용존 상태의 W는 WO42-로서 산화음이온 상태로 존재함을 감안할 때 중성 범위의 pH에서 음전하를 띠는 박테리아 표면에 W가 흡착하였을 가능성은 없다. Park et al.(2010)이 W와 동일하게 용존 시 산화음이온을 형성하는 As와 Cr을 이용한 실험을 수행한 결과, 이 원소들은 미생물 표면에 전혀 흡착하지 않음을 보인 바 있다.
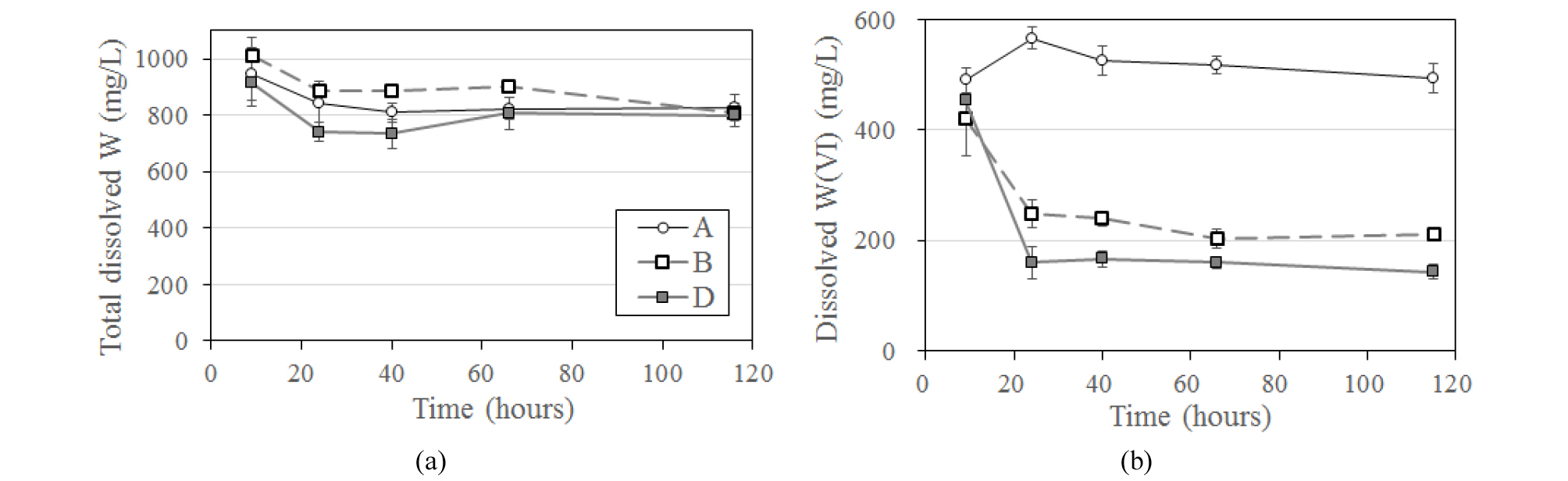
총 18종의 토착 미생물 중 W 감소량이 가장 컸던 DS2(Klebsiella sp. PAMU-1.2)와 KSS3(Uncultured Pantoea sp.)을 이용하여 약 5일간 후속 실험을 진행하였다. 총 용존 W 함량 변화를 관찰한 결과, 초기 주입한 1,000 mg/L이 시간이 경과하며 미생물 시료(B와 D) 및 무생물적 비교시료(A)에서 모두 일부 감소하는 추세를 보였다(Fig. 4(a)). 이는 앞에서 말한 바와 같이 주입한 WO42-가 혐기성 조건에서 WO2 등으로 환원되며 콜로이드를 형성하거나 침전한 것에 기인한 것이다. Fig. 2에서 나타난 것처럼 비교시료와 미생물 시료 간 W 제거량에서 큰 차이를 보이지 않은 것은 반응 기간의 차이(5일과 3주)에 의한 것으로 보인다.
실험 후 콜로이드를 수거하여 XRD 분석을 하였으나 비정질인 관계로 광물 파악은 불가능하였다. 주어진 조건에서 형성 가능한 화합물은 WO2 및 WS2 등이 가능하나 WS2는 아닌 것으로 판단하였다. CDM에 포함되어 있는 (NH4)2SO4 및 MgSO4·7H2O의 SO42-가 환원되어 S를 공급할 수 있으나, 접종한 미생물들이 황산이온을 환원한다고 보고된 바 없고, 실험 초기와 종료 후 SO42- 함량을 측정한 결과 A~E의 모든 조건에서 전혀 변화가 없었다(자료 미기재).
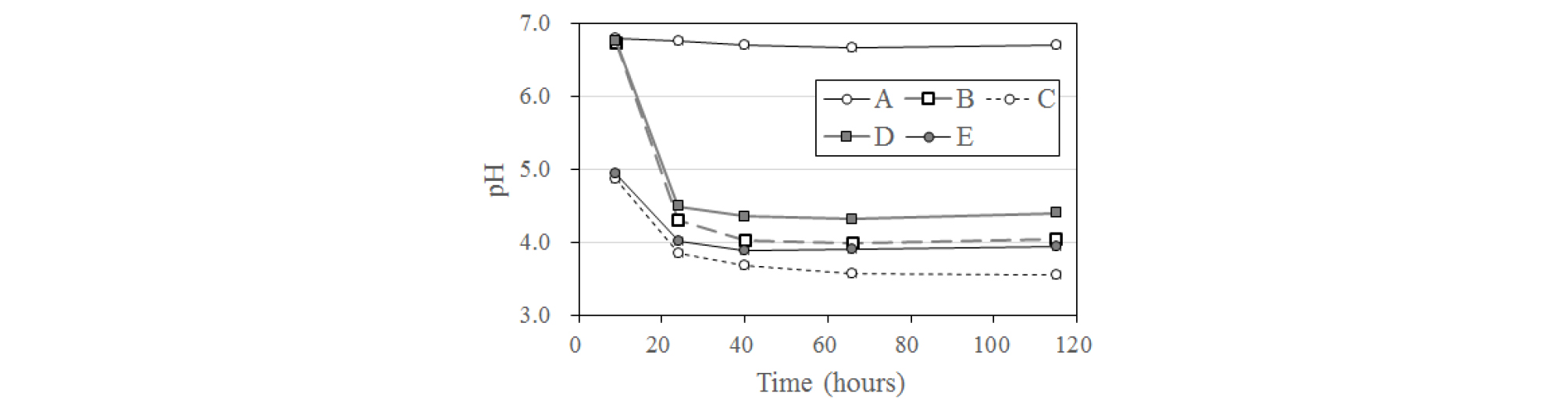
비교시료와 미생물 시료에서 나타난 용존 W(VI) 함량 변화를 Fig. 4(b)에 나타내었다. 1,000 mg/L의 W(VI)를 주입하였음에도 불구하고 반응 초기의 W(VI) 농도가 절반 정도로 감소한 것은 DS2와 KSS3 미생물을 접종하기 전 실시한 고압멸균(autoclave) 및 N2 가스 purging 등의 물리화학적 영향에 의해 WO42- 이온의 화학적 변화가 발생했기 때문으로 예상된다. 총 용존 W 함량과는 달리 용존 W(VI) 함량은 비교시료와 미생물 시료 간에 확연한 차이를 보였다(Fig. 4(b)). 즉 비교시료 A는 반응 기간 동안 W(VI) 함량 변화가 없는 반면, 미생물을 접종한 B와 D 시료에서는 시간에 따라 W(VI) 함량이 크게 감소하였다.
동일한 조건 하에서 무생물적 비교시료와 달리 미생물을 접종한 시료에서만 용존 W(VI)가 환원되어 감소하였다는 것은 명확히 미생물 작용에 의한 결과이다. 이는 자연 상태에서 미생물이 W의 산화환원 상태를 변화시켜 궁극적으로 W의 지구화학적 거동에 영향을 미칠 가능성이 있음을 나타내는 의미있는 결과이다.
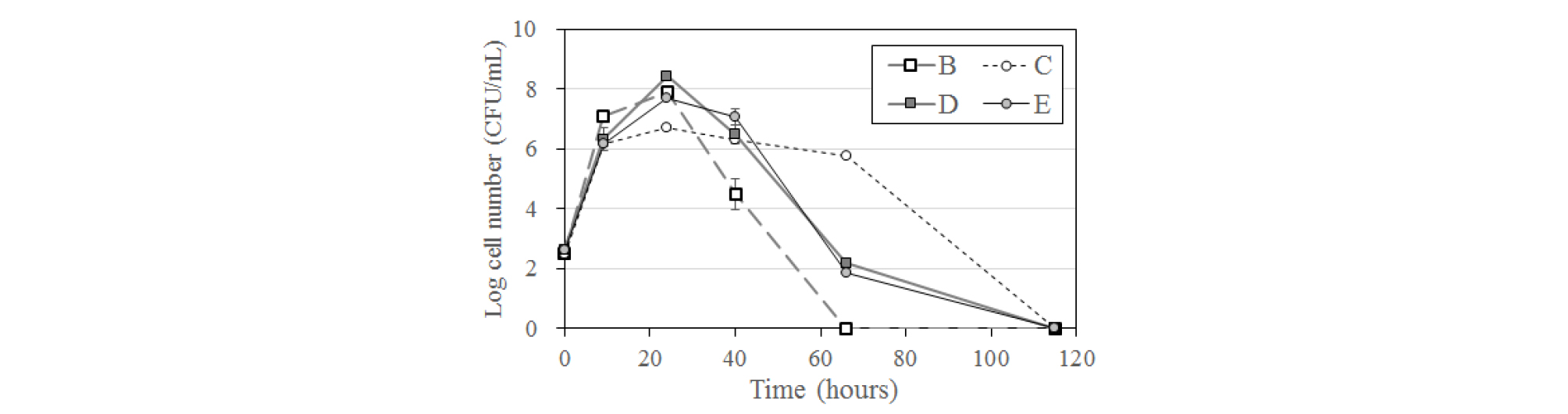
무생물적 조건에 비해 미생물이 W(VI)의 환원을 촉진한 기제로 다음 세 가지의 가능성을 들 수 있다. 첫째는 미생물에 의한 이화적(dissimilatory) W 환원이다. 이는 접종 미생물이 포도당을 전자공여체로, W(VI)를 전자수용체로 사용하는 호흡(respiration)을 하며 그 과정에서 ATP를 얻어 성장하는 것으로서, 이 과정에서 W(VI)는 전자를 획득하여 W(IV)로 환원되게 된다. 아직 국제적으로 이화적 W(VI) 환원균은 보고된 바 없다. 이를 확인하기 위하여 배양 기간 동안 시료를 채취하여 미생물 집락수 변화를 살펴본 결과, 미생물과 W(VI)를 주입한 B와 D 시료, W(VI)를 주입하지 않은 C와 E 시료의 모든 시료에서 박테리아 성장이 모두 나타나는 것을 확인할 수 있었다(Fig. 5). 특히 B와 D 시료는 용액 내 W(VI)이 대폭 감소한 24시간 경과시 최대치의 미생물 집락수를 나타내어 미생물 성장과 W(VI) 환원 간에 관계가 있는 것처럼 보인다.
그러나 Fig. 5에서 보듯이 W(VI)를 주입하지 않은 C와 E 시료에서도 미생물의 지수성장이 매우 유사한 패턴으로 나타난 사실은 이들 미생물이 호흡을 위해 W(VI)를 전자수용체로 사용하며 성장한 것이 아닐 가능성을 높여준다. W(VI)가 아닌 다른 이온, 예를 들면 배양액 내의 SO4을 전자수용체로 이용하였을 가능성도 있으나 앞에서 말하였듯이 배양 전후에 SO4의 함량은 변화가 없었다.
두 번째 가능성은 W 독성을 감소하려는 대사작용 결과로서의 W(VI) 환원이다. 즉 용존 상태의 W(VI)를 W(IV)로 환원하여 고체상으로 침전함으로써 흡수를 방지하는 기제이다. 이러한 해독성(detoxifying) W 환원의 가능성은 W(VI)를 주입하지 않은 시료(C와 E)에 비하여 W(VI)를 주입한 시료(B와 D)에서 미생물 최대 집락수(24시간 경과시)가 적고 특히 Klebsiella sp. PAMU-1.2의 경우(B와 C) 소멸기가 빠르게 진행된 것에서 나타난다(Fig. 5). 그러나 Klebsiella sp. PAMU-1.2의 경우에도 최대 집락수 차이가 10배 정도로 작을 뿐만 아니라 미생물에 대한 W 독성이 조사되지 않아 이 기제가 W(VI) 환원을 설명하기에는 설득력이 다소 부족하다.
세 번째 가능성은 미생물에 의한 발효(fermentation)의 효과이다. 미생물을 접종하지 않은 비교시료(A)의 pH는 평균 6.7 내외에서 변화가 없었던 것에 반해 미생물 시료(B~D)는 24 시간 경과 후부터 약 3.6~4.5 내외로 감소하였다(Fig. 6). 주입한 미생물인 Klebsiella와 Pantoae는 연구 지역에서 많이 분리된 Enterobacter와 함께 모두 Enterobacreiaceae 과에 속하며 이 중 Klebsiella와 Enterobacter는 부탄디올(butanediol) 발효를 하여 유기산과 CO2를 발생시키는 것으로 보고된 바 있다(Müller, 2001). 이들 발효 산물은 용액 내의 pH를 낮추며, Fig. 1에서 보듯이 동일한 환원조건에서 산성으로 이동할수록 WO2 및 WS2 등의 W(IV) 침전물이 열역학적으로 안정한 영역을 차지하므로 W(VI) 환원이 발생할 수 있다. 이 결과는 미생물에 대한 W 영향에 관계없이 정상적인 미생물 대사작용 결과 주위의 pH 등 지구화학적 환경을 변화시키며 그 결과 금속의 거동에 영향을 미치는 한 예라 할 수 있다.
결론
W로 부화된 토양 및 퇴적물에서 토착 미생물을 분리하여 이들이 용존 W(VI)에 미치는 영향을 조사하였다. 미생물을 접종하지 않은 비교시료에 비하여 주입한 미생물은 W(VI)가 W(IV)로 환원되는 속도를 촉진하였다. 환원된 W(IV)은 시간이 경과하며 WO2 등의 침전물을 형성하며 용액으로부터 제거되었다. 미생물에 의한 W(VI) 환원은 주로 포도당 발효에 의한 용액의 pH 감소에 기인한 것으로 보이며 일부 미생물은 W의 해독성 환원기제에 의하여 W의 이동성을 감소할 가능성도 나타났다.
그간 자연 상태에서 두 개 이상의 산화수를 갖는 원소 및 화합물에 대한 지구미생물학적 연구는 지질 매체 내에서 미생물이 이들 원소의 거동에 지대한 영향을 미침을 밝히고 있다. 이는 금속의 지구화학적 순환 기제 규명에 있어 미생물학적 영향이 필수적으로 고려되어야 함을 나타낸다. 또한 이러한 연구 결과는 이들 독성 금속으로 오염된 지역에 대한 새로운 미생물학적 처리방법을 정립하는데 매우 중요한 정보를 제공하게 될 것이다. 우리가 아는 바로는 이 연구 결과는 미생물-W 상호작용에 관한 최초의 지구미생물학적 보고이다.