서론
톰슨로이터사가 2018년 발행한 ‘GFMS Gold survey 2018’에 따르면 2017년 보석류로 2214톤, 산업용(전자 및 치과 등)으로 380톤, 정부구매로 366톤, 골드바나 동전으로 1028톤의 금이 소비되었다(O’Connell et al., 2018). 특히 산업용으로 사용된 금 중 277톤은 전기전자분야에서 사용되었으며, 이는 전기전도도가 높은 금의 특성이 반영된 것으로 생각된다(O’Connell et al., 2018). 한국지질자원연구원이 발간한 ‘광산물 수급분석 2017/2018’에 따르면 국내광산에서 생산된 금의 양은 287 kg에 불과하며(KIGAM, 2018), 대부분은 수입에 의존하고 있는 상황이다. 2017년 세계 금의 생산량은 광산에서 3,247톤 그리고 스크랩(재활용)에서 1210톤이며(O’Connell et al., 2018), 금의 안정적 공급을 위한 재활용 공정개발이 매우 중요하다.
금은 구리, 아연, 납 등의 황화물을 제련하는 건식제련공정에서 부산물로 생성되기도 하나, 광산에서는 주로 습식제련공정으로 처리되고 있다. 시안을 사용하는 청화법은 1867년 첫 특허가 미국에서 등록되고, 1889년 뉴질랜드의 크라운광산(Crown Mine)에서 상용화된 이후 가장 널리 이용되는 습식제련공정이다(Marsden and House, 2006). 다만 시안이 독성을 나타내기 때문에 대안 침출제가 연구되어 왔으며, 이 중 염화물에 의한 침출공정도 연구개발되어 왔다(Aylmore, 2005). 염화물 침출에서 주로 사용되는 염소가스나 차아염소산은 전기적으로 생성시키고 금의 침출반응 후 재생하여 이용하는 순환공정이 가능하므로 경제성 및 환경성이 우수하다(Kim et al., 2010). 이와 같은 염소가스나 차아염소산은 매우 강한 산화력을 나타내기 때문에 금 이외의 금속성분도 함께 용해될 수 있어 분리정제공정이 필수적이다.
한편, 이러한 침출액으로부터 금을 분리․정제하는 공정에서는 활성탄 및 이온교환수지를 이용한 흡착법, 용매추출법 등의 다양한 방법이 개발되어 왔다(Lu, 2008; McDougall et al., 1980; Nguyen et al., 2010). 가장 많이 사용되는 활성탄 흡착법의 경우 흡착 후 고액분리 과정에서 침출액에 포함된 광물 등 원료입자들에 의해 체(sieve) 또는 스크린이 막히는 체 막힘 현상이 발생하기 때문에 지속적인 관리가 필요하다는 문제점이 있다(Suzuki et al., 1989).한편, 산화철 기반 흡착제가 다른 산화물 또는 수산화물에 비해 용해된 금속종, 미립자, 유기물과 같은 물질을 효과적으로 분리할 수 있다고 보고되었다(Boyd et al., 1986). 자철석(Fe3O4)은 반도체로 식 (1)과 같이 산화 과정 중 계면에서 전자를 전달하거나 교환할 수 있어 흡착제로 이용될 수 있다(Alorro et al., 2010).
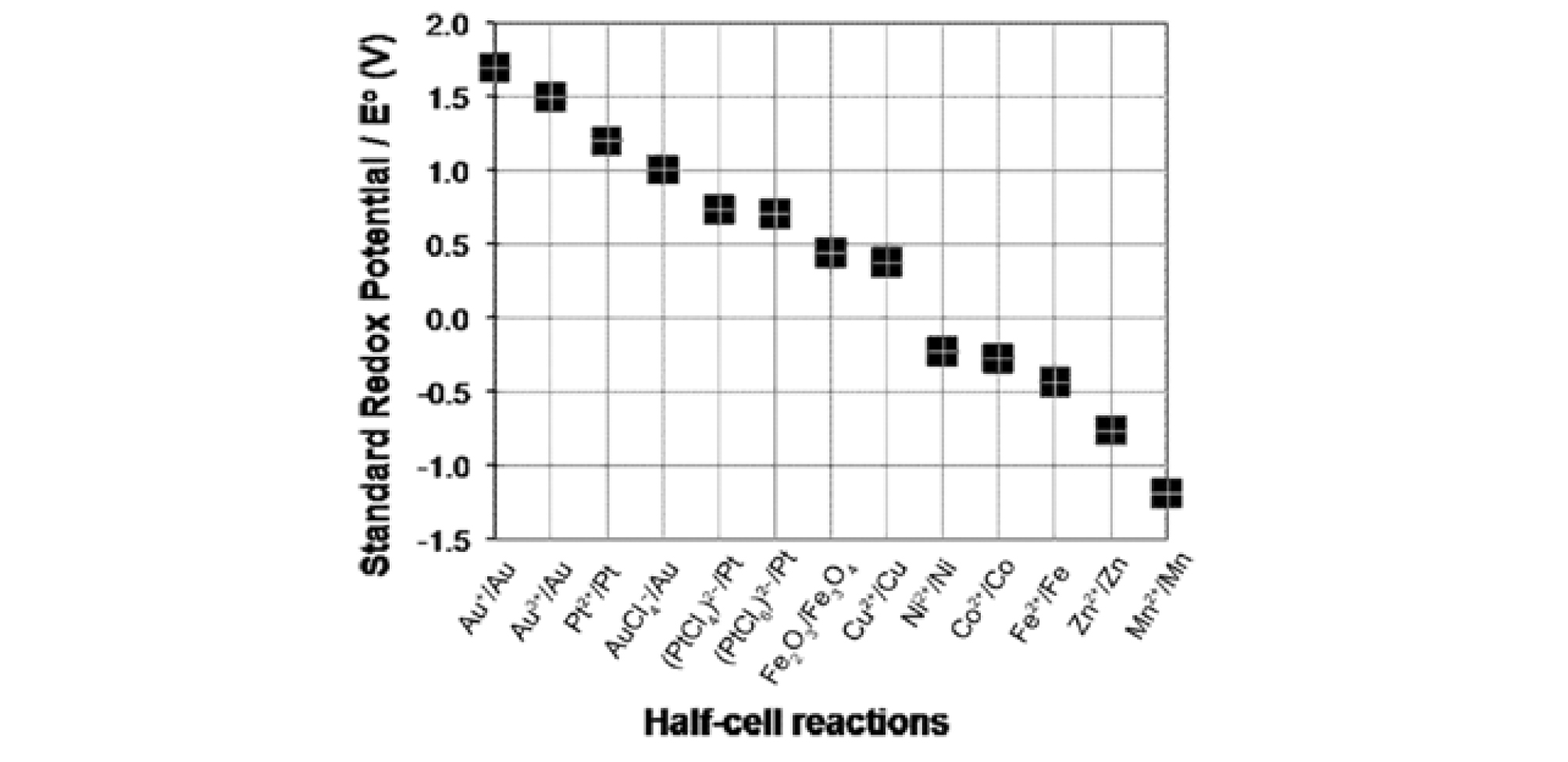
일반적으로 표준환원전위(Standard Reduction Potential, E0) 값이 클수록 환원이 잘 일어나기 때문에 Fig. 1과 같이 자철석보다 표준산화환원전위 값이 큰 금이온이 자철석 표면에 접근하면 식 (1)과 같이 2가 철이 산화되어 전자를 금이온에 전달하고 금이 환원되어 흡착하나 구리나 니켈과 같은 금속이온은 표준산화환원전위가 자철석보다 낮기 때문에 환원흡착이 발생하지 않아 금의 선택적인 흡착이 가능하다. 그리고 자철석은 자성을 나타내기 때문에 금이온의 흡착 후 체질 없이 자력선별공정에 의해 간단히 침출액으로부터 분리가 가능하다는 장점도 있다.
Alorro et al.(2010)은 자철석을 흡착제로 사용하여 pH, 접촉시간, 염화물 농도 영향에 대한 침출액 중 금의 흡착 특성을 조사하여 72시간 만에 100%의 금을 흡착한 바 있다. 그러나 온도, 흡착제 양 등의 조건에 대한 영향은 고려하지 않았는데 이러한 조건은 전자 이동이 수반되는 전기화학적 환원에 의한 흡착의 경우 중요한 변수가 될 수 있다. 그러므로 본 연구에서는 기존에 수행되지 않은 조건들에 대해 폐PCB 침출액을 상정한 모의용액으로부터 자철석에 의한 금의 흡착 거동을 조사하고자 하였다.
실험 방법
염산 0.1 mol/L에 금이 1000 mg/L의 농도로 용해되어 있는 금 표준용액(Kanto Chemical Co., Inc)을 이용해 모사액을 제조하였다. 염산의 농도를 0.01 mol/L, 0.1 mol/L 또는 1 mol/L, 그리고 금의 농도를 80 mg/L 또는 100 mg/L로 조절한 침출모사액을 제조하였으며, 흡착제로는 5 µm 이하의 합성 자철석 시약(Sigma-Aldrich)을 사용하여 침출 모사액 100 ml에 0.3 g - 3.6 g의 자철석을 투입하였다. 용액의 초기 pH는 실험전 염산 또는 수산화나트륨용액을 이용하여 조절하고, 불순물의 영향을 검토할 때는 염화구리(CuCl2․2H2O, Junsei Chemical Co., Ltd, 97.0%)와 염화니켈(NiCl2․6H2O, Junsei Chemical Co., Ltd, 97.0%)을 적정량 첨가하여 용액을 제조하였다. 금 흡착 실험은 침출액의 온도 유지(25°C - 90°C) 및 안정적인 교반(75 rpm과 150 rpm)을 위해 진탕항온수조(Shaking water bath, BS-31, Jeiotech Co.)에서 12시간 동안 진행하였으며, 실험 조건은 Table 1에 정리하여 나타내었다. 금의 흡착 거동을 확인하기 위해 정해진 시간 간격으로 샘플링하여 1M 염산으로 희석 후 ICP-OES(Inductively Coupled Plasma Optical Emission Spectrometer, Optima 8300, Perkin elmer)로 분석한 다음 자철석에 의한 금의 흡착 효율을 식 (2)와 같이 계산하였다. 또한, 남은 용액은 0.45 µm의 nylon membrane filter를 사용하여 고액분리 후 자철석 표면에 흡착된 금의 존재를 확인하기 위하여 FE-SEM(Field Emission Scanning Electron Microscope, MIRA-3, Tescan) 분석을 실시하였다.
Table 1. The parameters and their range in adsorption experiments
| $$\mathrm{Metal}\;\mathrm{adsorption}\;\mathrm{efficiency}\;(\mathrm{μmol}/\mathrm g)=({\mathrm C}_{\mathrm i}–\;{\mathrm C}_{\mathrm f})\times\mathrm V/\mathrm W$$ | (2) |
여기서,
Ci=초기 금속 농도
Cf=종료 후 침출액에 남은 금속 농도
V=침출액 부피
W=자철석의 양
실험결과 및 고찰
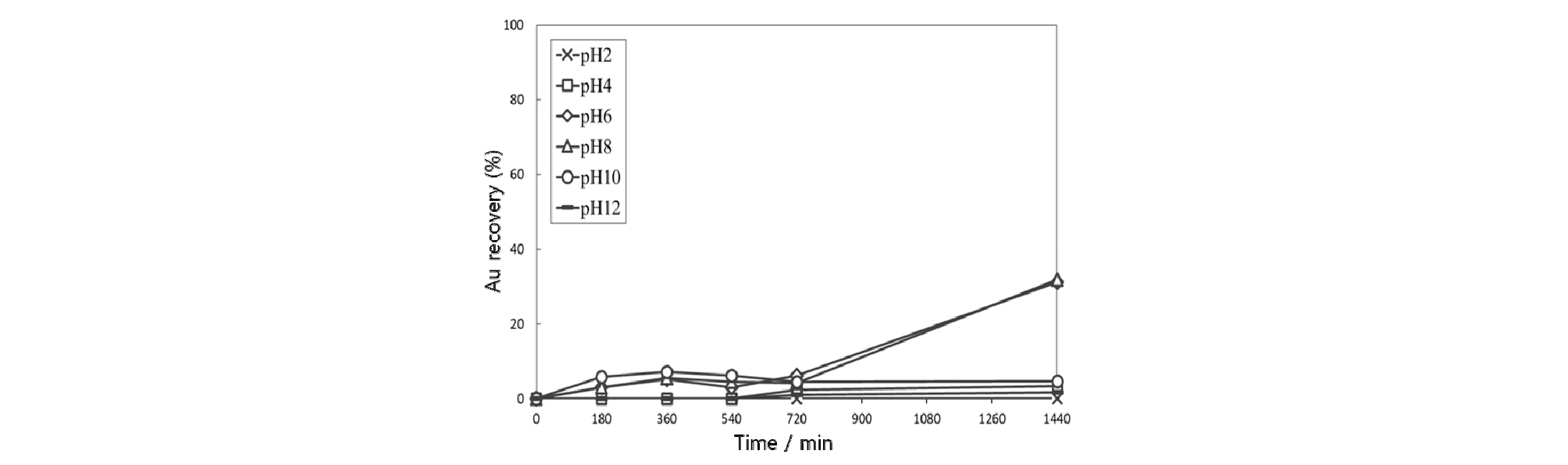
금의 농도 100 mg/L, 염화나트륨 농도 0.1 mol/L, 자철석 투입량 0.3 %, 교반속도 150 rpm, 온도 25°C의 조건에서 초기 pH를 변화시키면서 자철석에 대한 금의 흡착거동을 관찰하였다. 자철석에 대한 금 흡착의 pH 영향 실험결과를 Fig. 2에 나타내었다. 금이온은 pH 2-4 범위에서 4% 미만, pH 6-8 범위에서 31% 흡착되었으나 pH 10-12 범위에서는 거의 흡착되지 않았다. 산성 영역에서는 흡착제인 자철석 입자의 표면이 일부 용해되기 때문에 금의 흡착이 원활히 이루어지지 않은 것으로 생각된다. pH가 높은 경우는 금이온 입자와 자철석 입자의 정전기적 반발력에 기인하였다고 생각된다. 금이온은 염화이온(Cl-)과 용액에서 착이온을 형성하여 AuCl4-의 형태로 존재하고, 자철석의 표면전위를 측정하면 PZC(point of zero charge)가 pH 5-6 정도에서 형성되기 때문에(Erdemoǧlu and Sarikaya, 2006) 알칼리 영역에서 음(-)으로 하전되며, 하전량은 pH가 증가할수록 증가하여 반발력이 증가할 수 있다. 따라서 금이온이 흡착재인 자철석입자에 접근하기 힘든 것이 낮은 흡착율의 원인으로 판단된다. 이후 실험에서는 pH를 금의 흡착률이 가장 좋은 6-8 범위로 고정하였다.
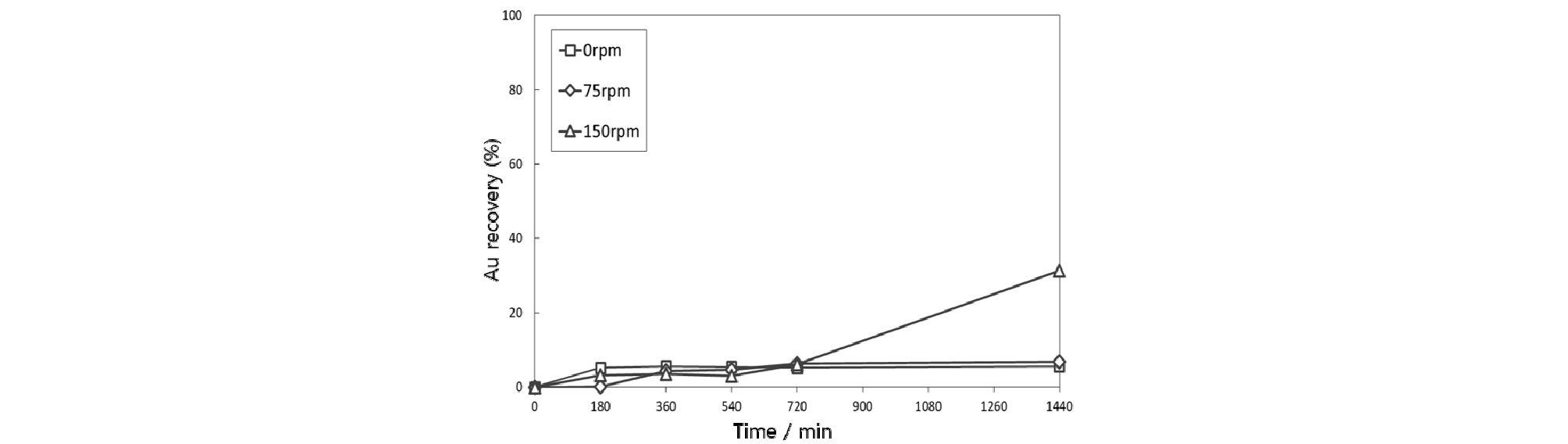
금이온 흡착에 대한 교반속도의 영향을 관찰하기 위하여 금의 농도 100 mg/L, 염화나트륨 농도 0.1 mol/L, pH 6-8, 자철석 투입량 0.3%, 온도 25°C 조건에서 교반속도를 변화시키며 흡착 실험을 수행하였다. 금 흡착에 대한 교반속도의 영향 실험결과를 Fig. 3에 나타내었다. 금의 흡착률은 교반속도가 150 rpm일 때 31%로 가장 높았고 교반을 하지 않았을 때와 75 rpm일 때는 각각 5%, 7%를 나타내었다. 이러한 결과는 일정 교반속도 이상에서 확산 장벽(Diffusion barrier)이 파괴되면서 자철석 표면에서의 전자 전달이 용이해졌기 때문인 것으로 생각된다. 따라서 이후 실험에서는 교반속도를 150 rpm으로 고정하여 금이온 흡착실험을 진행하였다.
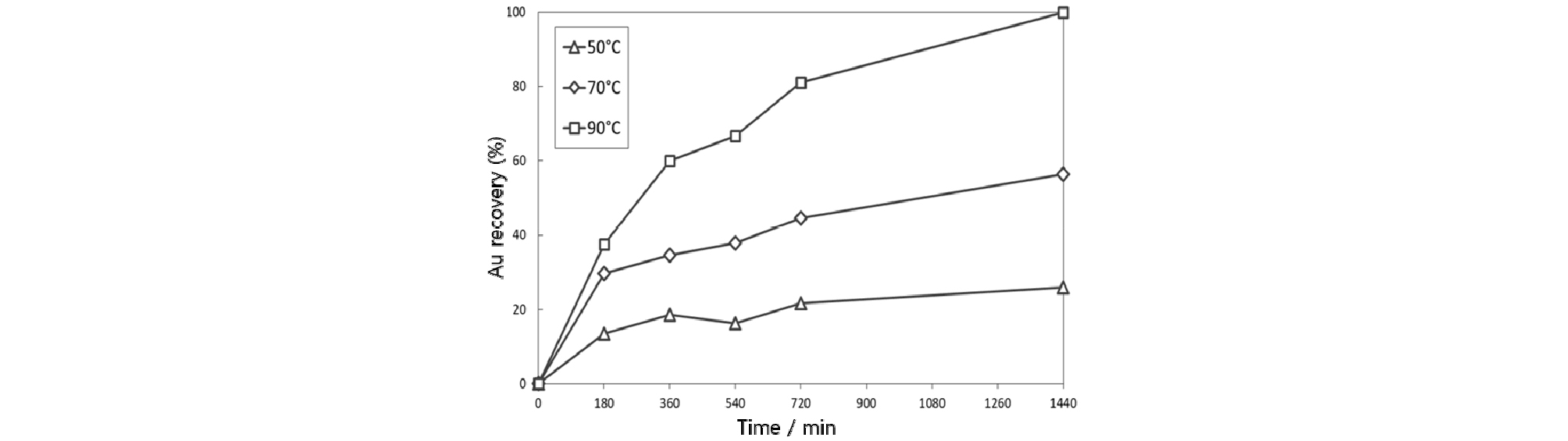
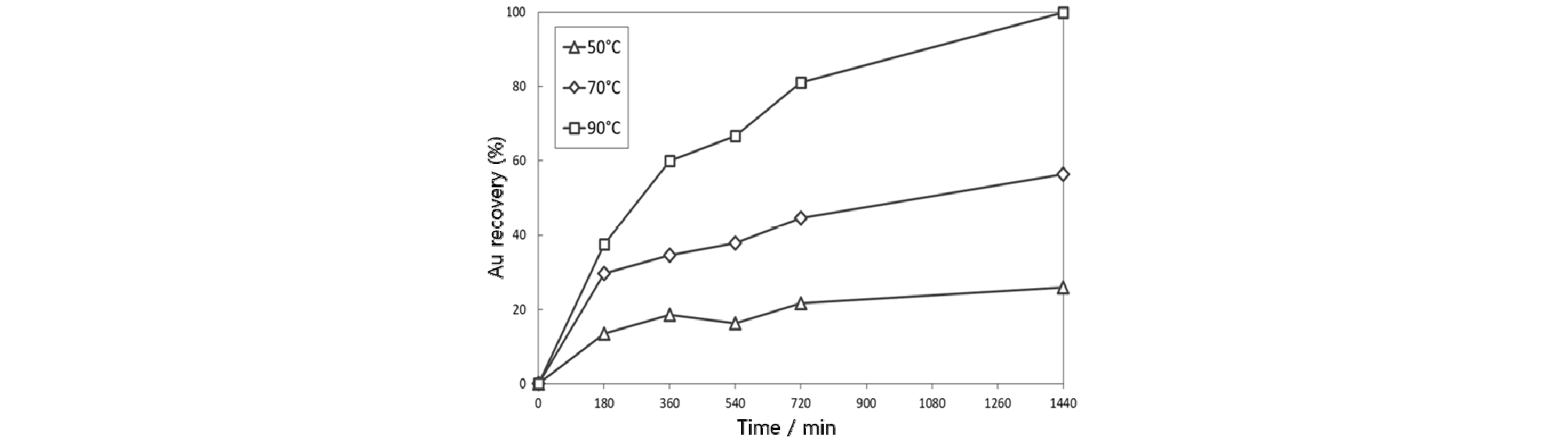
금이온 흠착에 대한 온도의 영향을 조사하기 위하여 금이온 농도 100 mg/L, 염화나트륨 농도 0.1 mol/L, pH 6-8, 자철석 투입량 0.3%, 교반속도 150 rpm의 조건에서 금이온 흡착 실험을 수행하였다. Fig. 4에 온도변화에 따른 실험결과를 나타내었다. 일반적으로 화학 흡착은 흡착 평형에 도달하는데 많은 활성화 에너지를 필요로 하므로 일정 온도 이상에서만 반응이 일어나게 된다. 실험결과 50°C 조건에서 25%, 70°C 조건에서 56%, 그리고 90°C 조건에서 100%의 금이 흡착되는 것을 확인하였다. 자철석을 이용한 금이온의 흡착은, 자철석 내의 2가철이 3가철로 산화되어 발생한 전자를 자철석 표면의 금이온에 전달하여 환원하여 흡착한 것으로, 온도가 증가할수록 전자전달효율이 증가하여 금이온의 흡착량이 증가하였다고 판단된다.
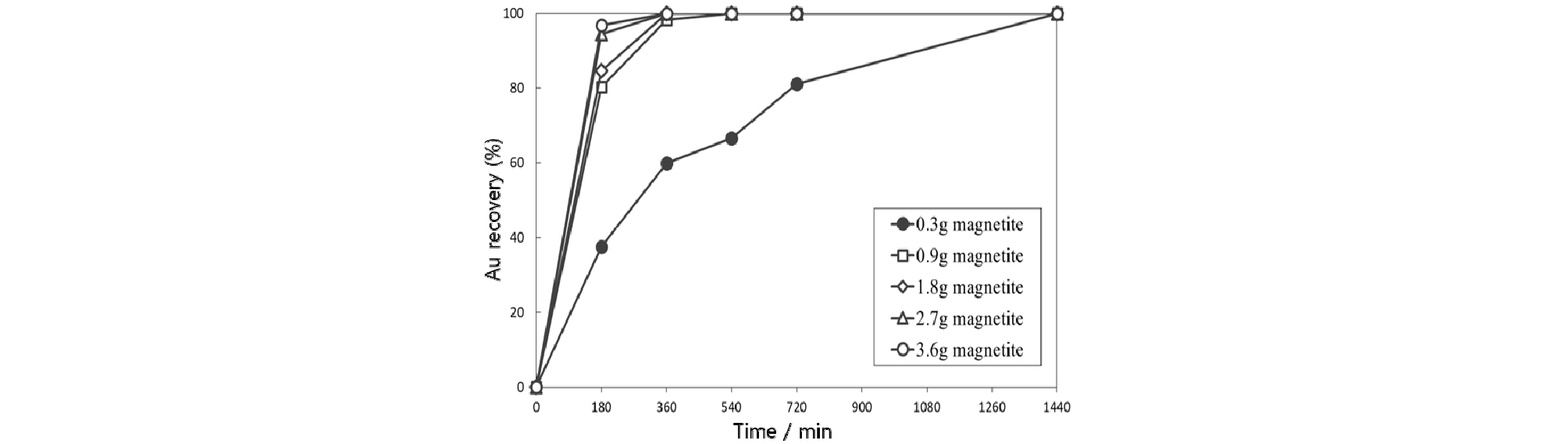
자철석의 투입량은 실제 공정에서 적절한 공정비용을 산출하는데 중요한 요소이다. 금이온농도 100 mg/L, 염화나트륨 농도 0.1 mol/L, pH 6-8, 교반속도 150 rpm, 온도 90°C의 조건에서 투입되는 자철석의 양을 변화시키면서 금이온 흡착 실험을 수행하였고 결과를 Fig. 5에 나타내었다. 자철석을 0.3% 투입했을 때 24시간, 0.9% 투입했을 때 9시간 이내에 금이 100% 흡착되었다. 특히 자철석을 1.8-3.6 % 투입한 경우 3시간 이내에 각각 84%, 94%, 96%, 그리고 6시간 이내에 모두 100%의 금이온이 흡착되었다. 이처럼 투입되는 자철석의 양이 증가할수록 흡착 평형에 도달하는 시간이 빨라져 공정 시간을 크게 단축할 수 있으나 경제성을 고려하여 적절한 변수를 설정해야 할 것으로 생각된다.
마지막으로 금의 선택적 흡착능력을 평가하기 위한 실험을 진행하였다. 염화나트륨 농도 0.1 mol/L, pH 3-4, 교반속도 150 rpm, 온도 90°C의 조건에서 금을 분리하기 위한 흡착 실험을 수행하였고 실험결과를 Fig. 6에 나타내었다. 실험에 사용된 침출 모사액은 Kim et al.(2011), Zalupski and McDowell(2014)과 Kim et al.(2018)이 수행한 연구에서 폐PCB 침출액의 조성을 참고하여 금 80 mg/L, 구리 37580 mg/L, 니켈 3560 mg/L의 농도로 제조하였다. 구리 및 니켈의 침전 방지를 위해 pH 3 이하로 조절해야 하나 앞서 언급하였듯이 자철석은 강산성 용액에서 불안정하여 일부 녹아나오므로 pH 3 이하에서는 실험을 진행할 수 없었다. 그러므로 금속들의 침전을 최대한 억제하기 위해 pH를 3-4 범위로 조절하였으며, 이 범위에서 침전된 입자는 고액분리 후 사용하였다. 고액분리 후 금속들의 농도는 구리 1950 mg/L, 니켈 293 mg/L이며, 금의 침전은 발생하지 않았다. 실험결과 금이 3시간 이내에 96% 흡착된 반면 구리 및 니켈의 흡착은 거의 일어나지 않았으므로 자철석을 이용해 침출액 중 금만을 선택적으로 흡착하여 분리할 수 있음을 확인하였다. 이때 금이 100% 흡착되지 않은 이유는 pH 3-4 사이에서 실험을 진행하였기 때문에 일부 자철석이 녹아 충분히 반응하지 못한 것으로 판단된다. 실험 종료 후 자철석 입자를 건조기를 이용하여 24시간 동안 105°C에서 건조한 후, FE-SEM 및 EDS 분석을 실시하였다. Fig. 7(a)와 (b)에 SEM 사진과 EDS mapping결과를 각각 나타냈다. 이 결과에서 가운데 위치한 입자가 금을 나타내며, 주변의 입자는 자철석이었다. 즉 금이온은 이 결과에서 나타낸 바와 같이 자철석입자에 금이온으로서 흡착한 것이 아니라 환원하여 고체로 성장하며 흡착한 것을 알 수 있다.
결론
본 연구에서는 자철석을 이용하여 금침출모사액으로부터 금을 선택적으로 흡착시켜 분리하는 연구를 진행하였다. 금이온은 pH 중성영역대에서 교반속도, 온도, 자철석투입량이 증가할수록 흡착효율이 증가하는 것을 알 수 있었으며, 금이온 농도 100 mg/L 및 염화나트륨 농도 0.1 mol/L, 자철석 투입량 3.6 %, pH 6-8, 교반속도 150 rpm, 반응온도 90°C 조건에서 실험을 수행한 결과 6시간 이내에 금이 100% 흡착되었다. 또한 금이 구리, 니켈 같은 불순물과 함께 존재할 경우 금은 96% 흡착되었으나 불순물은 거의 흡착되지 않아 자철석으로 금만을 선택적으로 분리할 수 있음을 확인하였다. 흡착 후 금이 흡착된 자철석은 자력선별 공정을 통해 쉽게 분리가 가능하여 체질 공정이 필요 없기 때문에 공정 효율 개선에 많은 도움이 될 것으로 기대된다.