서 론
이론적 계산 방법
결과 및 고찰
기능기 치환에 따른 탈수소화 반응 가역성 평가
탈수소화 반응 가역성이 가장 높은 물질의 탈수소화 반응 경로 분석
열역학적으로 가장 안정적인 기능기(F, NH2) 합성 평가
전자구조 분석을 통한 탈수소화 반응 활성도 예측
결 론
서 론
지구온난화 문제에 의한 환경파괴를 막기위한 노력으로서 에너지 전환 효율 증대, 친환경 에너지원의 확보, 그리고 지구온난화 가스를 효과적으로 줄일 수 있는 방안 등에 대한 연구가 전세계적으로 활발히 진행중이다(Dresselhaus and Thomas, 2001; Olah, 2005; Rabaey and Verstraete, 2005; Forsberg, 2009; Jain, 2009). 특히, 화석연료를 대체하기 위한 주에너지원으로서 수소에너지의 활용이 수소경제 활성화의 주요 사안이다(Johnston et al., 2005; Sartbaeva et al., 2008; Ball and Wietschel, 2009; Schlapbach and Züttel, 2010). 수소경제의 실현은 수소의 분리 및 생산 과정과 저장-이송의 과정을 포함하고 있는데, 물을 전기분해함으로써 수소와 산소를 생산할 수 있고 또한 생산된 수소를 저장 및 이송하기 위한 수소저장 기술이 필요하게 된다. 특히, 물을 전기분해하기 위해서는 상당량의 에너지가 필요하게 되는데 이는 잉여 재생에너지(태양광, 풍력 등)를 이용하여 수소를 생산할 수 있으며, 이렇게 생산된 수소를 효율적으로 저장 매체에 저장하고 운송하여 필요한 수요처에 수소를 공급하는 것이 수소경제 실현에서 반드시 필요한 일이다.
생산된 수소를 저장하는 방법으로는 고압 탱크로써 수소를 압축해서 저장할 수 있으나 고압 사용에 따른 폭발의 안전성 문제가 있을 수 있으며(Schlapbach and Züttel, 2010), 금속수소화물을 이용한 수소 저장은 대체로 높은 수소저장밀도를 가지며 있지만, 고체 형태로서 효율적 운송에 제약이 따르고 있는 실정이다. 또한 액화 수소 형태로 수소를 저장하면 높은 체적에너지밀도를 가지지만(Durbin and Malardier-Jugroot, 2013), 극저온 환경이 필요한 수소 저장 방법으로서 효율성이 다소 낮은 단점이 있을 수 있다. 수소를 효율적으로 저장하는 다양한 방법들 중, 액상유기수소운반체(liquid organic hydrogen carriers, LOHCs)는 수소화가 용이한 액체상 화학물질에 수소를 저장해 보관 수송한 후 탈수소화 과정을 거쳐 수소를 재방출시키는 물질이다. LOHCs 물질의 장점은 상온에서 안정한 액체상태로 장기간 보관 가능하며, 상대적으로 높은 무게대비(4~8 wt%) 및 높은 부피대비(55 kg H2/m3) 수소저장용량을 가지며, 특히 반복적 수소화(hydrogenation) 및 탈수소화(dehydrogenation) 과정에서 우수한 가역성(reversibility)을 나타낼 수 있는 장점을 가지고 있다(Chen et al., 2015).
최근 주목 받는 LOHCs 중 대표적인 물질은 붕소(B), 질소(N), 수소(H) 원자를 포함한 B-N-H 화합물인 ammonia borane(BH6N, AB)으로 상대적으로 높은 수소저장 용량(19.6 wt%)을 가지지만(Stephens et al., 2007), 수소를 방출한 후 불순물인 암모니아 등을 발생시키는 단점이 있으며(Whittermore et al., 2015), 고체로서 이송에 한계점을 가지고 있다. 또한, cyclohexane 물질은 3개의 수소 분자를 탈착 한 후 benzene으로 전환되며, 역반응으로서 다시 수소를 저장할 수 있는 대표적 LOHC 물질 중의 하나이다.
Cyclohexane의 탈수소화 반응 향상과 가역적 탈수소화-수소화 반응을 위해 헤테로 원자(즉, 탄소나 수소가 아닌 원자)가 도핑된 BN cyclohexane 물질이 주목을 받고 있는데, 이는 공기와 액상 상태에서 안정한 화합물로서 cyclohexane과 ammonia borane으로부터 합성이 가능하며 탈수소화시 cyclohexane 보다 더 낮은 활성화에너지를 나타내는 것으로 알려졌다(Luo et al., 2011). 또한 BN cyclohexane 및 bis-BN cyclohexane 물질 등은 다양한 기능기의 치환으로 인해 더 향상된 가역적 수소화-탈수소화 반응을 나타낼 수 있는 잠재성을 가지고 있음이 알려졌다. 이에 본 연구에서는 1,2-BN-cyclohexane 물질에 F와 NH2 기능기를 치환함으로써 향상될 수 있는 수소화-탈수소화 반응의 가역성을 평가하고, 기능기 치환에 따른 탈수소화 반응 메커니즘 및 반응경로 분석을 수행하고자 한다. 기능기 치환에 따른 F-BN-cyclohexane 및 NH2-BN-cyclohexane의 열역학적 생성 안정성을 평가하고자 한다. 두 기능기를 선택한 이유는, F 기능기는 강한 전기음성도(3.98 in Pauling scale)로 인해 다른 분자로부터 전자를 끌어 당겨오는 역할(electron withdrawing group)을 하며, NH2 기능기는 전자를 줄 수 있는 역할(electron donating group)을 함으로써, 기능기 부착에 의한 BN-cyclohexane 분자 내의 전자구조가 바뀌게 되며, 이로 인해 물질의 화학적 활성에 변화를 유발할 수 있기 때문이다.
이론적 계산 방법
밀도범함수이론(density functional theory, DFT) 계산은 Gauusian 16 package 프로그램(Frisch et al., 2016)을 사용하여 cyclohexane 기반의 다양한 물질들의 에너지 계산에 높은 정확도로서 사용되는 방법으로 알려진 B3LYP/ DGDZVP2 레벨에서 계산하였으며(Godbout et al., 1992; Sosa et al., 1992; Andzelm and Wimmer, 1992), 분자모형의 에너지 계산에 있어서는Gaussian 시스템을 이용하여 1,2-BN-cyclohexane 구조에서 수소 원자 대신 F와 NH2 기능기로 치환한 후, 탈수소화 반응자유에너지() 및 반응엔탈피() 계산식은 식 (1)과 같다.
여기서, E는 자유에너지(free energy, G) 또는 엔탈피(enthalpy, H)를 나타내며, product 및 reactant는 각각 생성물과 반응물을 의미한다. 구체적으로 탈수소화 반응의 경우, 반응물이 BN-cyclohexane이라면 생성물은 수소분자가 탈착된 BN-cyclohexane과 수소 분자 가스를 포함한다. 탈수소화 반응에서 값이 0(zero)에 가까울수록 탈수소화 반응과 역반응인 수소화 반응이 좀 더 가역적(reversible)임을 의미하고, 값이 음수값으로 클수록 열역학적으로 더 강한 발열반응(exothermic reaction)임을 나타낸다.
또한, BN-cyclohexane 물질에 기능기 치환반응의 반응엔탈피()는 식 (2)를 통해 결정된다.
여기서, 우변항은 순서대로 F-BN-cyclohexane 엔탈피, 수소 원자 엔탈피, BN-cyclohexane 엔탈피, 그리고 F 원자 엔탈피를 나타낸다.
결과 및 고찰
기능기 치환에 따른 탈수소화 반응 가역성 평가
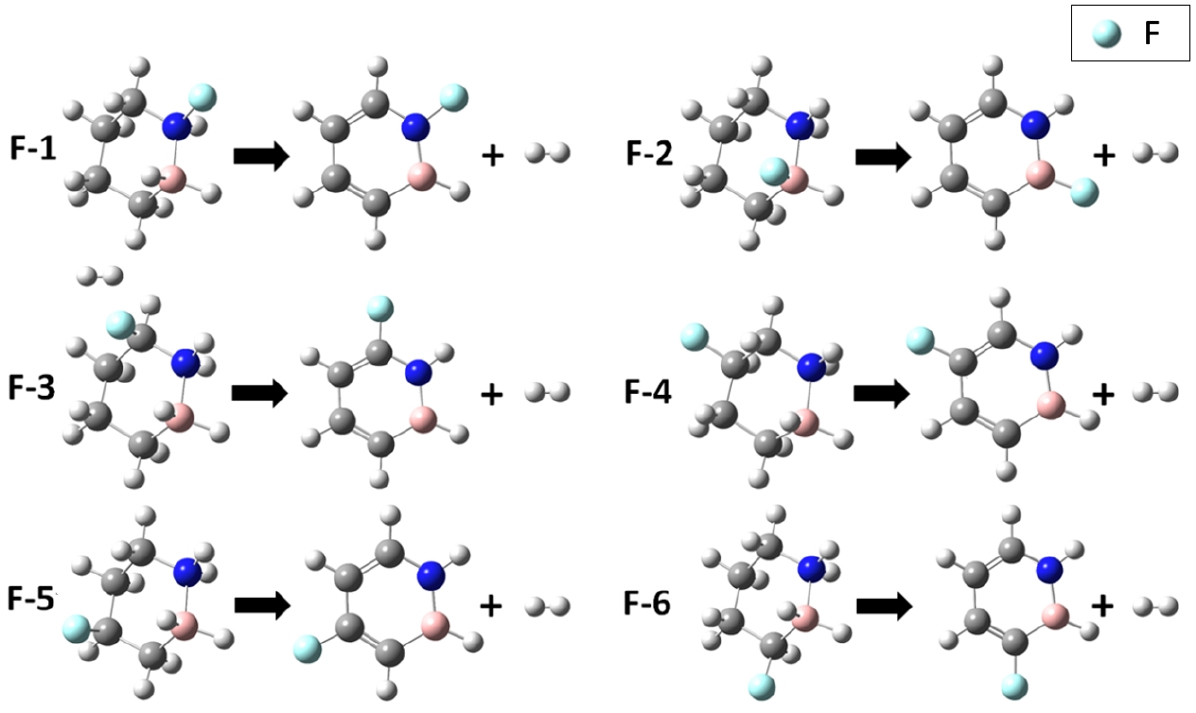
불소(F)와 아민(NH2) 기능기로써 1,2-BN-cyclohexane 분자(Fig. 1a)(Campbell et al., 2010)의 탄소 원자에 위치한 수소 원자를 치환하여 탈수소화 반응에서의 반응자유에너지()를 계산하였다. 탈수소화와 수소화 반응의 가역성은 값이 영(zero)에 가까울수록 우수하기에, 기능기 치환에 따른 새로운 LOHC 물질의 가역성을 평가하였다. 선정한 기능기 치환 사이트는 총 6개로 붕소, 질소 그리고 4개의 탄소 원자가 각각 하나의 기능기 치환 사이트를 의미한다(Fig. 1a).
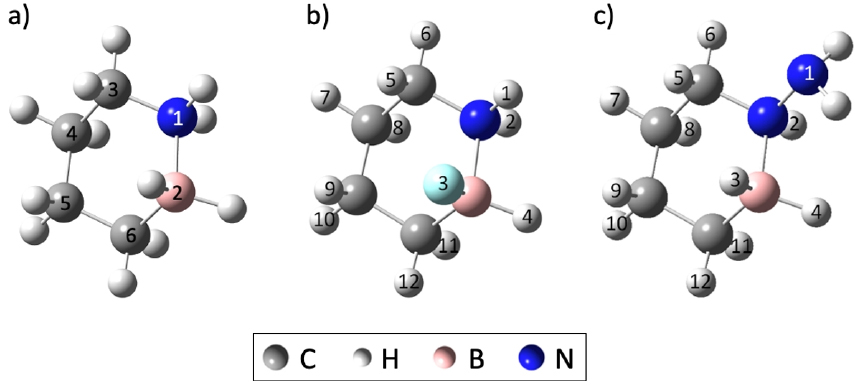
Fig. 1.
a) Molecule structure of 1,2-BN-cyclohexane with the substitutional sites of functional groups (Site 1~6), b) F-BN- cyclohexane (F-2 site) and c) NH2-BN-cyclohexane (NH2-1 site). Atoms with numbers in b) and c) are detached in the dehydrogenation reaction except for the functional groups (3 in b and 1 in c).
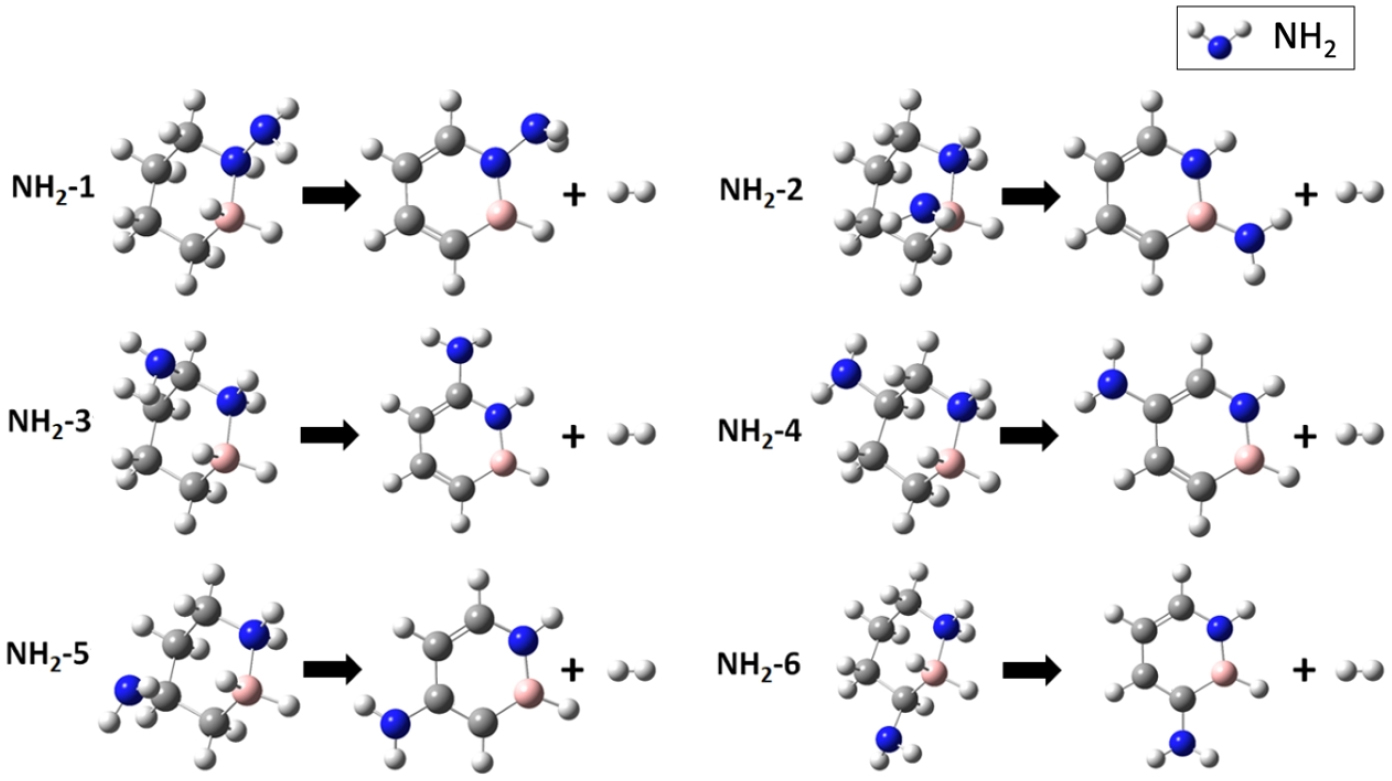
기능기 치환 사이트에 따른 탈수소화 반응 가역성을 비교하기 위해 기능기를 수소 원자 위치에 치환한 후 총 6개의 수소 원자(3H2)를 탈착 시킨 후 생성물의 자유에너지(G) 값에서 반응물의 자유에너지(G) 값을 빼어 값을 계산하였다(식 1). Fig. 2와 3 그리고 Table 1과 2에 각각 F와 NH2가 치환되는 사이트에 따른 탈수소화 값을 나타내었다.
Table 1.
Dehydrogenation reaction free energy () and reaction enthalpy () of F-BN-cyclohexane formation depending on the F substitutional sites (F–1 ~ F–6). Numbers are indicated in the order of reversibility and stability
F 치환에 따른 탈수소화 반응 가역성
1,2-BN-cyclohexane 분자의 기능기 치환 6개 사이트에 F를 치환 후 3개의 수소 분자가 탈착되는 반응을 모사하였다(Fig. 2). F 치환 위치에 따른 각 모델(F–1 ~ F–6)의 반응물과 생성물의 분자 구조 최적화에서 분자 고리가 깨어지지 않고 최적화된 구조를 나타냈으며, 반응물의 자유에너지와 생성물(즉, 수소 탈착된 분자와 3개의 가스 상의 수소 분자)의 자유에너지를 계산하여 값을 계산하였다(Table 1). 값의 절대값()이 영(zero)에 가까운 순서로 가역성이 우수한 순서를 부여했다. Table 1에 나타난 것처럼, 기능기 치환 사이트 2 번에 F가 치환될 때 탈수소화 반응의 값이 –4.10 kJ/mol로 가역성이 가장 우수할 것으로 예측된다.
1,2-BN-cyclohexane 물질에서 3개의 수소 분자가 탈착될 때의 와 값은 각각 103.20 그리고 –5.71 kJ/mol로 나타났다. 탈수소화 반응의 가역성을 고려할 때, F-BN- cyclohexane의 값이 BN-cyclohexane의 값보다 0 (zero)에 더 가깝기 때문에, 기능기 F의 치환에 의해 새로운 F-BN-cyclohexane 물질의 탈수소화-수소화 반응 가역성이 더 향상되었음을 알 수 있다.
NH2 치환에 따른 탈수소화 반응 가역성
1,2-BN cyclohexane 분자의 기능기 치환 6개 사이트에 NH2를 치환 후 3개의 수소 분자가 탈착되는 반응을 모사하였다(Fig. 3). NH2 치환 위치에 따른 각 모델(NH2–1~NH2 –6)의 반응물과 생성물의 분자 구조 최적화에서 분자 고리가 깨어지지 않고 최적화된 구조를 나타냈으며, 반응물의 자유에너지와 생성물(즉, 수소 탈착된 분자와 3개의 가스 상의 수소 분자)의 자유에너지를 계산하여 값을 계산하였다(Table 2). 값의 절대값()이 영(zero)에 가까운 순서로 가역성이 우수한 순서를 부여했다. Table 2에 나타난 것처럼, 기능기 치환 사이트 1번에 NH2가 치환될 때 탈수소화 반응의 값이 –5.38 kJ/mol로서 가역성이 가장 우수할 것으로 예측된다.
Table 2.
Dehydrogenation reaction free energy () and reaction enthalpy () of NH2-BN-cyclohexane formation depending on the NH2 substitutional sites (NH2–1 ~ NH2–6). Numbers are indicated in the order of reversibility and stability
탈수소화 반응 가역성이 가장 높은 물질의 탈수소화 반응 경로 분석
기능기 치환된 BN-cyclohexane의 실험적 탈수소화 반응 관점에서는 수소 원자들이 동시다발적으로 탈착되는 반응이기 때문에 실험적 분석으로 분자 내의 어떤 수소 원자에서 먼저 탈착 반응이 발생되는지를 확인하는 것은 어려운 일이다. 계산화학 DFT 연구의 장점 중의 하나는 이러한 탈수소화 반응 경로를 원자 단위로 분석이 가능하다는 점이다. 화학물질의 분자 구조 특성상 용이하게 먼저 탈착되는 수소 원자의 정보를 알 수 있다면, 다양한 촉매 반응에서의 이러한 탈수소화 반응 경로 분석 시 반응 중간생성물 결정에 중요한 정보를 제공해 줄 수 있을 것이다.
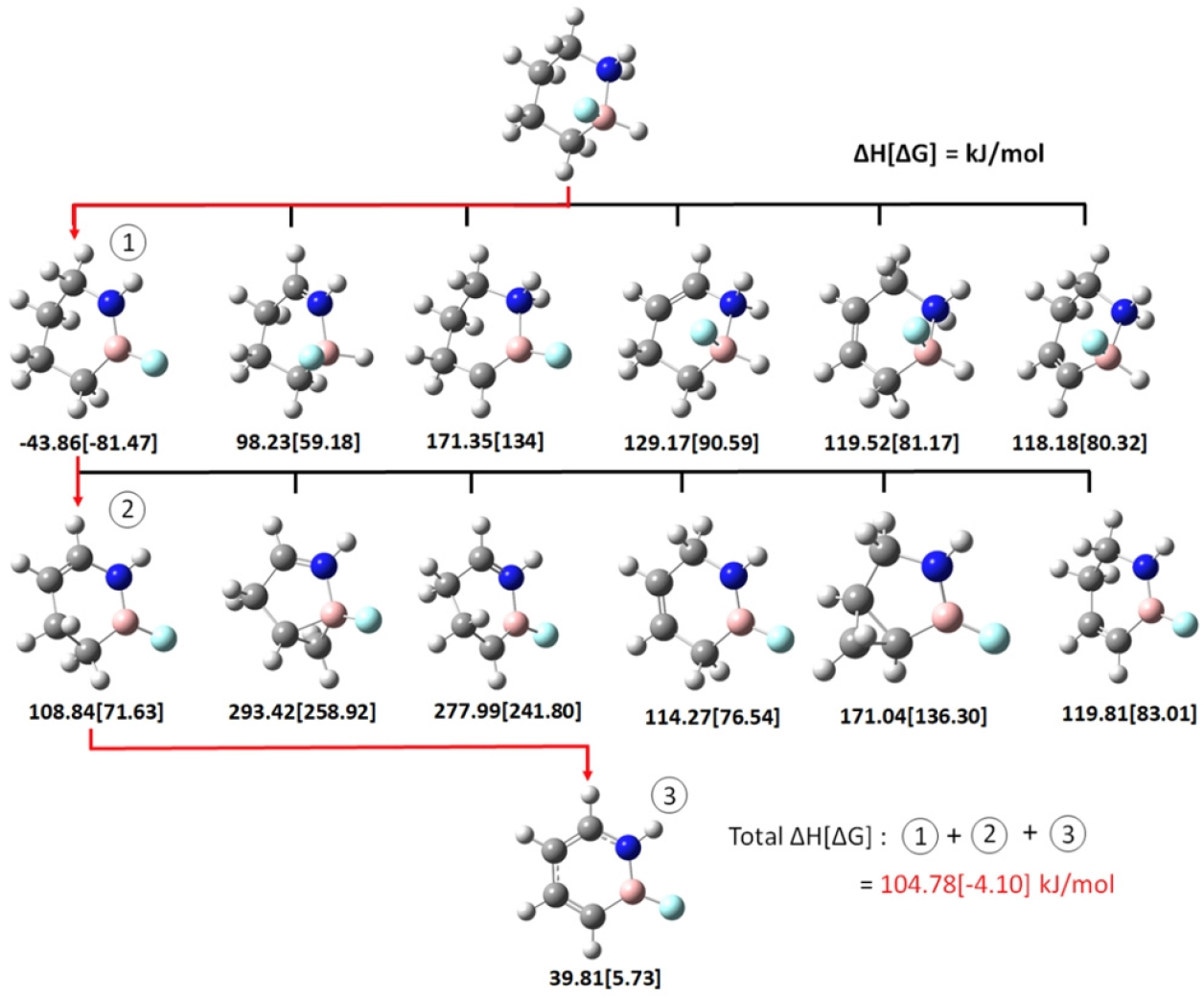
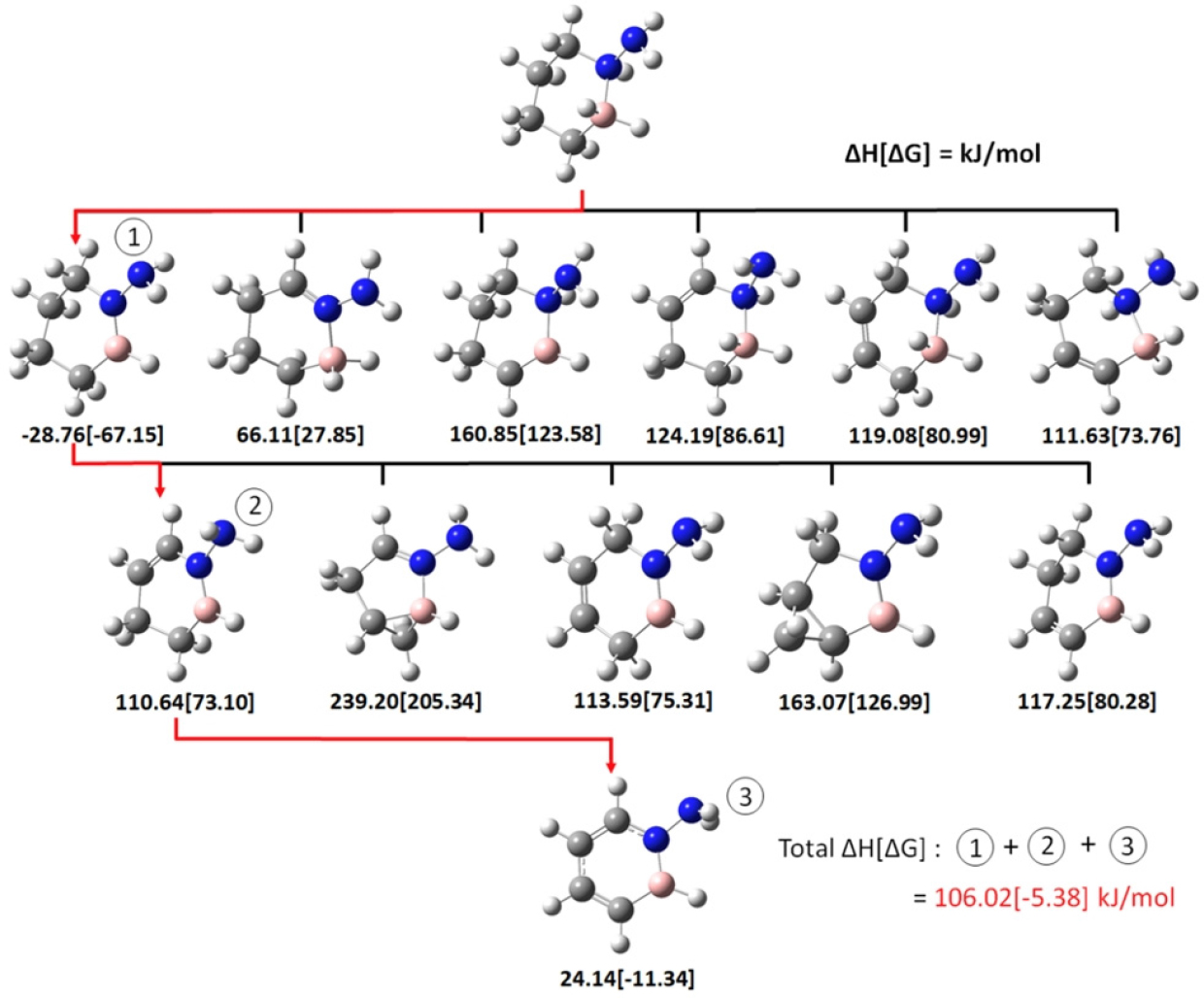
탈수소화 경로를 찾기 위하여 2개의 수소 원자가 동시에 탈착되어 1 개의 수소 분자(H2)가 방출되는 단계를 한 단계하여 총 3 단계(즉, 3H2 탈착)로 전체 반응 경로를 구성하였고, 각 반응 단계마다 수소 분자 탈착에 따른 반응엔탈피()를 계산하였다. 동일한 수소 탈착 단계 반응들에서 값이 작은 반응일 수록 열역학적으로 안정된 반응이며, 이 값이 음수일 때 발열반응임을 나타내기에 각 반응 단계 계산에서 가 최소화되는 경로를 선택하여 최종 반응 경로로 결정하였다. Fig. 1b와 1c는 탈수소화 반응 가역성이 가장 우수한 F 및 NH2 치환 BN-cyclohexane 물질로서(각각 F–2 및 NH2–1 치환 사이트), 탈착되는 수소 분자를 표시하기 위해 원자들에 번호를 부여하였다.
Fig. 4는 F-BN-cyclohexane에서 H2 분자가 탈착할 때의 반응엔탈피()를 나타내며, 열역학적으로 가장 안정한 반응 경로(즉 반응엔탈피()가 가장 낮은 반응 경로)를 붉은색 화살표로써 나타내었다. 가장 먼저 수소 원자 두개가 탈착되는 위치는 Fig. 1b의 1번 수소 원자와 4번 수소 원자이며 이들은 각각 질소(N)와 붕소(B)에 결합되어 있는 위치이며, 두 번째 수소 분자는 5번–8번, 그리고 마지막으로는 9번–12번 위치의 수소 원자들이 탈착되었다.
수소 원자가 가장 먼저 탈착되는 위치는 B와 N 원자의 수소 원자인데, 이는 B와 N의 전기음성도(electronegativity) 차이에 의한 결과라고 할 수 있다. 질소와 붕소의 전기음성도는 각각 3.04와 2.04 (in Pauling scale)로서, 질소에 결합되어 있는 수소의 경우는 질소의 강한 전기음성도에 의해 수소의 전자밀도가 질소로 강하게 끌려가게 되며, 이로 인해 수소 원자는 상대적으로 부분 (+)전하()를 가지게 된다(Lingam et al., 2011). 이와 유사하게 붕소에 결합되어 있는 수소의 경우는 질소보다 상대적으로 약한 붕소의 전기음성도로 인해 붕소에 결합되어 있는 수소는 상대적으로 부분 (‑)전하()를 가지게 된다(Lingam et al., 2011). 이로 인해, 질소와 붕소에 결합되어 있는 와 를 띠고 있는 수소들이 전기적 인력에 의해 수소 분자로 결합되기 쉽게 되고, 가장 먼저 수소 분자 탈착이 발생하게 됨을 알 수 있다. 이러한 탈수소화 메커니즘 원리에 의해, 기존 수소저장 물질에 질소와 붕소를 치환함으로써 더 향상된 탈수소화 반응을 기대할 수 있는 원리라고 할 수 있겠다.
Fig. 5는 NH2-BN-cyclohexane에서 H2 분자가 탈착할 때의 반응엔탈피()를 나타내며, 열역학적으로 가장 안정한 반응 경로(즉 반응엔탈피()가 가장 낮은 반응 경로)를 붉은색 화살표로써 나타내었다. NH2-BN-cyclohexane 탈수소화 반응에서도 앞서 F-BN-cyclohexane 탈수소화 반응처럼, 질소와 붕소에 결합된 수소에서 탈착 반응이 먼저 발생되었다. 이는 앞서 언급한 질소와 붕소의 전기음성도 차이에 의한 원인에 더해, NH2 그룹에 의한 볼만효과(Bohlmann effect)도 관여하는 것으로 판단된다. 볼만효과(Bohlmann effect)(Lii et al., 2004)란 C-H 결합에 NH2 그룹이 결합되어 있을 때(HC-NH2), 질소에 존재하는 고립 전자쌍(lone pair electron)이 C-H 결합의 반결합 오비탈(antibonding orbital)로 이동함에 따라, C-H 결합이 약하되고 이로 인해 수소원자가 탄소원자로부터 쉽게 탈착 되는 현상을 말한다. NH2-BN-cyclohexane의 경우 NH2 그룹이 BN-cyclohexane의 질소 원자에 결합되어 있는데, 이 경우에도 유사하게 NH2의 고립 전자쌍에 의해 탄소자리에 치환된 질소에 결합된 수소의 결합이 약해지고 이로 인해 Fig. 5에서 나타난 것처럼, Fig. 1c의 2번과 3번 위치의 수소가 가장 먼저 탈착되는 것으로 판단된다.
추가적으로, 1,2-BN-cyclohexane의 탈수소화 반응 경로에서도 F-BN-cyclohexane의 탈수소화 반응과 유사하게, 질소와 붕소로 도핑된 수소원자들에서 이들의 상대적인 반대 부분 전하로 인해 가장 먼저 탈착됨을 확인할 수 있었다.
열역학적으로 가장 안정적인 기능기(F, NH2) 합성 평가
앞선 결과에서는 탈수소화 반응의 가역성이 가장 높은 기능기 치환된 BN-cyclohexane 물질에 대한 반응 경로 분석을 수행하였는데, 이에 더해 기능기의 존재 위치에 따라 반응물(BN-cyclohexane + 기능기 원소 물질)에 의한 생성물(기능기-BN-cyclohexane + 수소 원자) 생성이 열역학적으로 얼마나 안정한지를 평가하기 위한 반응엔탈피()를 계산하였다.
F-BN-cyclohexane의 F기능기 위치에 따른 반응물 생성 는 Table 1에, NH2-BN-cyclohexane의 NH2 기능기 위치에 따른 반응물 생성 는 Table 2에 나타내었다. 생성물의 생성은 값이 음수로 클 수록 더 안정적인 생성을 의미하는데, F–2 기능기 위치와 NH2–2 기능기 위치에서 각각 F-BN-cyclohexane과 NH2-BN-cyclohexane이 열역학적으로 생성될 수 있는 발열반응임을 나타낸다. F-BN- cyclohexane의 경우 F 기능기의 모든 생성 위치에 값이 모두 음수로 나타났기에, F 기능기의 위치에 관계없이 열역학적으로 안정적인 생성이 가능할 것으로 예상되지만, NH2-BN-cyclohexane의 경우는 NH2–2 기능기 위치에서만 안정적인 생성물이 생성될 수 있을 것으로 나타났다.
전자구조 분석을 통한 탈수소화 반응 활성도 예측
1,2-BN-cyclohexane 물질에 기능기를 치환함에 따라 탈수소화의 반응엔탈피() 및 반응자유에너지()가 변하게 되며, 이로 인해 더 효율적인 탈수소화 반응 또는 더 가역적인 탈수소화-수소화 반응을 기대할 수 있게 됨을 증명하였다. 각 물질의 전자구조를 분석함으로써 향상된 반응 메커니즘을 해석할 수 있는데, 분자 오비탈 중 HOMO (Highest occupied molecular orbital)와 LUMO (Lowest unoccupied molecular orbital)를 분석하고, 이들의 에너지 차이 (즉, HOMO-LUMO 갭(gap))로써 분자의 화학반응 활성도를 가늠할 수 있다(Umadevi et al., 2014). 분자 오비탈에는 가장 안정한 낮은 에너지로부터 전자가 채워지게 되는데, 전자가 채워진 오비탈 중 에너지가 가장 높은 오비탈을 HOMO라고 하며, 전자가 채워지지 않은 오비탈 중 에너지가 가장 낮은 오비탈을 LOMO라고 한다.
Fig. 6a와 6b는 가장 가역성이 큰 기능기 위치인 F-BN- cyclohexane (F–2 구조)와 NH2-BN-cyclohexane (NH2–1 구조)의 HOMO와 LUMO를 보여주며, 또한 이들의 HOMO-LUMO gap 크기를 나타낸다. HOMO-LUMO gap 값은 F-BN-cyclohexane이 NH2-BN-cyclohexane 보다 더 작음을 알 수 있는데, F-BN-cyclohexane의 상대적으로 작은 HOMO-LUMO gap으로 인해 HOMO로부터 LUMO로 전자 이동이 쉽게 발생되며 이로 인해 F-BN-cyclohexane의 화학반응 활성이 NH2-BN-cyclohexane 보다 더 우수함을 예측할 수 있다. 이는 Fig. 4와 Fig. 5에서 나타난 세 단계의 탈수소화 값을 모두 합한 값인 3개 수소 분자가 탈착되는 탈수소화 값의 비교에서도 나타나는데, F-BN- cyclohexane과 NH2-BN-cyclohexane이 각각 104.78 kJ/mol 그리고 106.02 kJ/mol를 나타내며, 이는 F-BN-cyclohexane의 탈수소화 반응 활성이 NH2-BN-cyclohexane 보다 다소 우수함을 보여주며, 이는 HOMO-LUMO gap에 따른 화학반응 활성 비교 결과와 일치하는 결과이다.
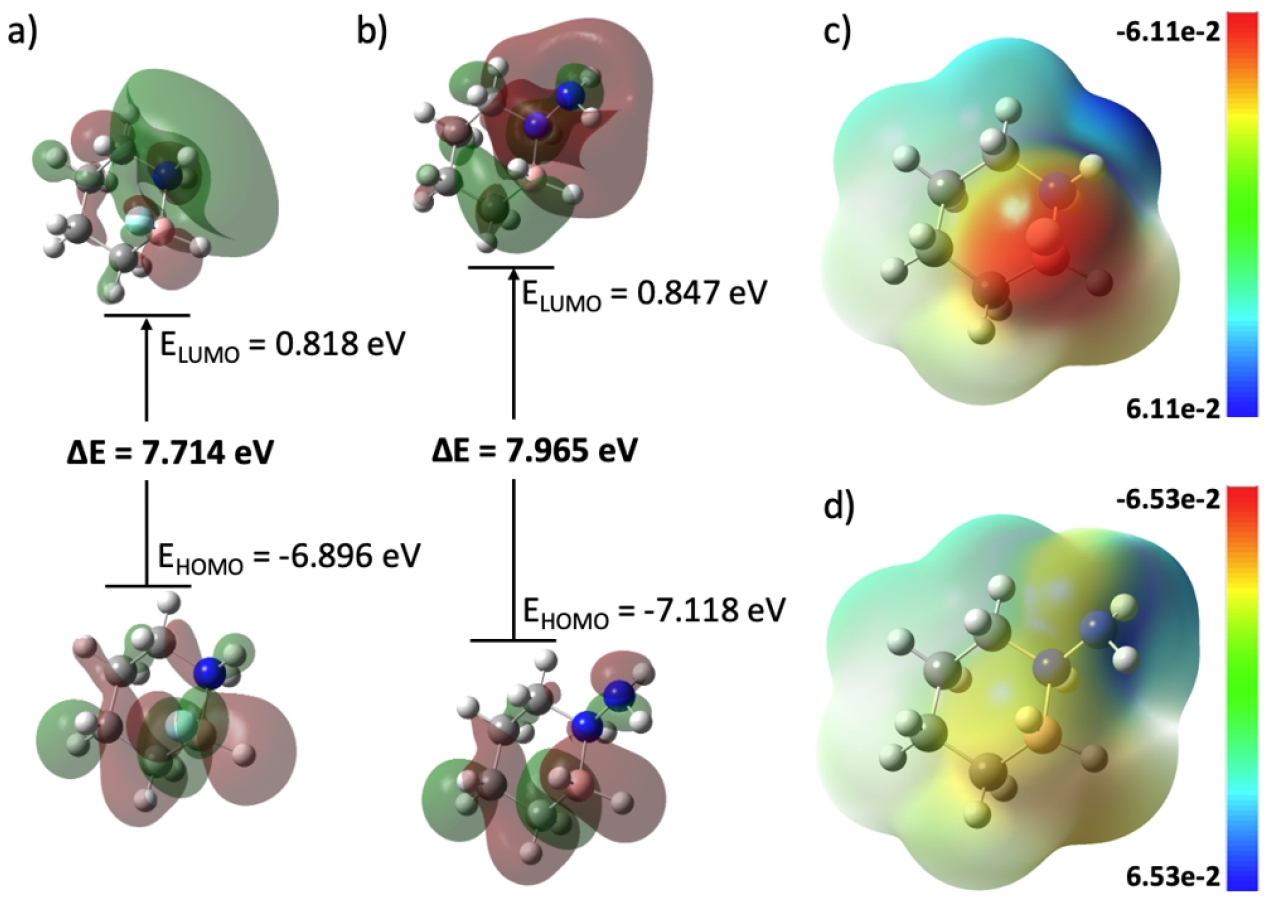
Fig. 6.
HOMO, LUMO, and HOMO-LUMO gap of a) F-BN-cyclohexane (F–2 site) and b) NH2-BN-cyclohexane (NH2–1 site). Red and green colors on HOMO and LUMO represent the positive and negative portions of the wave function. ESP visualization of c) F-BN-cyclohexane (F–2 site) and d) NH2-BN-cyclohexane (NH2–1 site). Red and blue colors on the ESP surface represent negative and positive charges (unit: electron), respectively.
또한, 분자 구조들에 대한 표면정전포텐셜(electrostatic surface potential, ESP) 분석을 통해 분자 표면에서의 전자의 분포 정도를 시각적으로 비교할 수 있는데, Fig. 6c와 6d에 F-BN-cyclohexane와 NH2-BN-cyclohexane 분자 구조의 ESP를 나타내었다. 앞서 질소와 붕소 원자에 결합된 수소 원자들에서 탈수소화 반응이 가장 먼저 발생되는 원인이 질소와 붕소의 상대적인 전기음성도 차이에 의한 것임을 밝혔고, 이로 인해 질소에 결합된 수소는 상대적으로 (+)전하()를 띠게 되고, 반면 붕소에 결합된 수소는 상대적으로 (‑)전하()를 띠게 됨을 서술하였는데(Lingam et al., 2011), 이러한 전기적 특성들이 Fig. 6c의 질소 부근에서의 푸른색(+전하)과 붕소 부근에서의 붉은색(-전하)으로 잘 나타나고 있다. 유사한 결과가 Fig. 6d의 NH2-BN- cyclohexane 에서도 나타나고 있음을 알 수 있다. 이러한 ESP 분석을 통해, 분석하고자 하는 특정 화학물질에서의 특정 원소의 탈착 반응이 어떻게 진행될 수 있음을 예측할 수 있는 정보를 얻을 수 있겠다.
결 론
본 연구는 액상유기수소운반체(LOHCs) 수소저장물질로서 개발된 1,2-BN-cyclohexane 물질에 F와 NH2 기능기를 치환함으로써 반응자유에너지()가 0 (zero)에 가까워지는지를 비교하여 탈수소화-수소화 가역적 반응 향상성을 평가하고자 하였다. 1,2-BN-cyclohexane 물질의 탈수소화 반응자유에너지()가 –5.71 kJ/mol인 반면, F- BN-cyclohexane과 NH2-BN-cyclohexane의 는 각각 –4.10과 –5.38 kJ/mol로서 두 종류의 기능기를 치환할 경우 더 향상된 탈수소화-수소화 반응 가역성을 나타낼 수 있을 것으로 나타났다.
F-와 NH2-BN-cyclohexane의 탈수소화 반응 경로의 자세한 분석을 통해 탈수소화 반응은 질소와 붕소에 결합된 수소에서 먼저 발생함을 알 수 있었다. 이는 질소와 붕소의 상대적 전기음성도에 차이에 의한 질소에 결합된 수소의 부분적 (+)전하()와 붕소에 결합된 수소의 부분적 (‑)전하()로써 수소 원자가 정전기적 인력에 의해 쉽게 탈착되어 수소 분자를 생성함을 표면정전포텐셜(ESP) 분석으로 통해 증명하였다.
또한, 기능기가 치환됨에 따라 F-와 NH2-BN-cyclohexane 물질의 생성 안정성을 생성반응엔탈피() 계산으로써 예측하였다. F-BN-cyclohexane 물질은 열역학적으로 안정할 것으로 평가되며, NH2-BN-cyclohexane 물질은 NH2 치환 위치에 따라 안정성이 다르지만 대부분의 위치에서 열역학적으로 불안정할 것으로 판단된다.
마지막으로, F-와 NH2-BN-cyclohexane 물질의 HOMO- LUMO gap을 계산하여 비교함으로써, HOMO-LUMO gap이 작을 수록 탈수소화 반응엔탈피()가 더 작음(즉, 반응 활성도가 높음)을 알 수 있었다.
본 밀도범함수이론(DFT) 연구는 기존 화학 물질에서 특정 기능기를 치환할 시 향상될 수 있는 화학반응 활성을 평가하는 체계적 방법론을 제시할 뿐만 아니라, 기존 LOHCs 물질보다 더 향상된 탈수소화-수소화 반응 가역성을 나타낼 수 있는F-BN-cyclohexane 물질을 제안하며, 열역학적으로 안정한 화합물 임을 증명하였다.