서 론
황동석(Chalcopyrite, CuFeS2)은 세계 구리 매장량의 약 70%를 차지하고 있으며, 황동석이 주 광물인 황화동광의 정광은 주로 건식제련에 의해 처리되어 구리를 생산해 왔다(Cordoba et al., 2008, Kim et al., 2019). 건식제련 처리가 가능한 고품위 황화동광이 고갈됨에 따라, 황동석을 함유하는 저품위의 황화동광에 대한 습식제련 처리가 요구되어 왔다(Watling, 2013). 황화동광의 습식제련 처리를 위해 개발된 공정은 황산염(sulfate)과 염화물(chloride)을 기반으로 하는 공정으로 대별 될 수 있으며(Dreisinger, 2006), 황산염 기반의 공정은 침출 후 용매추출, 전해채취를 통한 구리의 회수가 용이한 장점이 있다(Hackl et al., 1995b). 그러나 상압 조건에서 황산염을 기반으로 하는 황동석의 산화침출은 광석 표면에 부동태층(passivating layer)을 형성시켜 침출속도를 늦추는 단점이 보고되었다(Hackl et al., 1995b).
부동태화와 같은 현상을 극복하기 위해 금속을 환원제로 사용하는 방법, 산화환원전위 조절법, SO2 이용 환원법, 미립분쇄법, 가압침출법 등 다양한 습식제련 공정이 개발되어 보고되었다(Yoo et al., 2008). 그 중에서도 고온에서 산소를 산화제로 이용하는 산소가압(POX, Pressure Oxidation) 공정은 미국 애리조나의 Bagdad 및 Morenci 광산, 브라질 카라하스의 Sossego 광산의 황동석 광석 침출에 적용되어 개발되었다(Marsden, 2009; Sahu and Asselin, 2011). 산소가압침출을 위해 개발된 습식제련 공정은 온도에 따라 저온, 중온 및 고온공정으로 분류할 수 있다.
저온공정(90~110°C)은 초미립분쇄(ultra-fine grinding)를 이용하여 침출반응속도를 향상시키고, 80~90%의 황화물(sulfide)을 단체황(elemental sulfur)으로 전환시킨다(McDonald and Muir, 2007a). 중온공정(일반적으로 140~ 150°C)은 미립분쇄를 이용하지만 반응중 생성된 황(molten sulfur)에 의한 황동광 표면의 부동태화 층 형성으로 인해 침출반응속도가 느려지기 때문에 이를 최소화하기 위해 염화물 또한 계면활성제와 같은 특정 시약의 첨가가 요구된다(Hackl et al., 1995a; Hackl et al., 1995b; Steyl, 2004). 중온 공정은 70~80%의 황화물을 단체황으로 전환시키고 침출잔사는 황산염(sulfate)을 적게 함유하여 일반적으로 매우 안정한 공정이다. 고온공정(200~230°C)은 침출속도는 상당히 빠르지만 모든 황화물이 황산염으로 전환되면서 훨씬 더 많은 산소가 소비되고 보다 높은 농도의 유리산(free acid)이 생성된다(McDonald and Muir, 2007b).
본 연구는 국내에 수입되는 황동석 정광을 대상으로 50 L 파일럿 플랜트 규모의 산소가압침출기를 이용하여 산소압력, 침출온도, 침출시간, 시료입도가 구리 및 철 침출율에 미치는 영향에 대하여 살펴보았으며, 용액 중 구리와 철의 농도를 조사하고, 침출잔사를 XRD(X-ray diffractometer)로 분석하여 실험결과를 고찰하였다.
실험방법
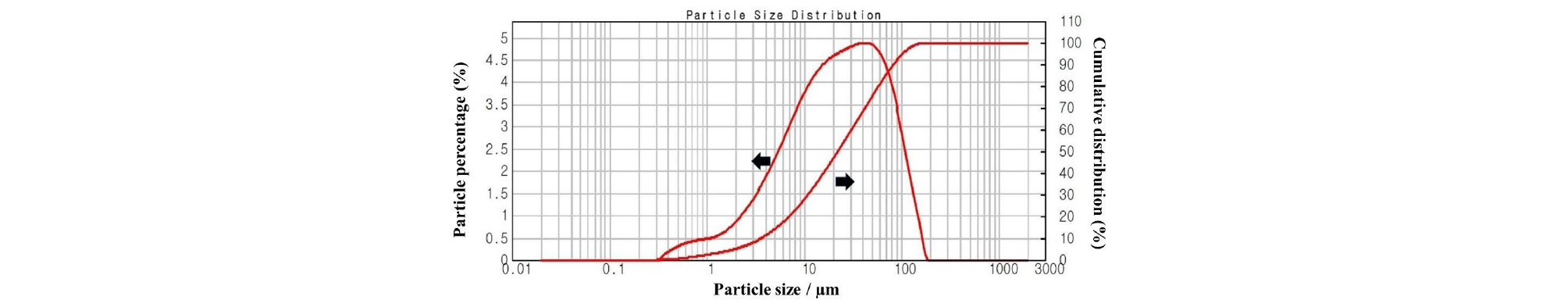
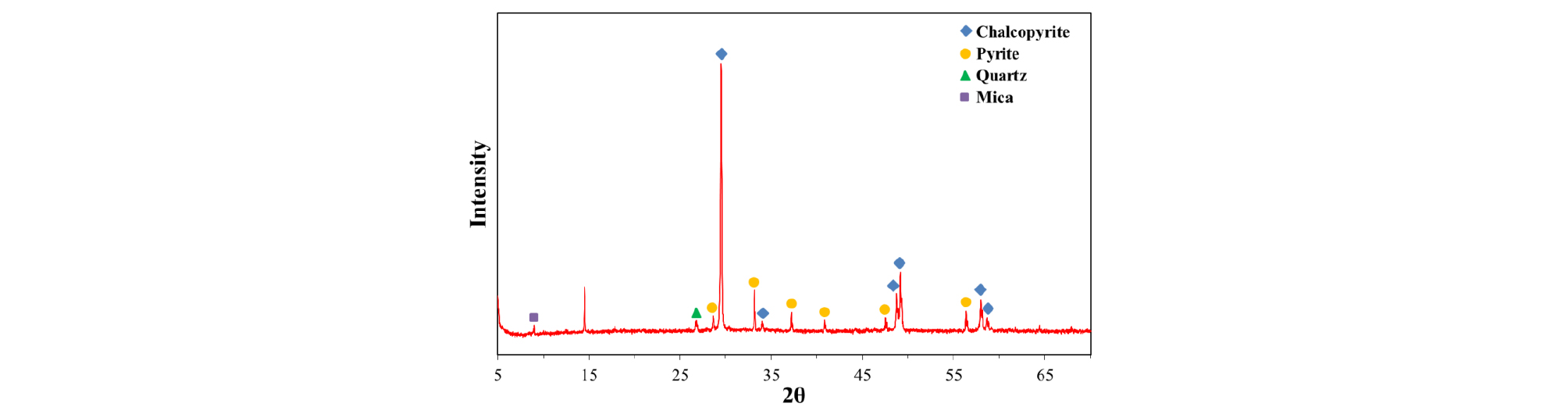
산소가압침출 실험을 위하여 국내에 수입되고 있는 황동석 정광을 시료로 사용하였으며, 시료의 입도 분석 결과(Malvern사의 MS 2000 이용), 전체 입도분포에서 90%의 크기(D90)는 82.62 µm이었다(Fig. 1). 시료입도 조건 변화 실험을 위하여 로드밀을 이용한 추가분쇄 후 공기분급기를 이용하여 입도크기 D90 9.92 µm의 시료를 확보하였다. 시료를 산용해 후, ICP-OES(Inductively Coupled Plasma Optical Emission Spectrometer, Perkinelmer, Inc.)를 이용하여 성분분석을 실시하고 분석결과를 Table 1에 나타내었다(Si는 SiO2로 환산하여 표시). 시료의 XRD(SmartLab X-ray diffractometer, Rigaku Co.) 분석결과 시료를 구성하고 있는 주요 광종은 황동석이며, 그 외에 황철석, 석영 등이 수반되고 있음을 확인하였다(Fig. 2).
Table 1. Elemental composition of the samples
| Composition | Cu | Fe | S | SiO2 | Al | Zn | Ca | Pb |
| Content (wt. %) | 25.68 | 27.33 | 30.53 | 7.28 | 0.98 | 0.48 | 0.34 | 0.12 |
모든 침출실험은 한국광물자원공사가 설계 및 제작한 반응기 용량 50 L 규모의 회분식(batch) 가압침출기(autoclave) 파일럿 플랜트(pilot plant) (Fig. 3 참조)를 이용하여 수행하였다. 반응기 재질은 stainless steel 304가 선택되었으며 내부를 hastelloy-C276으로 라이닝하였고, 반응기 외부 자켓에서 순환하는 열매체유(heating medium oil)를 가열 및 냉각하여 슬러리의 온도를 조절하였다. 첫 번째 탱크에서 증류수 20 L에 96%의 진한 황산을 57 mL 투입하여 초기 황산농도 5 g/L의 황산용액을 준비하고, 두 번째 탱크에서 황산용액과 2 kg의 시료를 혼합하여 산소압력 10-25 atm, 침출온도 150-220°C, 침출시간 30-120 min 범위에서 hastelloy- C276 재질의 임펠러를 이용하여 150 rpm으로 교반하면서 침출하였다. 침출 종료 후, 세 번째 탱크에서 침출슬러리를 냉각하고 침출액과 침출잔사를 여과하여 침출액의 부피를 측정하였다. 침출액 내 Cu 및 Fe의 농도는 ICP를 사용하여 분석하였고, 용액의 pH를 측정하였다. 건조시킨 침출잔사는 침출 후 XRD 분석을 통하여 실험조건에 따른 침출잔사의 특성을 살펴보았다. Table 2에 실험변수에 대한 조건을 요약하였다.
Table 2. Operation conditions for the pressure oxidation leaching in the present study
실험결과 및 고찰
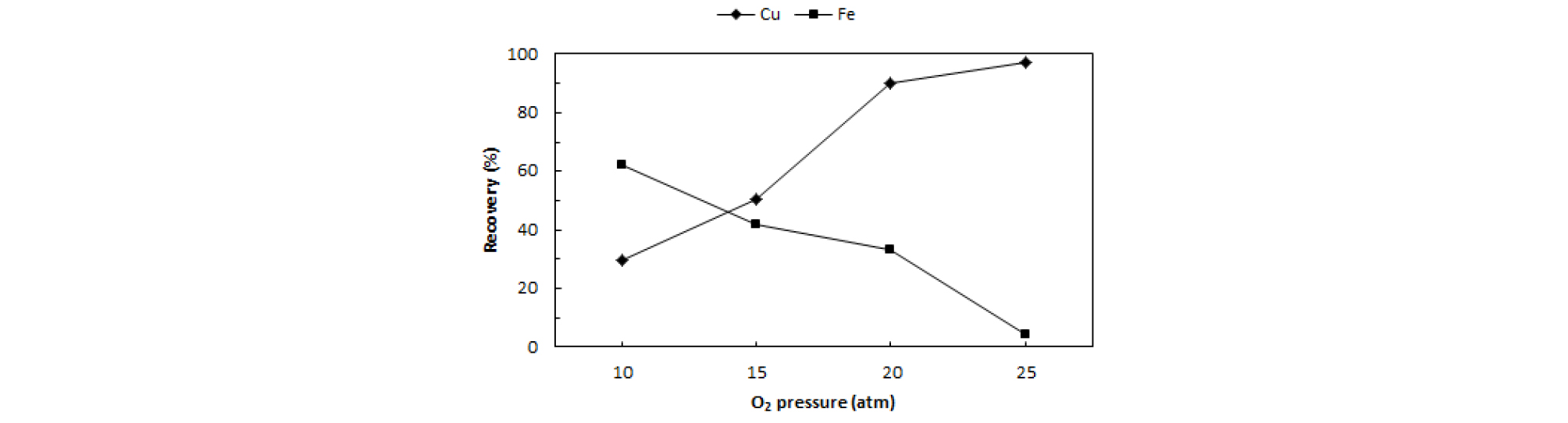
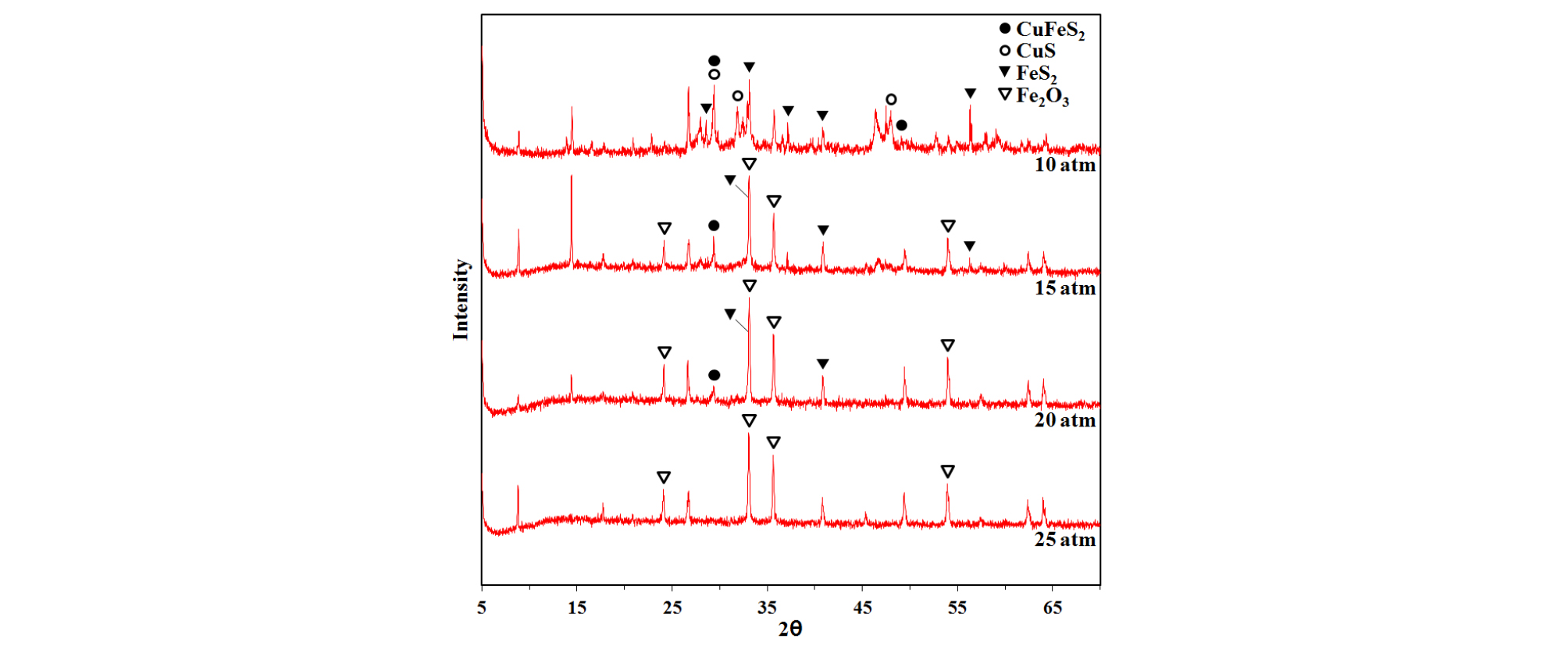
Fig. 4에 산소압력 증가에 따른 Cu와 Fe의 침출율 변화를 나타내었다. 산소압력을 10 atm에서 25 atm으로 증가시킴에 따라 Cu 침출율이 크게 증가하였으며, 25 atm에서 97.17%의 Cu가 침출되었다. Fe 침출율은 Cu 침출율과 반대로 감소하는 것을 볼 수 있는데, 이는 용액 중에 침출된 Fe 이온이 산소에 의한 산화에 의해 적철석 형태로 침전된 결과로 판단되었다.
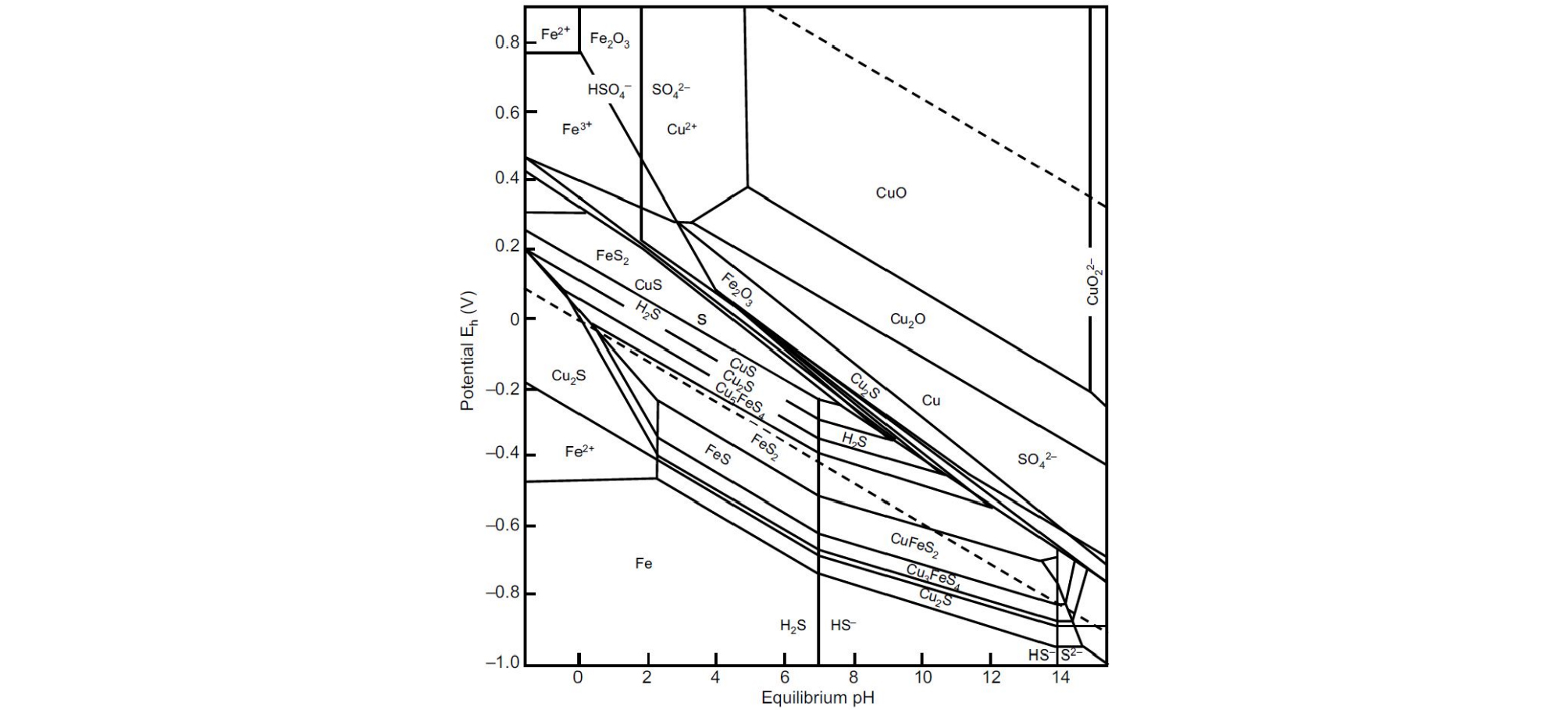
Fig. 5는 25°C에서 Cu-Fe-S-O-H2O 계의 Pourbaix diagram (Eh-pH diagram)을 나타내고 있으며(Peters, 1976), 대부분의 광물은 구리를 Cu2+로 침출시키기 위해 산성 환경 및 산화제 모두가 요구된다(Sherrit et al., 2005). 황동석과 같이 용해하기 매우 힘든 광물은 경제적으로 실현 가능한 속도로 침출이 가능하도록 높은 온도와 압력이 필요하고, 침출반응은 복잡하며 실험조건에 따라 다양하다(Hiskey, 1993; Lazarro and Nicol, 2003; Nicol and Lazarro, 2003). 황동석의 침출반응을 정리하면 다음과 같다.
| $$2{\mathrm{CuFeS}}_2+8.5{\mathrm O}_2+{\mathrm H}_2{\mathrm{SO}}_4\rightarrow2{\mathrm{CuSO}}_4+{\mathrm{Fe}}_2({\mathrm{SO}}_4)_3+{\mathrm H}_2\mathrm O$$ | (1) |
| $$2{\mathrm{CuFeS}}_2+16{\mathrm{Fe}}_2({\mathrm{SO}}_4)_3+16{\mathrm H}_2\mathrm O\rightarrow2{\mathrm{CuSO}}_4+34{\mathrm{FeSO}}_4+16\mathrm H2{\mathrm{SO}}_4$$ | (2) |
| $$2{\mathrm{FeSO}}_4+0.5{\mathrm O}_2+{\mathrm H}_2{\mathrm{SO}}_4\rightarrow{\mathrm{Fe}}_2({\mathrm{SO}}_4)_3+{\mathrm H}_2\mathrm O$$ | (3) |
황철석의 경우 산화되어 황산제이철(Fe2(SO4)3)로 용액 중 존재하며, 이 황산제이철은 낮은 산도에서 적철석(hematite) 형태로 침전된다. 이 반응은 다음과 같이 나타낼 수 있다(Lee and Choi, 2018; McDonald and Muir, 2007a).
| $$2{\mathrm{FeS}}_2+7.5{\mathrm O}_2+{\mathrm H}_2\mathrm O\rightarrow{\mathrm{Fe}}_2({\mathrm{SO}}_4)_3+{\mathrm H}_2{\mathrm{SO}}_4$$ | (4) |
| $${\mathrm{Fe}}_2({\mathrm{SO}}_4)_3+3{\mathrm H}_2\mathrm O\rightarrow{\mathrm{Fe}}_2{\mathrm O}_3+3{\mathrm H}_2{\mathrm{SO}}_4$$ | (5) |
고온(180~230°C)의 산화조건에서 황동석 및 황철석(황동석 정광에 주로 혼재)은 상기와 같은 침출반응을 거쳐 모든 황화물 황이 황산염으로 전환된다(McDonald and Muir, 2007a). 상기의 반응을 정리하면 다음 식과 같이 정리할 수 있다.
| $$2{\mathrm{CuFeS}}_2+8.5{\mathrm O}_2+2{\mathrm H}_2\mathrm O\rightarrow\;2{\mathrm{CuSO}}_4+{\mathrm{Fe}}_2{\mathrm O}_3+2{\mathrm H}_2{\mathrm{SO}}_4$$ | (6) |
| $$2{\mathrm{FeS}}_2+7.5{\mathrm O}_2+4{\mathrm H}_2\mathrm O\rightarrow{\mathrm{Fe}}_2{\mathrm O}_3+4{\mathrm H}_2{\mathrm{SO}}_4$$ | (7) |
상기 식에서 알 수 있듯이 산소는 가압침출에서 산화제로서 중요한 역할을 한다. 200°C 이상의 산소가압침출 조건에서 산소가 충분히 존재하는 경우 황동석 및 황철석에 대한 침출반응은 식 (6)과 식 (7)을 따른다. 본 실험에 사용된 정광 시료의 양은 2 kg이며, 이 중에서 황동석은 약 74%의 비율로 시료 중에 1.48 kg 정도 존재하고 황철석은 약 10%의 비율로 0.2 kg 정도 존재한다. 황동석 및 황철석의 질량을 기준으로 이를 모두 산화시키기 위한 산소의 질량을 계산하였을 때, 본 실험에서 필요한 산소의 양은 약 1.2968 kg으로 계산되었으며, 따라서 산소의 몰수는 약 40.53 mol이다. 본 연구의 실험조건에서 반응기 내부에서 산소가 차지하는 부피는 약 40.73 L(반응기 내부 부피-증류수 부피)였으며, 이상기체방정식을 이용하여 반응기 내부로 투입한 산소압력 25 atm에 대한 산소의 몰수는 약 41.30 mol로 계산되었다. 따라서 황동석 및 황철석을 모두 산화시키기 위한 산소의 몰수인 40.53 mol보다 약간 높은 수준이었으며, 25 atm보다 낮은 산소압력 조건에서는 산화에 의한 침출반응이 완전히 일어날 수 없음을 침출반응식 및 이상기체방정식으로서 검토하였다.
침출잔사의 XRD 분석결과(Fig. 6)를 통하여 산소압력이 증가함에 따라 침출잔사 중의 적철석이 증가하는 것을 확인하였다. 또한 pH 측정결과(Table 3)로부터 산소압력이 증가함에 따라 활발해지는 황동석 및 황철석과 같은 황화물의 분해반응(식 (6)과 식 (7) 참조)으로 발생하는 황산에 의해 pH가 감소하는 것을 확인할 수 있었다.
Table 3. pH of leaching solution with various oxygen pressures (H2SO4 5 g/L, pulp density 10% (w/w), temp. 220°C, time 60 min)
| O2 pressure (atm) | 10 | 15 | 20 | 25 |
| pH | 0.77 | 0.77 | 0.67 | 0.55 |
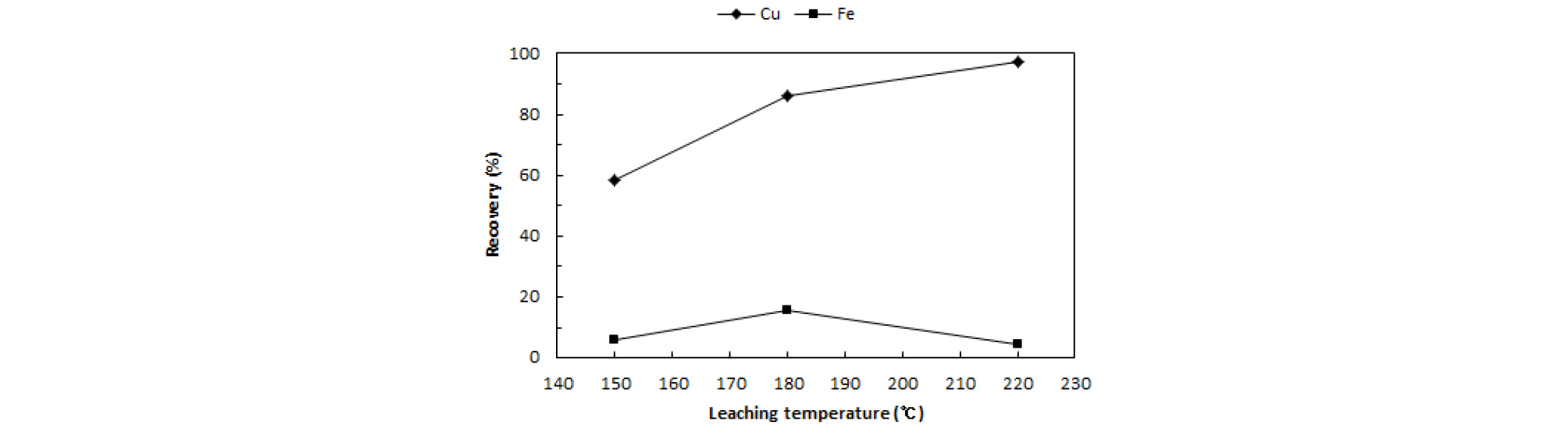
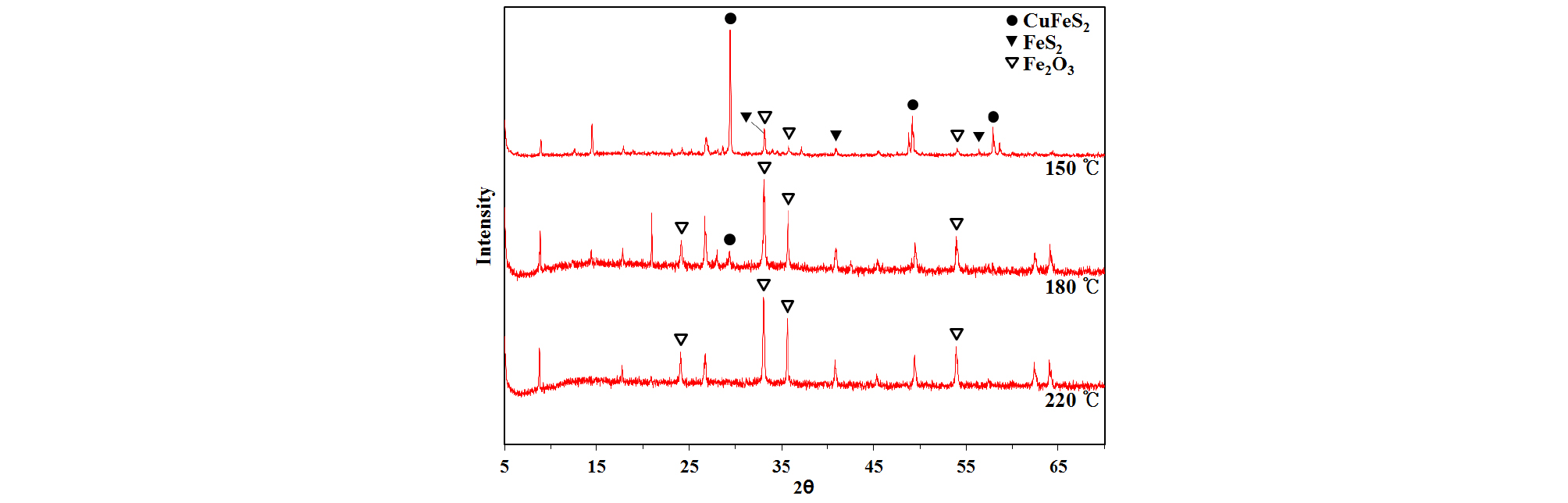
Fig. 7은 침출온도 증가에 따른 Cu와 Fe의 침출율 변화를 나타내었다. 침출온도를 150°C에서 220°C로 증가함에 따라 Cu의 침출율은 점차 증가하였으며, 산소압력이 침출된 Fe 이온을 산화시키기에 충분하였기 때문에 용액 내 Fe의 농도가 낮게 나타난 것으로 볼 수 있다. 침출잔사의 XRD 분석결과(Fig. 8)로부터 150°C에서는 황동석 및 황철석은 분해되지 않고 침출잔사 내에 적철석과 함께 존재하는 것을 확인하였으며, 180°C에서 황철석은 완전히 분해되어 침출잔사에는 적철석만 존재하는 것을 알 수 있었다. 하지만 180°C에서도 침출잔사에는 황동석이 일부 남아있고, 산소압력 25 atm, 침출시간 1시간 조건에서는 침출온도 220°C가 되어서야 잔사에 존재하지 않음을 확인하였다. 침출온도 증가로 인해 보다 많은 황화물이 분해되기 때문에, pH는 온도를 증가시킴에 따라 크게 감소하였다(Table 4).
Table 4. pH of leaching solution with various leaching temperatures (H2SO4 5 g/L, pulp density 10% (w/w), time 60 min, PO2 25 atm)
| Leaching temperature (°C) | 150 | 180 | 220 |
| pH | 1.26 | 0.67 | 0.55 |
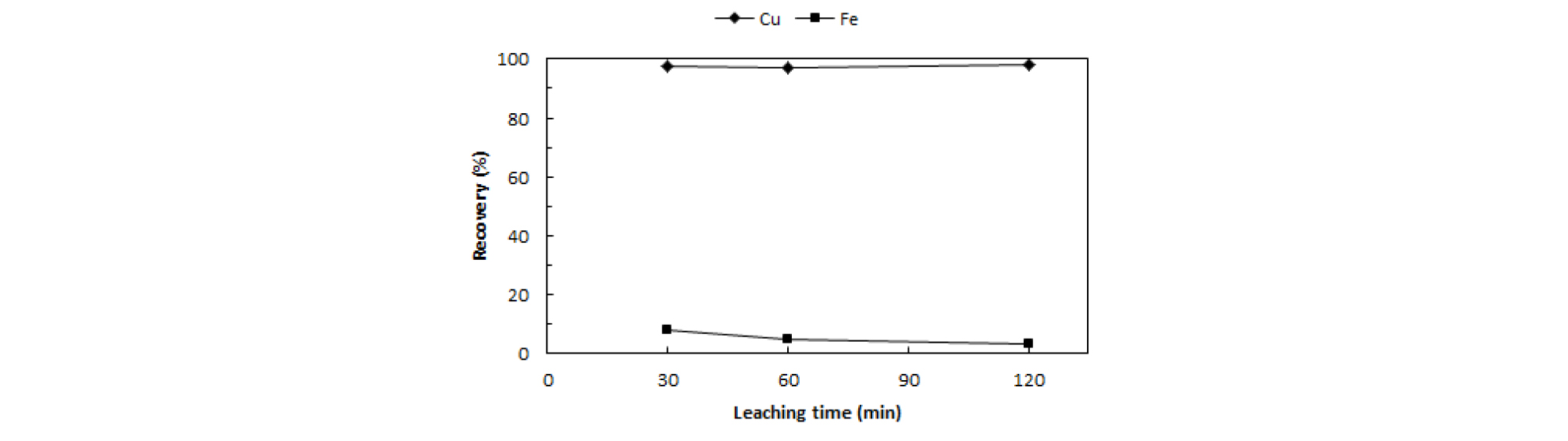
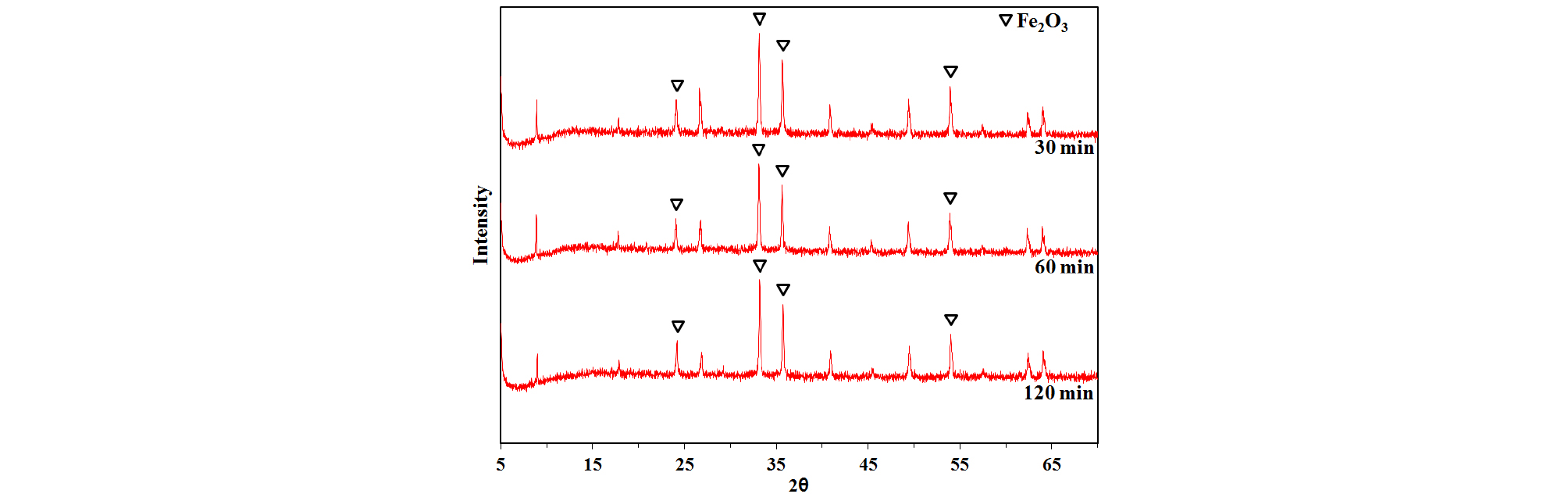
Fig. 9는 침출시간 증가에 따른 Cu와 Fe의 침출율 변화를 나타내었다. 침출시간을 30분에서 120분으로 증가함에 따라 Cu 침출율은 97%~98% 이상으로 거의 일정하였으며, Fe 침출율은 7.98%에서 2.93%로 조금씩 감소하기는 하였으나 큰 변화는 없었다. 따라서 본 실험조건에서 침출시간은 침출율에 큰 영향을 미치지 않았으며, 대부분의 황동석 및 황철석이 분해됨과 동시에 침출된 Fe 이온이 침전하는 반응시간은 30분 정도면 충분한 것으로 판단된다. 침출잔사의 XRD 분석결과(Fig. 10)로부터 황동석은 존재하지 않고 Fe가 적철석 형태로 남아있는 거의 동일한 spectrum을 확인할 수 있다. pH 측정결과(Table 5)로부터 침출시간이 증가됨에 따라 pH는 거의 일정함을 볼 수 있었다.
Table 5. pH of leaching solution with various leaching times (H2SO4 5 g/L, pulp density 10% (w/w), PO2 25 atm, temp. 220°C)
| Leaching time (min) | 30 | 60 | 120 |
| pH | 0.5 | 0.55 | 0.56 |
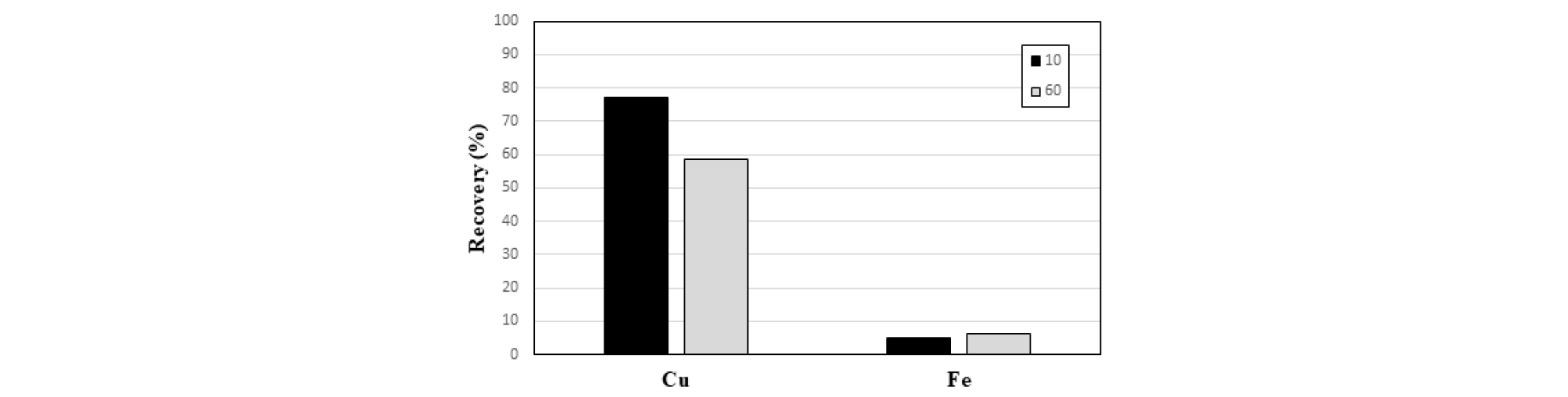
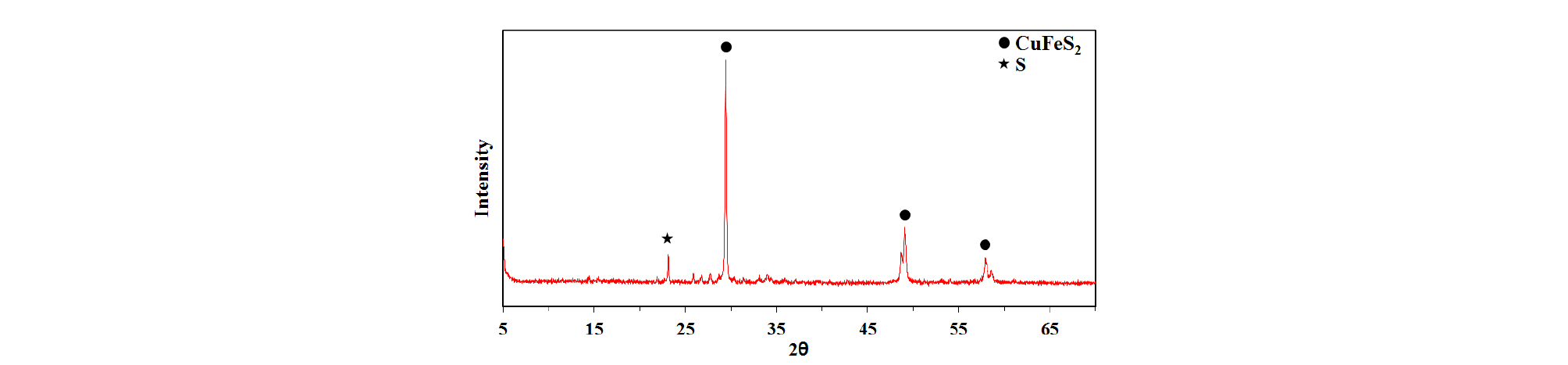
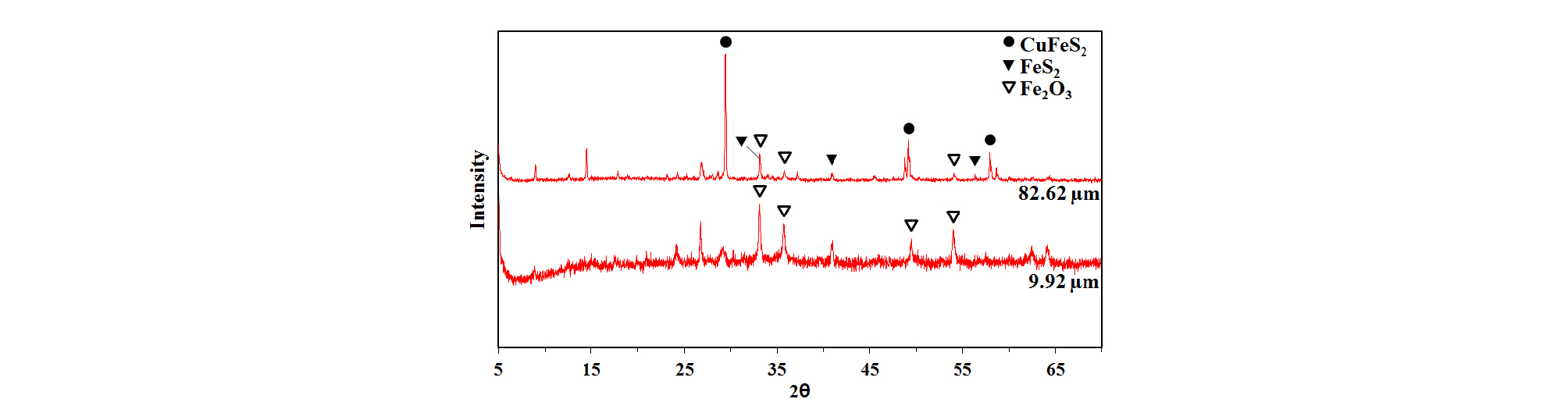
Fig. 11은 시료입도에 따른 Cu와 Fe의 침출율 변화를 나타내었다. 산소압력 25 atm, 침출온도 150°C, 침출시간 1시간 조건에서 시료입도 변화에 따른 Cu와 Fe의 침출율 그래프에서 D90이 9.92 µm인 초미립시료와 82.62 µm인 시료의 Cu 침출율은 각각 77.35%, 58.60%로 보다 미립의 시료에 대한 Cu의 침출율이 더 높았으며, Fe의 침출율은 각각 5.13%, 6.10%로 Fe 침출율 차이는 거의 없었다. 초미립시료는 침출반응 후 황동석이 존재하지 않는 침출잔사와 함께, 주로 황동석으로 이루어지고 황을 함유하는 직경이 2~3mm 정도인 구형의 응집물질을 생성하였다. 이러한 현상은 용융점이 약 119°C인 황이 본 실험의 온도조건에서 액체상태의 용융황(molten sulfur)으로 형성되어 미반응(un-reacted) 황동석 입자를 응집시킨 것으로 보여지며, McDonald와 Muir(2007b)의 연구에서도 침출잔사의 응집현상이 언급되었다. Fig. 12는 응집된 덩어리만을 채취한 사진이며, 황동석 표면에 응집되는 황은 염화물 또는 계면활성제와 같은 첨가제의 첨가로 분산시켜 보다 높은 Cu 침출율이 가능할 것으로 사료된다. Table 6에는 시료입도에 따른 침출액의 pH를 나타내었으며, 두 개의 실험조건 모두 황화물의 완전한 산화반응이 이루어지지 않았기 때문에 pH는 비교적 높았다. Fig. 13은 응집물질의 XRD 분석결과를 나타내며, 응집물질은 황동석 입자 및 황으로 이루어져 있음을 확인하였다. 나머지 응집되지 않은 침출잔사는 XRD 분석결과 Fig. 14로 부터 황동석 및 황철석은 분해되어 잔존하지 않고 Fe는 적철석 침전물 형태로 존재함을 볼 수 있다.
Table 6. pH of leaching solution with two particle sizes (H2SO4 5 g/L, pulp density 10% (w/w), PO2 25 atm, temp. 150°C, time 60 min)
| D90 (𝜇m) | 10 | 60 |
| pH | 1.36 | 1.26 |
결 론
한국광물자원공사가 자체 개발한 산소가압침출기 파일럿 플랜트(회분식, 50 L)를 이용한 황동석 정광의 산소가압침출 실험으로부터 다음과 같은 결과를 얻었다.
(1)입도크기 D90 82.62 µm인 황동석 정광 2 kg을 황산농도 5 g/L, 광액농도 10%(w/w), 침출온도 220°C, 침출시간 60분, 산소압력 25 atm에서 침출 시 Cu는 97.17%가 침출되었으며, 대부분의 Fe는 적철석 행태로 침전되었다.
(2)황산농도 5 g/L, 광액농도 10%(w/w), 침출시간 60분, 산소압력 25 atm에서 대부분의 황동석이 침출되는 온도는 220°C였으며, 황철석은 180°C에서 완전히 분해되었다. 모든 온도에서 침출된 Fe는 적철석 형태로 침전되었다.
(3)황산농도 5 g/L, 광액농도 10%(w/w), 침출온도 220 °C, 산소압력 25 atm에서 침출 시 대부분의 황동석 및 황철석은 30분 이내에 침출되었다.
(4)황산농도 5 g/L, 광액농도 10%(w/w), 침출시간 60분, 산소압력 25 atm, 침출온도 150°C에서 초미립시료(D90 9.92 µm) 침출 시 Cu 침출율은 77.35%이었으며, 반응 후 황동석 및 황을 함유하는 응집물질을 생성하였다. 이는 용융황에 의한 미반응 황동석 입자의 응집현상에 기인한다.
(5) 침출잔사의 XRD 분석결과 및 침출액의 pH 변화 특성을 통하여 산소가압하에 150°C 이상의 침출조건에서 황동석 침출반응은 주로 산소의 산화작용에 의한 분해인 것을 확인하였으며, 220°C에서 황은 모두 황산염 형태로 산화되어 단체황 생성으로 인한 부동태 현상은 일어나지 않은 것으로 판단된다.