서 론
실험방법
미생물 농화배양 및 비소 독성평가
Akaganeite 나노입자 제조
컬럼 실험
측정 및 분석항목
결과 및 해석
미생물에 대한 비소 독성평가
유리 비드 컬럼 실험
자연 토양 컬럼 실험
결 론
서 론
생태계 내 비소(As) 노출과 독성의 영향에 대해서는 널리 알려져 있다(Hughes et al., 2011)7. 특히 As는 인위적 오염 이외에 자연적 기원에 의한 오염의 심각성이 부각되는 독성 원소이며 최근 As로 오염된 대수층이 전 세계적으로 보고되고 있다. As로 오염된 지하수는 방글라데시 외에 대만, 인도, 베트남, 중국 등을 포함한 아시아 지역뿐만 아니라 캐나다, 미국, 멕시코, 칠레, 아르헨티나 등의 북남미 지역과 독일 등의 유럽 지역까지 분포한다(Smedley and Kinniburgh, 2002; Driehaus, 2002)20. 국내의 경우도 서해안 지역의 충적 대수층에서 As 오염이 보고된 바 있다(Kim et al., 2009)12. 이러한 지질학적 기원 As 오염의 문제점은 점 오염원인 인위적 오염원에 비하여 매우 넓은 범위에서 발생하므로 오염원의 사전 처리가 거의 불가능하다는 것이다. 이러한 이유로 As로 오염된 지하수를 처리하는 그간의 연구는 오염된 지하수를 지중에서 직접 처리하는 방법인 point-of-entry (POE) 처리보다 최종 사용자에게 공급되는 물을 정화하는 point-of-use(POU) 처리에 주로 집중되어 왔다(Dhadge et al., 2018; Phillips et al., 2018; Silva et al., 2018; Shakya and Ghosh, 2019)4,17,18.
다양한 독성 물질로 오염된 대수층 및 토양을 원위치에서(in situ) 경제적으로 처리하는 방법으로서 나노물질을 이용하는 기술은 많은 관심을 받고 있다(Karn et al., 2009)9. 대수층을 오염시킨 As를 원위치에서 처리할 수 있는 방법을 모색하기 위하여, Kim et al.(2011b)11은 컬럼 내에 유리 비드(bead)를 충진하고 As(III) 용액으로 오염시킨 후 미생물과 Pd-akaganite(β-FeOOH) 나노입자를 주입하였다. 미생물과 나노입자를 동시에 주입한 경우 32일 경과 시 약 84%의 높은 As 제거효율을 얻었으며, 이는 금속 환원을 유도하는 것으로 알려진 미생물인 Clostridium sp.에 의해 akaganite의 Fe(III)가 Fe(II)로 환원되며 자철석(magnetite) 나노입자를 형성하고 용존 As가 이에 흡착되었기 때문인 것으로 해석하였다. 이 결과가 실제 자연 환경에 효과적으로 적용된다면 금속환원균과 철 나노입자를 대수층에 주입할 경우 최종 사용자에게 공급되는 지하수 내의 As 함량을 대폭 저감할 수 있다.
유리 비드 매질에서의 As(III) 반응을 관찰한 Kim et al.(2011b)11의 연구를 확장하여 추가적으로 As(V)와의 반응 그리고 자연 토양에서의 반응 결과를 살펴 볼 필요가 있다. As는 Fe, Mn 등과 마찬가지로 서로 다른 산화수(As(V) 및 As(III))로 존재하며 산화수에 따라 상이한 지구화학적 특성을 갖는 원소이다. 따라서 중성 pH 조건에서 H3AsO30로서 전하를 갖지 않는 As(III)와 비교하여 동일한 조건에서 H2AsO4- 및 HAsO42- 등의 음이온 형태를 띠는 As(V)의 거동에 관한 파악이 필요하다. 지하 대수층의 경우 환원환경이 조성되기 쉬우므로 용존 As는 주로 As(III)로 존재할 것이나 As(V) 역시 검출되는 예가 다수 보고되고 있다(Kim et al., 2002; Nguyen et al., 2009)13,15.
우리나라와 같은 결정질암 대수층 내에서 지하수는 주로 열극 또는 절리면의 알루미늄 규산염 광물과 접하며 이동한다. 유리 비드는 알루미늄 규산염 광물이 주를 이루는 심부 결정질 대수층 암반을 모사할 수 있다. 그러나 최근에는 토양의 오염 처리에 나노물질을 이용하려는 시도가 많이 있으며 따라서 나노물질에 의한 As 제거 효과가 토양에도 적용될 수 있을지의 여부를 확인하는 것은 중요하다. 토양층 내에서 나노물질을 이용하여 각종 오염물질을 처리하기 위한 다양한 실험들은 주로 모래를 사용하여 수행되었다(Hydutsky et al., 2007; Doshi et al., 2008, Chrysochoou et al., 2012)8,5,2. 그러나 토양층을 구성하는 광물학적 ‧ 물리적 ‧ 화학적 성분은 심부 대수층 암석에 비하여 매우 복잡할 뿐만 아니라 점토광물, 철 (수)산화물, 유기물질 등의 반응성이 큰 물질들로 이루어져 있다. 따라서 토양에서의 As 및 나노물질 이동은 점토광물 및 유기물 흡착 등과 같은 화학적 측면과 미사 및 점토 함량 증가에 의한 토양 투수성 변화 등의 물리적 측면에 크게 영향받을 것으로 생각한다.
따라서 이 연구에서는 컬럼을 사용한 Kim et al.(2011b)11의 실험 방법을 기본으로 하여, ① 오염물질이 As(V)인 경우와 ② 유리 비드뿐만 아니라 자연 토양층에 적용할 경우 As 저감 효과가 발생할 수 있는지의 여부를 알아보고자 하였다. 이를 위하여 Kim et al.(2011b)11이 암반 대수층을 모사하기 위하여 사용한 유리 비드 충진 컬럼 뿐만 아니라 자연 토양으로 충진한 컬럼 실험을 구성하였다. 컬럼 구성은 비교(control) 컬럼, 미생물 주입 컬럼, 나노입자 주입 컬럼, 미생물과 나노입자를 동시에 주입한 컬럼으로 구분한 후 그 효과를 비교하였다.
실험방법
미생물 농화배양 및 비소 독성평가
이 실험에서 사용한 미생물은 Kim et al.(2011b)11과 동일하게 통성(facultative) 혐기성균인 Clostridium sp.(Haejae-1)으로서 이는 갯벌 퇴적물로부터 분리, 농화 배양하였다. 이 미생물은 포도당을 이용하여 발효(fermentation) 성장하는 동안 Fe(III)를 환원하고, akaganeit(β-FeOOH)를 자철석(FeO ‧ Fe2O3)으로 환원성 변환하는 것으로 보고된 바 있다(Kim et al., 2011b)11. 미생물은 25°C, 150 rpm 조건에서 1 L 당 효모추출물 0.5 g, NaHCO3 2.5 g, CaCl2 ‧ 2H2O 0.08 g, NH4Cl 1 g, MgCl2 ‧ 6H2O 0.2 g, NaCl 10 g, HEPES 7.2 g, trace minerals 10 mL, vitamin solution 1 mL의 배양액에 포도당 10 mM, Fe(III) citrate 5 mM을 주입하여 3일간 배양 후 실험에 사용하였다.
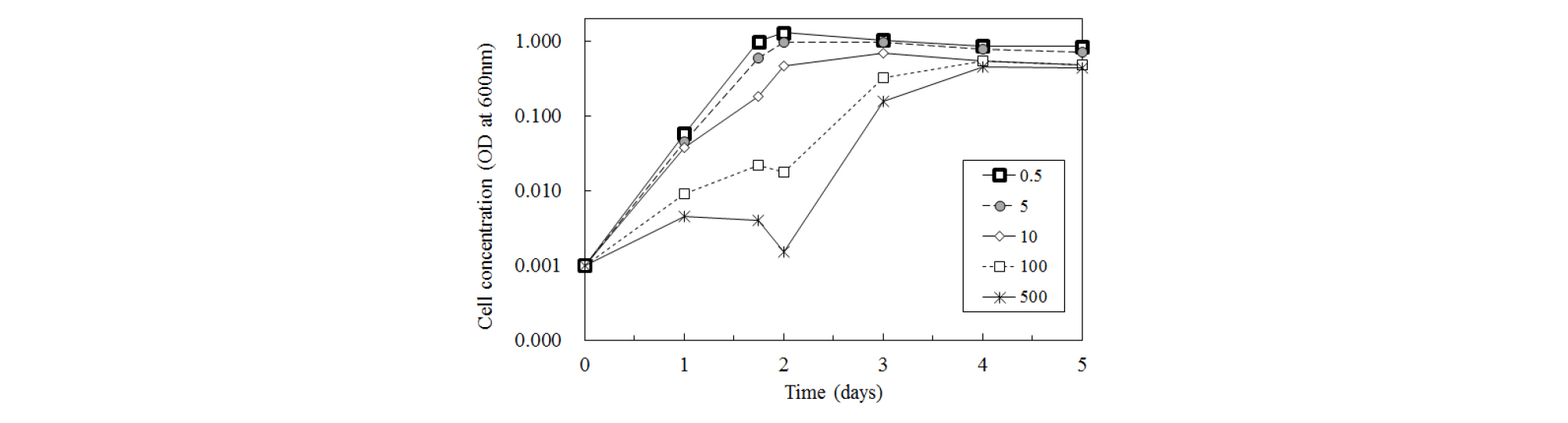
실험에 사용한 미생물에 대한 용존 As(V)의 농도별 독성을 파악하기 위하여 As(V)를 다양한 농도로 위 배양액에 용해한 후 미생물의 성장을 조사하였다. 이를 위하여 위 배양액에 0.5~500 mg/L의 농도 범위로 As(V)를 용해하여 주입한 후 포도당 10 mM, 지수성장기의 미생물 2 mL을 포함하여 최종 부피 100 mL로 하였다. 질소(N2)로 purging하여 혐기적 조건을 조성하였으며 25°C, 200 rpm 조건에서 5일간 배양하였다. 시간에 따라 시료를 채취한 후 UV-vis(Shimadzu MINI 1204)를 이용하여 600 nm 조건에서 광밀도(optical density)를 측정하였다.
Akaganeite 나노입자 제조
실험에 사용한 akaganeite 나노입자는 0.5 M FeCl3 ‧ 6H2O를 NaOH(10 M) 수용액으로 pH 7까지 적정하여 침전된 갈색 침전물을 원심분리하여 회수한 후 탈이온수로 3회 세척하여 얻었다. 합성된 나노입자는 5~15 nm 크기의 결정질 형태를 보였다(Kim et al., 2011b)11.
컬럼 실험
실험에 사용한 컬럼은 두께 10 mm, 길이 430 mm, 지름 70 mm(약 1.6 L 부피)로 아크릴로 제작하였다. 컬럼의 옆면에 80 mm 간격으로 각각 4 cm 관이 설치된 4개의 밸브를 설치하여 나노입자 및 미생물을 주입할 수 있도록 하였다. 실험 전에 중성세제 및 탈이온수로 세척하였으며 자외선을 3시간 이상 조사하여 멸균하였다.
컬럼 내부를 충진할 다공성 매질체로는 1 mm 입경의 유리 비드(Glastechnique, Germany)를 사용하였다. 실험에 사용한 유리 비드는 sodalime glass로 제조되었으며 다음과 같은 조성을 가졌다: SiO2 70.5%, Na2O 9.0%, K2O 8.0%, CaO 4.0%, MgO 1.5%, Al2O3 1.5%, B2O3 1.5%, Fe2O3 1.0%, ZnO 3.0%, PbO < 0.01%. 컬럼에 충진하기 전 10% HNO3를 이용하여 세척 후, 탈이온수를 이용하여 산을 중화시키며 여러 번 헹구었다. 60 °C에서 24 시간 이상 건조 후, 121 °C에서 15분간 고압멸균(autoclave)하여 유리 비드 표면의 미생물학적 간섭을 제거하였다. 실험에 사용하기 전까지 3 시간 이상 자외선 조사한 후 실험에 이용하였다.
컬럼 내부에 충진한 토양은 경상북도 봉화군 풍정광상 주변의 밭토양을 이용하였다. 시료는 10일간 자연 건조 후 입경 2 mm 이하의 토양을 준비하였다. 실험에 사용한 토양은 모래 84.4%, 미사 15.4%, 점토 0.2%의 토성으로 양질사토에 속하며, pH는 5.7, 양이온교환능력은 6.25 meq/100 g, 작열감량(loss-on-ignition)으로부터 계산한 유기물 함량은 11.2%이었다. As 농도(-80 mesh 기준)는 왕수 분해 후 330 mg/kg, 1 N HCl 분해 후 12 mg/kg이었다. Fe 농도는 0.20%, Mn 농도는 130 mg/kg이었다. 이외에 왕수 분해 결과, Pb 305 mg/kg, Cd 1 mg/kg, Cu 11 mg/kg, Zn 22 mg/kg의 함량을 나타내었다. 고압멸균 후 컬럼에 충진된 토양의 양은 1957±15 g이었으며 충진된 컬럼은 컬럼 스탠드에 고정하고 수평계를 이용하여 수평을 유지하였다.
As(V)가 함유된 위 배양액을 20 L 이상의 대용량 수조로부터 연동식 펌프(Masterflex, USA)를 이용하여 컬럼에 상향식으로 공급하였으며 일정 시간 간격으로 삼출수 시료를 채취하였다. 컬럼 구성은 비교 컬럼, 미생물 주입 컬럼, 철 나노입자 주입 컬럼, 미생물과 철 나노입자를 동시에 주입한 컬럼 등의 4개로 구성하였다. 이를 위하여 먼저 컬럼에 고압멸균한 탈이온수를 72 시간 이상 통과하게 한 후 As(V) 용액을 주입하였다. As(V) 용액은 위에서 기술한 미생물 배양액에서 효모추출물만 제외한 용액에 Na2HAsO4 ‧ 7H2O 시약을 용해하여 사용하였으며 주입 농도는 0.5 mg/L로 하였다.
컬럼 삼출수의 전기전도도 변화를 측정한 결과, As(V) 용액을 주입한 후 약 40 시간 경과하였을 때 컬럼 내부가 As(V) 용액으로 완전히 포화된 것으로 판단하였으며 이후 미생물과 나노입자를 주입하였다. 미생물과 나노입자는 가장 하단 밸브(컬럼 상단으로부터 320 mm 이격)에 주입하였으며 비소 농도 희석을 보정하기 위하여 비교 컬럼에는 미생물 배양액을 동일량 주입하였다. 미생물 주입 시에는 농화배양한 지수성장기의 미생물 18 mL에 0.1 M의 포도당 2 mL을 혼합하여 포도당의 최종농도를 10 mM이 되도록 한 후에 주입하였다. 컬럼에 주입시 주사기를 이용하였으며 주사기 내부에 공기방울이 유입되지 않도록 하였다.
측정 및 분석항목
삼출수 시료를 주기적으로 채취하여 YSI 556MPS를 이용하여 pH, 전기전도도, 용존산소 등을 측정하였으며, 총 용존 As 농도, As(III) 농도를 정량하였다. 미생물을 주입한 컬럼 시료는 0.2 µm, 나머지 시료는 0.45 µm로 여과 후 As 농도를 분석하였다. As의 화학종 분리를 위해 음이온 카트리지(LC-SAX, Supelco, USA)를 사용하였으며, As(V) 농도는 총 용존 As 농도에서 측정한 As(III) 농도를 뺀 값으로 계산하였다. 화학분석은 광주과학기술원의 ICP-OES(Optima 5300 DV, Perkin Elmer)를 이용하였으며 이때 As의 측정한계(detection limit)는 0.005 mg/L이었다.
결과 및 해석
미생물에 대한 비소 독성평가
다양한 농도의 As(V)에 대한 Clostridium sp.(Haejae-1) 내성 실험 결과, 주입한 As(V)의 농도가 증가할수록 미생물의 성장이 제한되는 경향을 보였다(Fig. 1). 즉 0.5 mg/L 및 5 mg/L 농도의 As(V)를 주입하였을 때에 비하여 10 mg/L의 As(V) 조건에서는 정지기(stationary phase)에 이르는 기간이 1일 정도, 100 mg/L 이상의 농도에서는 추가로 2일 정도 지연되었다(Fig. 1). As(V)는 대사작용에 필수적인 인산이온(PO43-)과 화학적으로 매우 유사하여 생물체 내로 흡수되며, 세포 내에서 에너지를 생산하는 산화성 인산화(oxidative phosphorylation) 과정을 방해한다(Oremland and Stolz, 2003). 독성 평가를 통해 이번 실험에서 사용한 As(V) 농도인 0.5~1 mg/L는 Clostridium sp.(Haejae-1)의 생장에 심각한 장해를 유발하지 않음을 알 수 있었다.
유리 비드 컬럼 실험
유리 비드로 충진한 컬럼에 0.5 mg/L의 As(V) 용액을 주입한 결과, 7일에 이르는 실험 기간 내내 주입수와 컬럼 삼출수의 pH는 7~8 사이를 일정하게 유지하였으므로 컬럼 내에서 미생물의 활동, 나노입자와 As, 미생물과 As 사이의 반응 등이 pH 변화에 크게 영향을 미치지 못하는 것으로 보였다(자료 미기재).
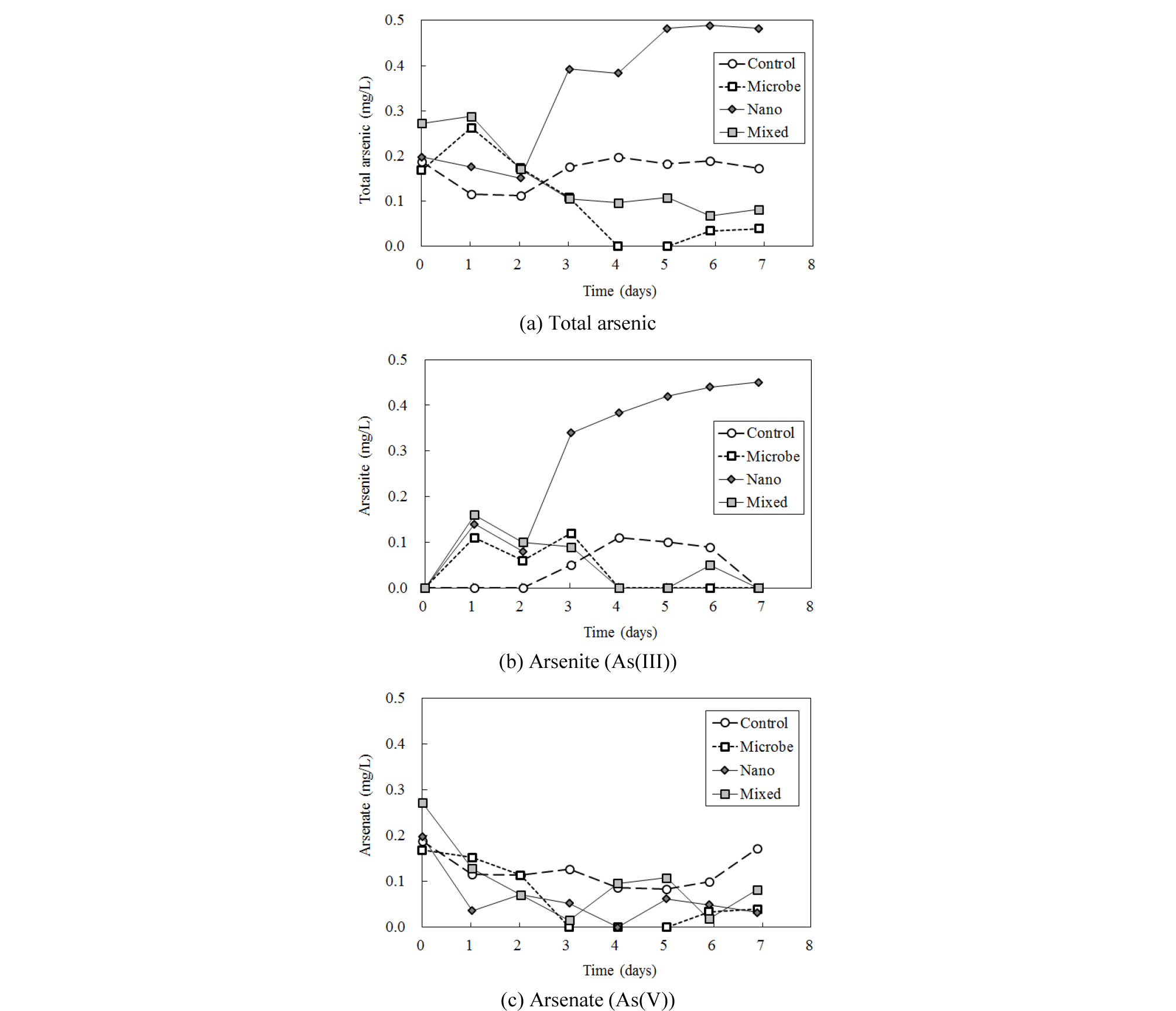
시간에 따른 비교컬럼, 미생물 컬럼, 철 나노입자 컬럼, 미생물과 나노입자 혼합 컬럼의 삼출수 내 총 As, As(III), As(V) 농도 변화를 Fig. 2에 나타내었다. 초기 삼출수 내 총 As 농도가 비교컬럼을 포함하여 0.17~0.28 mg/L로 감소한 것은 0.5 mg/L의 농도로 주입한 As(V) 일부가 유리 비드에 흡착되었기 때문으로 보인다. 모래를 이용한 기존의 용존 As 제거 연구들은 대부분 모래를 영가철 또는 철산화물 등으로 피복한 후 수행한 실험이며(Thirunavukkarasu et al., 2003; Leupin et al., 2005)21,14, As로 오염된 자연 지하수를 모래만으로 여과한 Berg et al.(2006)1의 경우도 지하수 중에 자연적으로 존재하는 철 성분의 산화에 의한 As 공침전을 연구한 것으로서 유리 비드와 As(V) 간의 흡착에 관한 연구는 아직 수행된 바 없다. 동일 조건에서 As(III)을 주입한 Kim et al.(2011b)11에서는 이러한 유리 비드에 의한 용존 As(III) 제거를 관찰할 수 없었다. 전하를 띠지 않는 As(III)에 비하여 음전하를 띠는 용존 As(V)의 특성 및 주입액에 포함되어 있는 미생물 배양액의 각 성분들이 유리 비드 표면 흡착에 미치는 영향을 규명하는 연구가 필요하다.
비교컬럼의 경우 시간에 따라 약간의 변이가 있으나 대체적으로 초기 As 농도를 유지하는 반면, 미생물 또는 미생물+나노입자가 주입된 컬럼에서는 3일 경과 후 비교컬럼에 비하여 낮은 총 As 농도를 나타내었다. 이러한 결과는 특히 미생물만 주입한 컬럼에서 두드러져 4일 경과 후부터는 < 0.04 mg/L의 총 As가 배출되었다(Fig. 2(a)).
그러나 철 나노입자만 주입한 컬럼에서는 다른 컬럼에 비하여 매우 다른 결과를 보였는데, 3일 경과 후부터 급격히 높은 총 As 함량이 나타났으며 7일 경과 후에는 주입 농도에 가까운 0.48 mg/L의 As가 배출되었다. 이러한 높은 농도의 As는 대부분 As(III)의 형태로 존재하였다(Fig. 2(b),(c)). 실험 경과 7일 후, 미생물 주입 컬럼의 경우 배출된 총 As 농도는 비교컬럼의 23%, 미생물+나노입자 주입 컬럼은 48%의 비율을 보였으나 나노입자만 주입한 컬럼에서는 280%가 배출되었다. 이러한 결과는 Kim et al.(2011b)11이 동일한 조건에서 As(III)를 주입하였을 때 미생물 및 나노입자 컬럼에서는 비교컬럼과 비교하여 큰 차이가 없었고, 미생물+나노입자 주입 컬럼에서는 월등한 제거효과를 보인 것과는 다른 결과이다.
철 나노입자 컬럼에서 이러한 특이한 결과가 나타난 원인은 현재로서 알 수 없다. 결과만을 놓고 볼 때 가능한 첫 번째 해석으로는, 3일 경과 후부터 철 나노입자가 유리 비드 표면을 피복하여 추가적인 흡착을 방해하였기 때문에 주입액 중 As(V)가 대부분 배출되었다는 것을 예상할 수 있다. Kim et al.(2011a)10에 의하면 실험에 사용한 akaganeite 나노입자의 영전하점(point of zero charge)은 7.8로서 컬럼 내 용액의 pH가 7~8인 것을 감안하면 산화음이온인 As(V)가 정전기적 흡착(electrostatic adsorption)의 영향을 적게 받았을 가능성이 있다. 그러나 영전하점 이상의 pH에서 As(V) 흡착 농도가 두드러지게 감소한다고 해도 흡착은 역시 발생하며, pH 7.5 조건에서 Kim et al.(2011a)10은 akaganeite 1 g당 30 mg, Deliyanni et al.(2003)3은 134 mg의 As(V)가 흡착된다고 보고한 바 있다. 또한 이 연구에서는 저농도의 As(V)를 주입하였으므로 흡착에 의한 제거는 더욱 쉽게 발생할 수 있다. 이를 확인하기 위하여 25°C, 150 rpm 조건으로 As(V) 1 mg/L을 함유한 배양액에 40 mM akaganite 나노입자를 회분식으로 반응시킨 결과, 반응 24 시간 이내에 용존 As가 전혀 검출되지 않아, 철 나노입자에 의하여 As(V)가 모두 흡착, 제거됨을 확인하였다(자료 미기재). 따라서 위 해석에 대해서는 추가적인 고려가 필요하다. 두 번째 해석은 As(V) 용액으로 40시간 동안 컬럼을 사전 충진시키는 과정 중에 유리 비드에 흡착된 As(V)가 나중에 주입한 철 나노입자에 의하여 현재로서는 파악할 수 없는 메커니즘에 의해 탈착된 후 배출되었을 가능성을 들 수 있다. 이것이 사실이라면 아마도 철 나노입자와 As(V) 간의 경쟁적 흡착에 의한 가능성이 있으며, 철 나노입자-As(V)-유리 비드 간의 상호반응에 대해서는 보다 정밀한 추가 연구가 필요하다.
한편 각 컬럼에서 배출되는 As의 화학종이 환원상태인 As(III) 형태로 주로 나타났다. 삼출수에서 검출된 총 As 농도 중 비교컬럼의 경우 평균 47%, 미생물 컬럼의 경우 평균 59%, 철 나노입자 컬럼의 경우 평균 84%, 혼합 컬럼의 경우 평균 68%의 As(III) 비율을 보였다. 이는 상향식 주입 방식에 의해 컬럼 내부에 혐기적 조건이 형성되었기 때문으로 보이며, 철 나노입자를 주입한 경우 다른 컬럼에 비해 유리 비드 입자 사이의 유로를 폐색하는 경향이 있어 유속을 다소 감소시키기 때문에 다른 컬럼에 비하여 혐기적 환경을 상대적으로 용이하게 조성할 수 있었을 것이다.
용존 As를 흡착하여 제거하기 위하여 철 나노입자가 효과적으로 사용될 수 있다는 것은 널리 알려진 사실이다. 그러나 이 연구에서는 정확한 메커니즘은 아직 알 수 없으나 이미 유리 비드에 흡착되어 있는 As(V)가 철 나노입자의 후속 주입에 의하여 탈착할 가능성을 보였다. 이것이 사실이라면 철 나노입자 주입이 As(V)와 유리 비드 간의 흡착 반응을 저해하는 요소일 것이다. Akaganeite 나노입자와 As(V) 간의 이러한 반응이 지질학적 매질에도 적용된다면, 이는 유리 비드가 대표할 수 있는 지하 암반 대수층이 As(V)로 오염되었을 경우 철 나노입자의 주입이 도리어 기존 대수층 광물 표면에 As(V) 흡착을 방해하거나 이미 흡착되어 있을 As의 지하수 내 유입을 촉진할 수 있는 가능성을 나타낸다고 할 수 있다. 따라서 As(V)로 오염된 심부 결정질암 대수층에 철 나노입자를 적용하여 처리하려 할 경우, 지하수의 유로를 형성하는 열극면에 존재하는 광물에 대한 조사가 필요할 것으로 보인다.
자연 토양 컬럼 실험
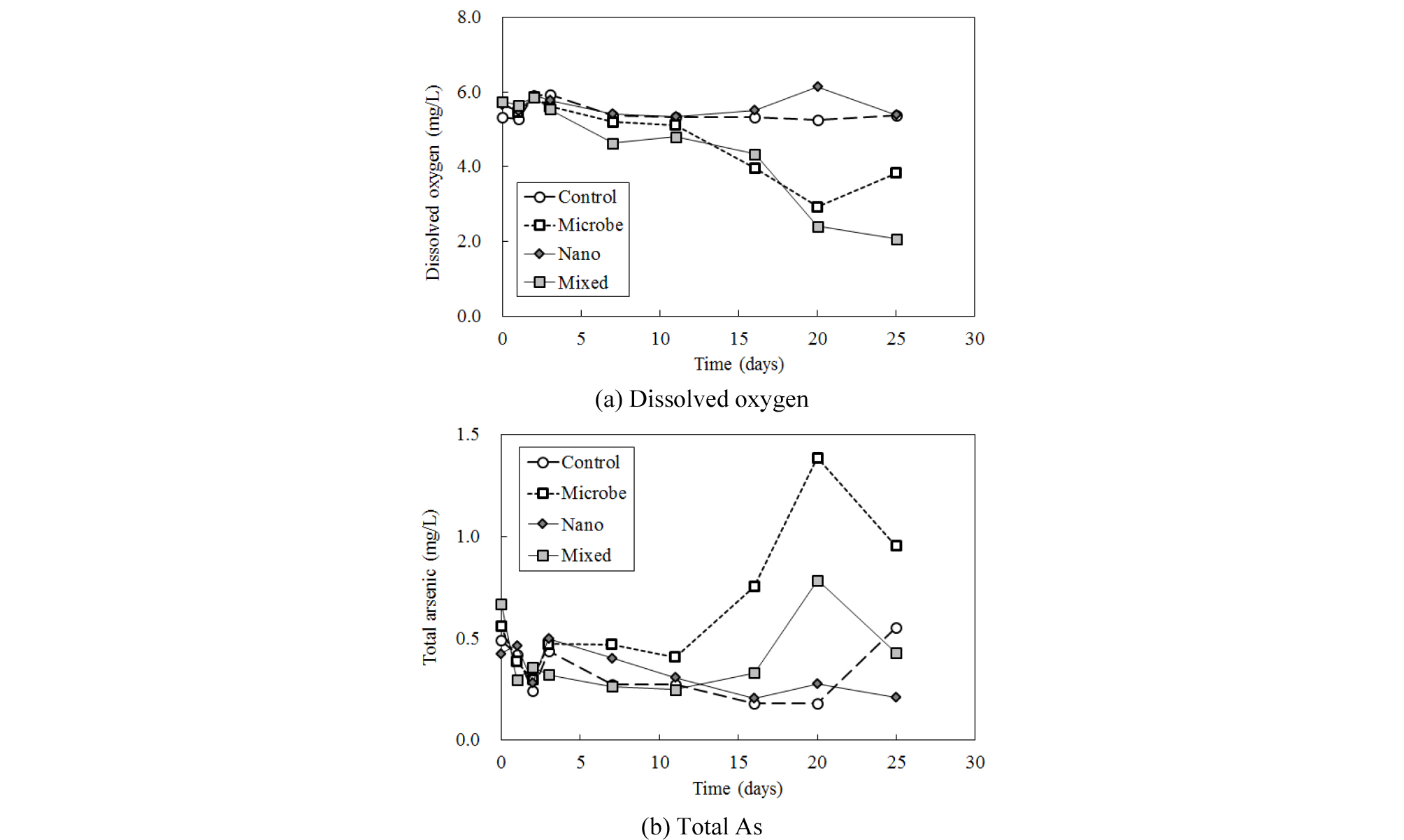
As로 오염된 풍정광산 토양을 충진한 컬럼에서 나온 삼출수를 대상으로 pH, 전기전도도, 용존 산소를 시간에 따라 측정한 결과 비교컬럼에서 나타난 변화와 매우 흡사하였다. pH는 비교시료를 포함한 모든 컬럼에서 시간이 경과함에 따라 증가하였다. 초기 pH 4.5~4.8에서 3일 경과 후 6.1~6.5로 증가하였으며 이후 점진적으로 증가하여 25일 경과 후 7.5~7.6을 나타내었다. 이는 토양 자체 pH 및 주입수로 사용된 배양액 내 HEPES의 pH 완충효과에 의한 것으로 보인다. 전기전도도는 초기 22~24 mS/cm에서 25일 경과 후 27~30 mS/cm로 소폭 상승하였다.
이처럼 시간에 따른 pH와 전기전도도 변화는 비교시료에 비하여 큰 차이가 없었으나 용존 산소 함량은 변화를 보였다. 용존 산소의 경우, 초기에는 거의 변화가 없었으나 실험 경과 10일 이후부터 시간이 지날수록 미생물 또는 미생물+나노입자를 주입했던 컬럼에서 감소하는 것이 관찰되었다(Fig. 3(a)). 이는 주입한 배양액에 의해서 Clostridium sp.(Haejae-1)가 활성화되었기 때문으로 보인다.
20일 경과 후 컬럼 내에서 총 용존 As의 농도를 살펴보면, 비교컬럼(0.18 mg/L)과 철 나노입자 주입 컬럼(0.28 mg/L)은 낮은 값을 나타내었으나, 미생물 주입 컬럼(1.39 mg/L)과 미생물+나노입자 혼합 주입 컬럼(0.79 mg/L)에서는 16일 경과 후부터 증가하여 한층 높은 값을 보였다(Fig. 3(b)). 미생물을 주입하였을 경우 용존 As 용출량이 증가한 시기가 용존 산소량의 감소 시기와 유사하게 발생한 것을 감안할 때 이는 아마도 용존 산소 감소에 따른 As(V)의 As(III)로의 환원 및 이에 따른 이동도의 증가와 관련있는 것으로 보인다. 한편 25일 경과 시에는 비교시료에서 용존 As 유출량이 증가하였으나(0.55 mg/L), 미생물 주입 컬럼(0.95 mg/L)과 혼합 주입 컬럼(0.43 mg/L)에서는 다시 감소하는 모습을 보였다.
비교컬럼에 비해 미생물을 주입한 컬럼의 경우, 주입한 As(V) 농도보다 월등히 높은 함량의 용존 As가 배출되었으므로 미생물이 컬럼을 충진한 토양으로부터 As를 추가적으로 용출하였음을 알 수 있었다. 이때 유리 비드를 충진한 컬럼 실험에서 나노입자를 주입하였을 때 총 용존 As 농도가 증가하였던 결과(Fig. 2)는 나타나지 않았으며, 오히려 철 나노입자를 미생물과 함께 주입한 경우 나노입자가 미생물에 의한 As 용출을 일정 부분 저감하는 결과를 보였다. 이러한 결과의 가장 큰 원인은 컬럼을 충진한 물질이 유리 비드가 아니라 자연 토양임에 기인할 것이다. 다양한 물질의 혼합체인 자연 토양과 나노입자 및 As(V) 간의 상호 반응이 단순한 광물학적 조성을 갖는 유리 비드와 대조적인 결과를 나타낸 것으로 판단한다.
한편 토양층에 나노입자를 주입할 경우 나노입자가 토양 입자 전체와 균일하게 반응할 수 있는지의 여부를 확인하는 것은 중요하다. 이 실험 결과에 의하면 암반 대수층의 유로와는 달리 토양층 내에서는 나노입자가 오염 토양 입자 대부분과 반응하기를 기대하기는 어려운 것으로 나타났다. 이는 유리 비드와 토양으로 충진한 두 컬럼에서의 나노 입자 유동 상태를 보면 육안으로 확연히 드러났는데, 투수성이 좋은 유리 비드에서는 나노 입자의 효과가 균일하게 작용하여 거의 대부분의 컬럼을 충진하며 이동한 것과는 달리 토양 컬럼에서는 배양액을 상향 주입하였음에도 불구하고 물이 흐르는 특정 유로가 형성되어 나노입자의 작용이 국지적으로만 미친 것으로 나타났다(Fig. 4). 이러한 결과는 투수성이 좋은 모래로 충진한 그간의 대부분의 나노입자 반응 연구에서는 볼 수 없었던 것으로서 화학적 반응성이 좋은 나노입자라 할지라도 토양 내 투수성이 충분히 확보되지 못하면 기대한 만큼의 효과를 얻을 수 없을 가능성을 나타낸다.
이는 주로 열극이나 절리 등을 통해 오염물질이 이동하는 결정질 암반 대수층의 경우 나노입자 투입의 원래 효과를 기대할 수 있으나, 자연 상태의 오염 토양에 오염 저감을 위해 나노입자를 주입할 경우, 주입한 나노입자가 토양 내 공극으로 골고루 분산되어 충분한 정화 효율을 나타낼 수 있는지의 여부가 중요함을 나타낸다. 즉 As를 처리하는 철 나노입자의 화학적 특징뿐만 아니라 오염 토양 내에서 나노입자가 충분히 분산하여 작용할 수 있는 물리적 이동에 관한 수리역학적, 화학적, 광물학적 특성에 관한 부지특이적(site-specific) 선행 조사가 필요할 것이다.
결 론
Kim et al.(2011b)11은 As(III)로 오염된 유리 비드 충진 컬럼을 이용한 실험 결과, 미생물과 나노입자를 함께 주입하면 탁월한 As 저감 효과를 얻을 수 있음을 보였다. 이 연구는 As(III) 대신 As(V)로 오염된 경우 그리고 유리 비드 대신 자연 토양을 사용한 경우 동일한 As 저감 효과가 나타날지를 파악하기 위해 수행되었다.
As(V)로 오염된 유리 비드 컬럼의 경우, 미생물 및 미생물+나노입자를 주입하면 비교 컬럼에 비하여 다소 향상된 As 저감 효과를 보였다. 그러나 철 나노입자만 주입하면 다른 컬럼에 비하여 매우 높은 농도의 As가 배출되었으며 용존 As는 대부분 As(III) 형태로 존재하는 것으로 나타났다. 이에 대한 정확한 원인은 현재 알 수 없으나, 유리 비드가 없는 회분식 실험에서는 철 나노입자가 효과적으로 용존 As(V)를 흡착, 제거하였음을 고려할 때, 유리 비드가 존재할 경우 철 나노입자가 유리 비드와 As(V) 간의 흡착 반응을 저해하는 요소인 것으로 보인다. 유리 비드가 규산염 광물이 주를 이루는 결정질 암반 대수층을 모사할 수 있으므로, As(V)로 오염된 대수층에 철 나노입자를 주입할 경우 As 저감 효과가 기대한 대로 발생하지 않을 가능성도 있음을 나타낸다.
유리 비드 대신에 As로 오염된 자연 토양을 충진한 컬럼의 경우, 미생물 또는 미생물+나노입자를 주입한 경우 토양 자체로부터 As를 추가로 용출시키며 다른 컬럼에 비해 높은 농도의 As가 유출되었다. 이러한 결과는 미생물의 대사작용 결과 용존 산소 함량이 감소하는 시기와 일치하는 것으로 보아 아마도 As(III)로의 환원에 의한 것으로 보인다. 유리 비드 컬럼에 나노입자를 주입한 결과 보였던 As 함량 증가 현상은 토양 컬럼에서는 관찰되지 않아 철 나노입자가 반응하는 지질 매질에 따라 다른 결과를 유발할 수 있음을 나타내었다. 한편 토양 컬럼에서는 주입한 나노물질이 국지적인 특정 유로로 한정되어 이동하는 모습을 보여 현장 적용시 나노물질의 화학적 유효성과 아울러 토양층의 광범위한 투수성 확보 역시 필요할 것으로 보인다.