서 론
황동석 부동태층 생성반응
황동석 부동태층 모델링
황동석의 침출저해 및 부동태의 원인에 대한 다른 의견
부동태층으로 인한 침출저해 해결 방안
고온성 미생물
pH 제어를 통한 Jarosite 생성 억제
첨가제 또는 외부 전극물질
외부전극을 이용한 환원성 침출
Jarosite 물리적 제거
광화학 반응
향후 연구주제
결 론
서 론
현재 매장된 Cu가 대부분 황동석(CuFeS2)의 형태이지만, 황동석내 Cu는 저품위이고 내화성이 강하며 침출속도가 늦어 회수가 어렵다 (Debernardi and Carlesi, 2013; Panda et al., 2015). 특히 Cu 생물학적 침출은 Chalcocite와 같은 2차 Cu 황화광이 저품위로 존재할 경우 적용성이 양호하여 상용화가 매우 활발하지만 황동석 생물학적 침출은 그렇지 못하다 (Panda et al., 2015). 생물학적 침출이 부진한 가장 직접적인 원인 중 하나는 침출 중에 형성되는 부동태층(Passivation layer)의 존재로 인식되고 있다(Deber-nardi and Carlesi, 2013; Klauber 2008; Li et al., 2013; Nicol et al., 2017). 부동태(Passivation)란 일정 조건하에서 어떤 물질의 화학적 반응성이 감소된다는 의미로 많이 쓰이는 용어이며, 부동태층은 부동태를 야기시키는 피막물질을 일컫는 용어이다. 참고로 부동태층은 원자차원의 매우 작은 두께로 웬만한 표면분석기술로도 관찰이 어렵다(Debernardi and Carlesi, 2013; Klauber 2008). 황동석 표면에 부동태층이 형성될 경우 광물내 Cu의 산화침출이 크게 저해를 받으며, 황동석의 성공적인 생물학적 침출을 위해서는 부동태층 관련 문제를 해결하는 것이 매우 중요하다고 대부분의 연구자들이 생각하고 있다(Debernardi and Carlesi, 2013; Klauber 2008; Li et al., 2013; Nicol et al., 2017).
황동석의 부동태층 성분은 여러 가지로 추측되고 있으나 기존 침출실험의 반응양론적 분석을 통해 주로 황화물로 구성되었다는 점은 확실시되고 있다(Debernardi and Carlesi, 2013; Klauber 2008; Li et al., 2013). 다만 성분이 일정한 형태의 화학식으로 표현되지 않은 non-stoichiometry 특성을 지니고 있어 그것이 구체적으로 어떤 성분인지 어떤 특성을 가지고 있는지는 단정적으로 기술하기 어렵다. 현재까지 알려진 결과로는 황동석 부동태층은 반응에 필요한 이온의 흐름을 막는 일종의 부도체 또는 Band gap이 매우 큰 반도체 물질로 작용하여 Cu 침출을 방해하게 된다는 것이다(Debernardi and Carlesi, 2013). 이러한 침출저해를 야기하는 부동태 층의 구성성분은 Jarosite와 S0(원소황)이 주로 언급되는데 이중 Jarosite의 영향이 특히 큰 것으로 알려져 있다(Debernardi and Carlesi, 2013; Li et al., 2013). S0은 침출저해효과는 비교적 덜 하나 화학적으로 안정하여 제거하기가 어렵다는 점이 문제이다.
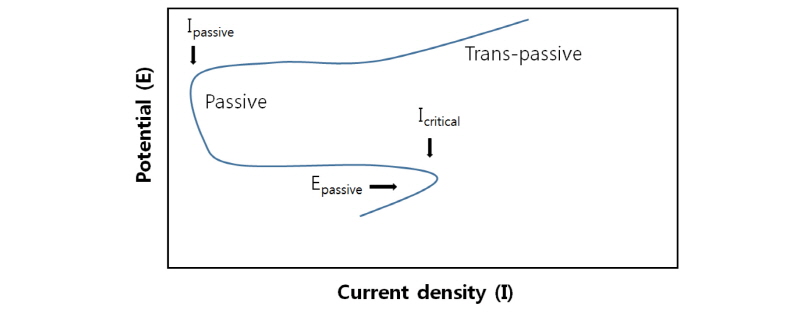
아직 표면분석에 의한 황동석 부동태층 관찰은 확실한 신뢰성을 가지고 있는지 못하는 실정이다. Parker et al. (1981)에 의해 황동석 표면에 피막된 복합황이 처음 관찰되었는데 이 당시에는 전압에 따른 전류의 증감을 통해 관찰한 것이다. Fig. 1을 보면 외부전압의 변화에 따라 전류밀도의 변화가 크게 변화한다는 것을 알 수 있다. 정상적인 산화침출이라면 전압의 증가에 따라 전류밀도도 같이 증가해야 하지만 부동태층이 형성되면 어느 전압에서 전류밀도가 급격히 감소하게 된다(Viramontes-Gamboa et al., 2007).
|
Fig. 1. A hypothetical anodic dissolution curve with passivation. Redrawn from Viramontes-Gamboa et al.(2007). |
Fig. 1에 부동태가 시작되는 전류밀도와 전위를 각각 Icritical과 Epassive로 표시하였고 부동태 발생시의 전류밀도를 Ipassive로 표시하였다. 이는 황동석에 전위를 가하면 침출로 인한 양극산화로 전류밀도가 증가하는 것이다. 그러다가 전위가 Epassive에 이르면 전류밀도가 Icritical에서 Ipassive로 갑자기 감소하는데 이는 부동태층의 형성으로 인한 침출저해를 나타낸다. 이러한 실험은 부동태의 존재 및 생성을 간접적으로 파악하는 데는 효과적이지만, 부동태층의 형상이나 이온의 저해과정을 있는 그대로 관찰하기는 힘들다. 황동석 부동태층의 연구는 중요성에 비해 아직 명확히 규명된 것이 많지 않아 이론 또는 학술적 견해에 대해 논란의 여지가 많다. 이런 경우에는 많이 인용된 최근 연구결과를 위주로 검토하고 정리하는 것이 효과적이다 따라서 본 연구에서는 생물학적 침출에서 황동석 부동태층 관련 주요 최근 연구문헌을 정리하여, 부동태 층의 형성 및 반응을 자세히 기술하고 대처 방안을 기술하였다.
황동석 부동태층 생성반응
황동석 침출반응 관련 가장 보편적으로 언급되는 반응식은 다음과 같다 (Debernardi and Carlesi, 2013; Li et al., 2013; Panda et al, 2015).
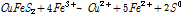 (1)
(1)
황동석내 Fe와 Cu의 산화침출시 부동태 관련해서 특히 중요하게 고려해야 할 점이 황동석내 S의 화학적 반응이다. 식 (1)에서는 광물내 S성분이 S0(원소황: 일반적 표기인 황 S과 구분하기 위해 첨자 0를 추가하였다)으로 산화되었음을 알 수 있는데 생성된 S0은 상당량이 광물표면에 축적된다. 다만 철/황산화 미생물은 궁극적으로 S0를 다시 SO42-로 산화하여 용해시킬 수 있다(Debernardi and Carles, 2013; Li et al., 2013). 이를 반응식으로 기술하면 다음과 같다.
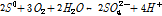 (2)
(2)
실제 황동석 부동태층 생성반응은 위와 같은 일반적인 식으로 기술하기에는 너무 복잡하다. 또한 일반적으로 다루는 침출반응은 금속의 산화에 초점을 맞추기 때문에 부동태층 같이 광물표면에서 발생하는 S 반응을 자세히 기술하지 않는다. 황동석 부동태층 관련 반응은 Harmer et al. (2006)이 제시한 3 단계 반응이 있는데 이는 다음과 같이 기술된다.
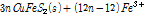
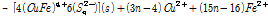
If n ≥ 2 (3A)
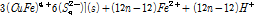
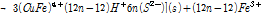 (3B)
(3B)
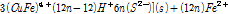
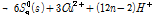 (3C)
(3C)
1 단계 식 (3A)에서 Cu2+와 Fe2+가 침출되고 S(Monosulfide)는 Polysulfide(복합황)로 전환된다. 이 후 2단계 식 (3B)에서는 Fe2+가 산화될 때 S2- 또는 Sn2-이 광물표면에 생성된다. 마지막 3단계에서는 Sn2-이 Sn0으로 전환된다. 즉 상기 반응에 따르면 부동태층은 Sn0로 구성되었을 수도 있다는 의미이다. 원소황의 화학적 결합형태도 다양해서 S8이 가장 많으며 가장 안정한 결합 형태를 지니고 있다는 사실이 실험적으로 관측되었다(Klauber et al., 2001; Parker et al., 2008). 또한 부동태층 생성반응은 Cu 또는 Fe 침출과 같은 반응조건에서 발생한다는 것을 알 수 있다. 전기화학적 측면에서 Fe3+/Fe2+비를 통해서 반응을 조절할 수 있으나, 부동태층 생성을 전위를 통해 억제할 경우 산화침출도 동시에 억제될 수 밖에 없다.
상기 반응식의 문제는 황동석내 Fe와 Cu가 서로 동일한 양이 침출되었다고 가정한 것이다. 실제 부동태층의 초기에는 주로 CuSn 성분이 많은데 이는 Cu와 S가 광물에서 Fe가 제일 먼저 침출되고 난 후 남은 물질이기 때문이다. Fe와 Cu의 침출속도차를 감안한 황동석 부동태층 화학반응식을 Hackl et al. (1995)이 다음과 같이 제시되었다.
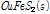
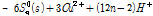 y ≫ x, x + y = 1 (4A)
y ≫ x, x + y = 1 (4A)
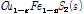
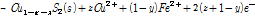
(4B)
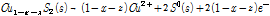 (4C)
(4C)
첫 번째 식(4A)은 황동석에서 Fe가 먼저 침출되어 (y≫x) 남겨진 Cu1-xFe1-yS2 (Metal deficient sulfides)가 부동태층이 되가는 과정을 나타낸 것이다. 두 번째 식 (4B)는 식 (4A)에서 침출되고 남겨진 Cu1-xFe1-yS2에서 나머지 Fe가 전부 침출되고 Cu1-x-zS2만 남은 것이다. 이때 부동태층의 성분은 CuSn 형태인데 이는 실제로 침출저해를 야기하는 것으로 알려져 있다(Hackl et al., 1995; Li et al., 2013). 마지막 식 (4C)에서는 두번째 반응에서 남겨진 CuSn에서 Cu가 침출되고 S0만 부동태층으로 남은 것이다. 즉 반응이 경과하면서 CuSn의 Cu와 S도 각각 Cu2+와 S0로 산화된다. 이후의 반응은 식 (2)에서와 같이 S0는 산화되어 SO42-로 전환된다. 여기서 감안해야 할 점은 상기 식 (4A-4C)을 도출한 반응은 원래 생물학적 침출이 아닌 화학적 침출을 나타낸 식이다. 다만 생물학적 침출이 대부분 간접침출(미생물에 의하여 지속되는 화학적 침출)이라는 측면에서 본질적으로 화학적 침출과 유사하고 기존 생물학적 침출 부동태층 실험 결과도 이들 연구결과와 유사하다는 점을 고려하여 본 연구에 언급하였다.
실제 S0은 대체로 액상 잔류물에서 많이 발견되어 최종 부동태층의 주성분은 아닌 듯하다. 원소 황은 광석에 접촉되어 잇는 미생물보다는 비접촉 미생물의 저해를 일으킨다고 보는 기존 연구결과가 있으며 Hackl et al. (1995)의 연구에서 S0는 다공성이 높아 표면에 축적이 되더라도 이온확산 저해 등 침출에 크게 지장을 초래하지는 않은 것으로 평가되었다. 문제는 반응이 진행되면서 S0외에 Jarosite가 생성되어 표면에 침전 되는데, 이 물질이 침전고형물질이기 대문에 다른 성분의 피막내 공극을 막아 비표면적을 감소시켜 침출을 매우 악화시킬 수 있다(Hackl et al., 1995; Debernardi and Carlesi, 2013; Klauber, 2008). S0와 Jarosite는 각기 다른 조건에서 생성되는데 특히 pH가 국부적으로 높아질 경우, Fe3+이온이 침전되어 Jarosite가 생성되기 쉽다. 또한 Jarosite는 온도가 높아질수록 생성이 용이하다.
일반적인 Jarosite의 침전반응은 다음 식 (5)와 같이 나타낼 수 있다(Feng et al., 2014; Leahy et al., 2009).
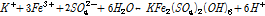 (5)
(5)
위 식에서 K+이온 대신 종종 Na+이 포함되기도 한다. Jarosite 이외에도 미생물군집 자체에서 생성되는 EPS (Extracellular Polymeric Substance) 자체도 침출저해효과가 있으나(Zeng et al., 2010; Zeng et al., 2011) 이를 표현할 수 있는 반응식은 아직 존재하지 않는다.
황동석 부동태층 모델링
침출반응속도의 저해는 종종 반응속도식으로 모사된다. 황동석 침출관련 반응속도를 수식으로 나타내기 위한 가장 기본적인 방법 중 하나는 용액이온의 농도를 변수로 하여 방정식을 구축하는 것이다. 실제로 수소이온농도(pH), 금속이온농도 또는 온도에 따른 속도식이 다수 개발되었다(Acero et al., 2009; Adebayo et al., 2003; Kimball et al., 2010; Li et al., 2010). 문제는 이러한 속도식이 주로 화학적 반응속도를 나타내는 것인데 반해 부동태층에 의한 침출반응저해는 (정확히 표현하자면) 부동태층으로 인한 침출금속의 확산지체가 문제이다. 즉 화학반응 관련 항으로만 구성된 속도식에 별도의 확산항 없이 확산지체를 묘사하기는 어렵다. 이와 반대로 확산항을 추가하게 되면 확산계수나 확산층의 두께 등 추가적인 계수를 더 고려해야 된다는 단점이 있다.
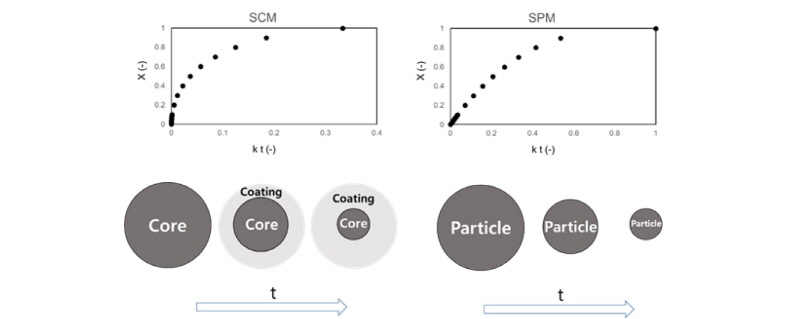
시간에 따른 황동석의 침출곡선을 관찰해보면 보통 반응초기에는 포물선 모양을 그리다가 시간이 지나면서 완만한 기울기를 가진 직선으로 변화한다. 이는 침출에 따라 반응물질(광석량)이 변하기 때문인데 이를 몇 가지 모델로 나타낼 수 있다. 그 중에 하나인 SCM (Shrinking Core Model)은 광석 같은 고체입자가 침출 등의 반응으로 인하여 소모되어 없어지면서 반응 생성물이 고체입자의 표면에 쌓이는 반응을 모델화한 것이다(Dutrizac, 1978; Safari et al., 2009; Carneiro and Leão, 2007). 여기서 Shrinking은 고체가 반응으로 소모되어 고체부피가 줄어들어 가는 것을 의미하는 것이다. SCM에서는 반응을 하면서 생성물이 고체표면에 쌓이기 때문에 고체+생성물 입자의 크기는 원래 고체입자의 크기와 같다고 본다. 반면 SPM(Shrinking Particle Model)은 SCM과 마찬가지로 고체입자가 반응으로 인하여 없어지는 현상을 모델화한 것인데 SCM과 다른 점은 생성물이 고체입자의 표면에 쌓이지 않는다고 가정하기 때문에 총 고체입자의 크기는 원래 입자에 비해서 계속 감소한다(Aydoğan et al., 2006b; Espiari et al., 2006). SCM과 SPM은 각각 다음과 같이 표기된다.
SCM:1 - (2/3) X - (1-X)2/3 = k t (6A)
SPM:1 - (1-X)1/3 = k t (6B)
여기서 t는 침출반응시간 (s), k는 반응상수 (1/s) 그리고 X는 이미 침출된 황동석의 분율(-)이다. 두 모델 모두 반응초기 포물선 형태의 곡선을 모사하지만 그 형태는 모델마다 약간 다르다. SCM 모델에서는 생성물이 표면층에 축적되기 때문에 SPM 모델보다 시간에 따른 침출반응 지체가 더 심하여 침출속도 곡선이 더 포물선에 가까워진다. 반대로 SPM 모델은 SCM 보다 직선에 가깝다. Fig. 2는 SCM과 SPM을 도식화한 것이다.
이를 황동석 부동태층에 적용시, 부동태 층의 생성으로 인해 광석내의 반응물질이 확산이 지체되어 침출속도가 심하게 저해를 받는다면 이 침출곡선은 SCM 모델로 모사하는 것이 적합하다고 할 수 있다. 실제로 Ikiz et al. (2006)은 황동석 침출속도곡선의 형태를 보고 주요 메커니즘을 판단하였는데 그 결과 생성층을 통한 확산(Diffusion through the production layer)이 우세할 경우의 곡선형태에 가장 근접하다고 판단하였다. 즉 침출속도곡선이 SCM 모델을 전제로 한 경우와 근접한 것이다. 황동석 생물학적 침출의 경우에도 광석내 금속이 계속 침출되어 없어지지만 S0를 비롯한 일부 물질이 표면에 생성되기 때문에 SCM이 적용될 수 있다. 황동석 침출속도를 모사하기 위해 주로 SCM이나 SPM 모델을 기반으로 한 다양한 모델들이 개발되었다. 이들은 많은 경우 식(6)의 반응계수 k를 상수가 아닌 pH나 온도 등의 함수로 나타내었다(Adebayo et al., 2003; Aydoğan et al., 2006a; Dong et al., 2009; Dreisinger and Abed, 2002).
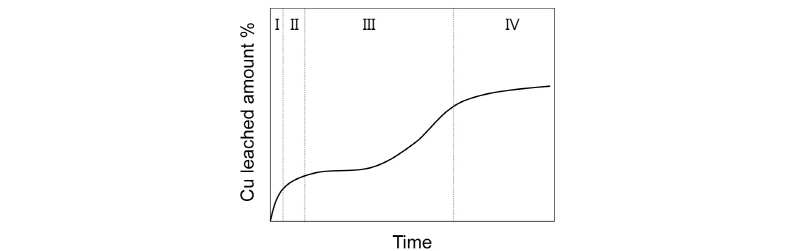
실제 시간에 따른 침출곡선은 상기 모델보다 다소 복잡하다. Klauber(2008)는 침출곡선에 따른 반응을 다음 4 단계로 정리하였다. (1) 침출속도가 빠른 초기단계(기울기가 가파른 선형 상승곡선). (2) S0가 광석표면에 계속 부착되어 침출을 저해하기 시작하는 단계(시간에 따라 기울기가 완만해지는 포물선 곡선) (3) S0 표면축적에 따라 침출이 계속 지체되는 단계(또는 S0가 제거되면 침출속도가 다시 증가하면서 침출곡선이 선형으로 복귀) (4) Jarosite 형성 단계 - 형성된 Jarosite가 광석표면에 부착되면서 침출이 크게 저해되는 단계(곡선은 기울기가 매우 완만한 포물선 형태). Fig. 3에 상기 4단계 모델을 도식화하였다.
황동석의 침출저해 및 부동태의 원인에 대한 다른 의견
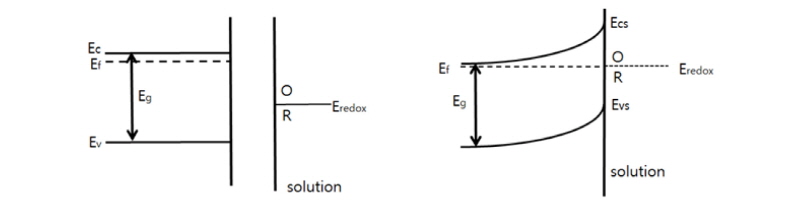
지금까지는 침출저해의 주요 원인이 광석표면에 축적된 Jarosite와 S0 등으로 구성된 부동태층의 존재라고 하였다. 이 견해가 가장 널리 받아들여지고 있지만 부동태층 자체가 분광학적 또는 현미경을 이용한 직접 관찰이 쉽지 않아 논란이 계속되고 있다. 대표적인 예로 보편적인 견해와 매우 다른 의견이 최근 Crundwell (2015)의 연구에서 제시되었는데, 이들은 황동석 표면에 부동태층 같이 어떠한 물질이 축적되어서 침출이 저해되는 것보다는 황동석이 n형 반도체이기 때문에 나타나는 자연스러운 현상이라고 주장하였다. 일반적으로 n형 반도체의 경우 Conduction band내 전자에 의해서 전류가 만들어진다. 원래 n형 반도체 물질에서 산화(Anodic) 침출이 자발적으로 발생하기 위해서는 반도체 표면에 위치한 Valence band 내 전자가 계속 제거되어야 한다. 전도성 금속의 경우에는 Conduction band내 자유전자의 흐름이 원활하기 때문에 산화에 필요한 전자를 금속 Bulk 내부에서 표면으로 계속 공급할 수 있지만 황동석 같은 반도체는 그러한 자유전자의 흐름이 제한적이다. 따라서 표면의 Conduction band와 Valence band의 전자가 산화침출로 소모되어 버리면 그 표면의 전위와 반도체 Bulk 내부의 전위가 달라지는 현상이 발생한다. 이 떄 산화침출로 인해 전자가 부족한 반도체 표면층을 공간전하영역(space charge region) (전해질 용액 계면 등에 인접한 반도체 표면전위층)이라고 하고 그로 인해 표면/Bulk간 전위가 달라지는 현상을 밴드굽힘(band bending) 현상이라고 한다. Fig. 4의 좌측에 정상적인 상태에서의 n형 반도체 표면 에너지 준위를 나타내었고 우측은 공간전하층 형성으로 인한 표면부위 에너지준위 변화를 묘사한 것이다.
Crundwell(2015) 기존 침출지체로 인하여 발생하는 현상(전류-전압 거동 등)이 이러한 이상적인 반도체 계면에서의 전류-전압 거동과 상당히 유사하다고 보았다. 그러나 이 학설은 아직 더 많은 검증이 필요하다. 어떤 연구자들은 Crundwell(2015)의 거론한 황동석의 산화침출에 따른 전압-잔류 곡선이 일반적인 기존 연구의 그것과 상이하다는 이유로 이 학설에 비판적이다(Nicol, 2016; Nicol et al., 2017). 또한 대부분의 연구자들은 여전히 부동태층이 황동석 용출지체에 심각한 영향을 준다고 보고 있다.
부동태층으로 인한 침출저해 해결 방안
침출저해 해결방안은 크게 침출속도를 증가시키는 방법, 부동태층 생성을 억제하는 방법, 이미 생성된 부동태층 성분을 제거하는 방안 등으로 구분하여 생각할 수 있다. 현재 연구자들이 제시하고 있는 기술은 (1) 활동도가 큰 고온성 미생물을 적용하는 방안(Ahmadi et al., 2011; D'Hugues et al., 2002; Zeng et al., 2011; Zhao et al., 2015) (2) Ag 등 첨가제 또는 외부전극물질을 주입하는 방안(Córdoba et al., 2008; Dixon et al., 2008; Ghahremaninezhad et al., 2015; Hiroyoshi et al., 2002; Holmes et al., 1995; Nakazawa et al., 1998; Zhao et al., 2016) 그리고 (3) pH 제어나 별도 물리적 공정을 통해 Jarosite 생성을 최소화 또는 제거하는 방안(Feng et al., 2014; Klauber, 2008) 등이 있다. 본 장에서는 이러한 기술을 소개하고 효과를 논의하고자 한다.
고온성 미생물
Jarosite의 저해효과를 저감시키는 방안 중 하나는 고온환경을 조성하여 고온성 미생물의 활동도를 높이는 것이다(D’Hugues et al., 2002). 미생물 종은 최적 활동 온도에 따라서 저온성, 중온성, 고온성 3 가지로 구분할 수 있는데 생물학적 침출에서 중요한 미생물은 중온성 또는 고온성이다(Deberardi and Carlesi, 2013; Li et al., 2013; Rittmann and McCarty, 2001). 이 중 고온성 미생물은 에너지가 높아 황동석같이 내화성이 강한 광물의 생물학적 침출에 더 효과적이고 부동태층 영향도 줄일 수 있다고 한다(Debernardi and Carlesi, 2013). 다만 어떤 이유로 고온성 미생물이 부동태층 영향을 줄일 수 있는지는 관련 상세 메커니즘이 아직 충분히 밝혀지지 않았다. 고온성 미생물 중 극고온성(Extreme thermophilic: 최적 활동온도 55-80°C)에 해당되는 Archaea보다는 중고온성 (Moderately thermophilic: 최적 활동온도 40-55°C) 미생물이 황동석 관련해서 많이 연구되고 있는데 이는 중고온성 미생물이 Archaea에 비해 온도상승에 필요한 에너지 소모가 적고 생물학적 침출 환경에 더 잘 적응하여 생존력이 높기 때문인 것으로 알려져 있다(Zhou et al., 2009).
pH 제어를 통한 Jarosite 생성 억제
Feng et al.(2014)은 황동석 생물학적 침출 증진을 위해 Three-stage pH stat 생물학적 침출 기술을 개발하였다. 이 기술은 미생물의 적응/성장, Cu의 침출 및 Jarosite 생성에 유리한 pH 조건 또는 Leaching cycle이 약간씩 다르다는 점을 이용한 것으로, Leaching 시점에 따라 pH 1.3 ↔ 1.0 ↔ 0.7 사이를 미세하게 조절하는 방식이다. 즉 미생물량의 증식이 필요한 시점에서는 pH를 약간 증가시키는 반면 Fe3+ 증가로 Jarosite 생성이 용이한 시점에서는 pH를 낮춰서 생성을 억제시킨다. 그 결과 pH를 조절하지 않고 고정시킨 경우보다 Jarosite 생성이 억제되었고 미생물 사전적응기간도 단축되었으며 Cu 용출량 및 속도도 상당히 증가하였다(Feng et al., 2014).
첨가제 또는 외부 전극물질
부동태층의 침출저해를 막는 또 하나의 일반적인 방법은 외부 촉매 또는 전극이 될만한 물질을 주입시키는 것이다. 촉매로는 Ag가 많이 연구되고 있는데 Ag는 S와 반응하여 Ag2S를 표면에 형성시킬 수 있다. 이 반응의 장점은 바로 Ag2S가 침출반응 중에 쉽게 산화된다는 것이다(Córdoba et al., 2008; Ghahremaninezhad et al., 2015; Hiroyoshi et al., 2002; Zhao et al., 2016). 반면 단점은 Ag의 가격이 비싸고 용액내 고농도로 존재할 경우 생독성을 야기시킨다 점이다. SO42-이나 Cl- 이온의 첨가도 종종 연구되었으나(Cameiro and Leão, 2007; Hirato et al., 1986; Hirato et al., 1987) 이들 이온이 침출에 끼치는 직접적 영향은 미미한 것으로 알려져 왔다(Debernardi and Carlesi, 2013). 설사 있다고 하더라도 관련 메커니즘이 전기화학 측면이 아닌 이온의 존재로 인한 광물이나 부동태층 표면의 구조변화에 관련된 것으로 알려져 있다.
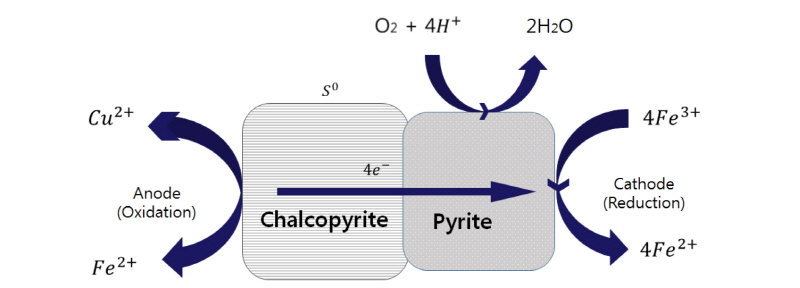
또한 황동석 침출을 위해 별도의 전극물질을 첨가하는 경우가 있는데 황동석과 다른 전도성 매체를 접촉시켜 전류를 발생시키기 위한 것이다. 이는 Galvanic 효과로 널리 알려져 있다(Chmielewski and Kaleta, 2011; Dixon et al., 2008; Holmes and Crundwell, 1995). 별도의 전극물질로는 황철석이 종종 이용되는데, 황동석이 황철석과 접촉하면 고유의 전위차에 의해 전류회로가 형성되고 황동석의 산화 침출이 보다 용이해진다. 즉 전기화학적 전위가 높은 황철석이 음극 Cathode의 역할을 맡고 반대로 전위가 낮은 황동석이 양극 Anode역할을 하여 산화가 더 용이해지는 것이다 (Fig. 5 참조). 이때 수반되는 두 전극간의 전류는 별도의 음극전위 없이 황동석 단독일 때 발생하는 전류보다 당연히 높다. 전류가 높다는 것은 산화(침출)/환원이 활발하다는 의미이다. 황철석 외에 이용되는 다른 전극물질로는 활성탄이 있는데, 활성탄도 일종의 전기적 도체로 음극 역할을 하여 황동석의 양극침출을 증진시키며 액 중 활성탄 농도가 2 g/L일 때 침출효과가 최적으로 알려져 있다(Nakazawa et al., 1998; Li et al., 2013; Liang et al., 2010).
|
Fig. 5. Galvanic effect generated in the contact of chalcopyrite and pyrite. Redrawn from Li et al. (2013). |
외부전극을 이용한 환원성 침출
(Electro-assisted reductive leaching)
본 연구에서 다룬 침출반응은 황동석내 Cu와 Fe가 각각 Cu2+와 Fe3+로 산화 침출되는 반응이다. 이 경우 황화물도 S0, SO42- 등의 형태로 산화되는데 황동석이 Fe 존재하에서 침출될 때 복합황으로 구성된 부동태층이 형성되는 것으로 알려져 있다. MartÍnez-Gómez et al.(2016)은 산화침출대신 외부전극에 의하여 황동석을 Cu2S 같이 침출이 쉬운 광물로 전환시키는 환원반응이 부동태층 형성을 방지한다고 보고하였다. 이는 부동태층의 형성이 산화환경에서 침출에 악영향을 주나 Cu의 환원과는 거의 무관하기 때문으로 생각된다. 이러한 반응은 미생물에 의한 생물학적 침출은 아니지만 전기화학적 측면에서 부동태층 형성을 줄이는 방안으로 고려될 수 있다. 외부전극에 의한 황동석 환원반응은 산화반응에 비해 규명이 덜 되었으나 지금까지 알려진 메커니즘을 기술하자면 아래 식 (7)과 같다.
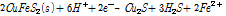 (7)
(7)
먼저 황동석은 H+에 의해 Cu2S로 환원될 수 있다. 여기서 황동석내 Fe는 침출되고 황은 H2S로 환원된다. 참고로 이 반응은 O2분자가 관여하지 않으므로 비산화침출(Non-oxi-dative Leaching)이라고도 일컫는다(Debernardi and Carlesi, 2013; Nicol and Lázaro, 2003). 또는 Fuentes-Aceituno et al.(2008)의 연구에 따르면 H+와 단원자 H(Monoatomic Hydrogen)가 황동석과 반응하여 상기 환원반응이 발생될 수 있다고 하였다. 아무튼 생성된 Cu2S는 외부 전극에 의한 H+와의 반응에 의해 다음 식 (8)과 같이 Cu로 환원된다.
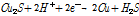 (8)
(8)
이 반응에서 중요한 점은 용액의 환원환경을 유지해야 한다는 점이다. 그렇지 않으면 H2S는 Fe3+와 반응하여 부동태층 S0를 생성할 수 있다.
Jarosite 물리적 제거
Klauber(2008)는 침출저해의 가장 큰 요인을 Jarosite의 광석표면 생성 및 코팅으로 지목하였으며 Jarosite 제거하기 위해서는 (1) 초기에 Jarosite의 생성을 막음 (2) 생성된 Jarosite의 자가침전 유도로 광석표면에 부착되는 것을 막음 (3) 별도의 공정을 구축하여 Jarosite 제거하는 방법 이상 3가지 방법을 제시하였다. 첫 번째 방법이 성공하려면 애초에 Jarosite 형성이 불가능한 조건을 구축해야 하는데 가장 간단한 방법 중 하나가 pH를 항상 1보다 작게 유지하는 것이다. 그러나 실제 pH<1을 항상 유지할려고 해도 일부 국소적 환경내(예를 들어 맥석 표면 부근)에서는 pH가 얼마든지 1보다 커질 수 있을 것이다. 이 경우 바로 Jarosite가 생성되는데 한번 생성된 Jarosite는 전구물질로 작용하여 다음 Jarsosite가 더 쉽게 생성될 수 있다. 결국 Klauber (2008)는 두 번째와 세 번째 방법으로 제거를 해야 한다고 주장하였다. 즉 생물학적 침출 반응계 외부에 별도의 공정을 구축하고 생물학적 침출 결과 침출수가 나오면 이 공정을 통하도록 한다. 그 공정내에서 침출수내 Jarosite를 생성 및 자가 침전시켜 Jarosite가 없는 상등수를 다시 생물학적 침출 반응계로 돌려보내는 식이다(Klauber, 2008).
광화학 반응
이는 가시광선을 이용하여 산화침출을 촉진시키는 일종의 광촉매작용이다. 메커니즘은 전술하다시피 황동석이 n형 반도체라는 물질적 특성과 밀접한 관계가 있다. 즉 철 주변의 전자가 주로 Conduction band에 존재하데 비해 Cu 주변의 전자는 주로 Valence band에 존재하고 이 두 Band사이 0.6 eV Gap 이상의 에너지를 가하면 Cu의 산화침출 촉진이 가능하다. 이러한 방법 중 하나가 이 Valence band의 Cu 결합전자에 에너지를 가해서 Conduction band로 올려놓는 것이다(Zhou et al., 2015). 생물학적 침출의 경우 미생물의 호흡에너지를 이용하지만 광에너지를 이용할 경우 전자 이동이 훨씬 원활하다. Zhou 등의 연구에 의하면 가시광선을 생물학적 침출에 이용했을 때 Cu 산화침출 및 Fe3+의 환원이 원활하여 Cu 회수율이 약 24% 증가하였다(Zhou et al., 2015). 문제는 이 기술을 적용하려면 황동석광물이 빛에 최대한 노출이 되어야 한다는 점이다. 이를 위해서는 용액내에 광물이 비교적 저농도로 존재해야 빛의 투과가 가능하며 빛이 투과하는 반응기의 두께도 얇아야 한다. 생물학적 침출에 많이 쓰이는 Heap/dump 타입에는 적용하기 힘들고 분쇄한 광물을 주입한 교반식 반응기 등에 적용할 수 있을 것이다.
향후 연구주제
황동석 생물학적 침출시 부동태층 관련 향후 연구주제로는 우선 부동태층의 존재를 직접 확인할 수 있는 관측기법이 개발되어야 한다. 기존 현미경법 또는 분광법 등 많은 기법이 동원되었지만 아직 신뢰성이 부족한 실정이다. 전압-전류법에 의한 부동태층의 간접적 관찰도 해당 전극이 황동석의 현장 침출특성을 더 잘 반영할 수 있도록 제작되어야 한다(Debernardi and Carlesi, 2013). 또한 대상 광물 황동석은 구조나 성분이 일정해도 불순물이 포함되어 있을 경우 실험결과가 예상보다 다를 수 있고 이런 경향은 광물이 포함된 다양한 성상의 Ore를 측정대상에 포함시킬 경우 더욱 심할 것이다. 이를 고려한다면 황동석 침출 또는 부동태층 제거 실험시 재현성 제고를 위해서 황동석 시료 및 용액환경의 물리/화학/미생물학적 특성이 더 상세하게 정의되어야 한다. 또한 최근에 제시된 연구(Crundwell et al., 2015)에서 제시된 것처럼 황동석의 자연 반도체 특성이 Cu 침출속도에 얼마나 큰 영향을 미치는지도 다각적인 측면에서 검증해야 한다.
결 론
황동석으로부터의 Cu 생물학적 침출이 아직 상용화되지 못한 이유 중 하나가 침출시 부동태층 생성으로 인한 침출반응속도의 저하이다. 부동태층은 현미경으로 직접 관찰하기에는 두께가 너무 얇아 간접적인 방법으로 그 존재와 영향을 예측한다. 예를 들면 (1) 황동석에 외부 전압을 가할 때 전압상승에 따른 침출에 의한 전류값이 나타나는데, 이 때 전류값이 갑자기 하락하는 전위값을 측정하는 기법 (2) 시간에 따른 침출반응의 변화를 관측할때 침출량의 증가가 저하되는 지점을 관측하는 기법이 주로 사용된다. 침출반응을 저해하는 부동태층 주요 성분은 Jarosite일 것으로 예상하고 있는데 이는 주로 용액 pH의 국부적 상승시 자주 발생하는 것으로 보인다. 또한 최근에는 황동석 Cu 침출 저하 원인이 어떤 부동태층의 존재가 아니라 황동석이 가지고 있는 반도체의 일반적인 특성이라는 의견도 제시되었다. 황동석의 침출을 증진시키는 방법은 크게 (1) 고온성 미생물을 이용하는 방법 그리고 (2) 첨가제, 외부전극 혹은 미생물을 통해 침출속도 자체를 향상 시키는 방법 등이 있으며 기타 pH 조절을 통해 Jarosite의 생성을 최소화하거나 별도의 공정을 통해 이미 생성된 Jarosite를 제거하는 방법 등이 제시되었다.
황동석 생물학적 침출로 인한 부동태층 관련 향후 연구에서는 부동태층 관측시의 신뢰도 제고, 황동석 자체 반도체 물성특성이 부동층 생성이 미치는 영향, 그리고 각 현장별 시료특성의 영향 등이 명확히 규명되어야 한다.