서 론
광물찌꺼기, 토양, 퇴적물, 하수 슬러지 등으로부터 다양한 추출제를 이용하여 유독성 중금속을 용출‧제거하는 화학적 과정이 널리 적용되어 왔다(Geng et al., 2020; Kedziorek et al., 1998; Tunsu et al., 2019; Wasay et al., 1998). 그러나 이러한 방법들은 때때로 높은 비용과 에너지를 필요로 하고 운전이 어려울 뿐만 아니라 많은 양의 산을 필요로 하며 용출 효율이 낮게 나타나기도 한다(Couillard and Zhu, 1991; Nguyen and Lee, 2015; Tyagi and Couillard, 1989). 미생물학적 중금속 용출 방법은 이러한 단점을 극복할 수 있는 좋은 대안이 될 수 있다. 미생물학적 금속 용출 과정에 널리 쓰이는 미생물로는 Acidithiobacillus thiooxidans, A. ferrooxidans, Leptospirillum ferrooxidans 등이 있으며 이들은 대기 중 CO2를 탄소원으로 이용하는 호기성 독립영양균(chemoautotoph)이다.
A. thiooxidans는 황 및 황화합물을 산화시켜 생장 에너지를 얻으며 이 과정 중에 황산을 만들어 배양액의 pH를 강산성으로 낮추는데(식 (1)), 이 때 만들어진 황산은 금속 화합물로부터 금속을 용출한다(식 (2)).
| $${\mathrm S}_0\;+\;{\mathrm H}_2\mathrm O\;+\;1.5{\mathrm O}_2\;\rightarrow\;{\mathrm H}_2{\mathrm{SO}}_4$$ | (1) |
| $${\mathrm H}_2{\mathrm{SO}}_4\;+\;\mathrm{Soils}-\mathrm{Me}\;\rightarrow\;\mathrm{Soil}-2\mathrm H\;+\;{\mathrm{MeSO}}_4$$ | (2) |
(Me: metals)
A. ferrooxidans는 Fe2+를 Fe3+로 산화하며 에너지를 얻는다(식 3). 고체 금속 황화물(sulfide)은 산화제인 Fe3+에 의하여 화학적으로 산화성 용해되며 이 때 생성된 Fe2+는 식 (3)에서 재사용되고 H+ 생성에 의해 강산성의 슬러리를 조성한다(식 (4)).
| $$14\mathrm{Fe}^{2+}+3.5{\mathrm O}_2+14\mathrm H^+\rightarrow14\mathrm{Fe}^{3+}+7{\mathrm H}_2\mathrm O$$ | (3) |
| $$\mathrm{MeS}\;+\;4{\mathrm H}_2\mathrm O\;+\;14\mathrm{Fe}^{3+}\;\rightarrow\;\mathrm{Me}^{2+}\;+\;14\mathrm{Fe}^{2+}\;+\;{\mathrm{SO}}_4^{2-}\;+\;8\mathrm H^+$$ | (4) |
(MeS: insoluble metal sulfide, Me2+: free metal ion)
생성된 Fe3+가 철백반석(jarosite) 등을 형성하여 소비되어도 H+ 생성은 지속되므로 중금속 용출이 가능하다(식 (5)).
| $$3\mathrm{Fe}^{3+}\;+\;\mathrm{Me}^+\;+\;2\mathrm{HSO}^{4-}\;+\;6{\mathrm H}_2\mathrm O\;\rightarrow\;{\mathrm{MeFe}}_3{({\mathrm{SO}}_4)}_2{(\mathrm{OH})}_6\;+\;8\mathrm H^+$$ | (5) |
(Me+: monovalent metal ion)
그 동안 국내에서 A. thiooxidans 및 A. ferrooxidans를 이용하여 오염 토양으로부터 As 및 중금속을 용출하는 연구는 다수 수행된 바 있다(Han and Lee, 2015; Han et al., 2009, Han et al., 2011; Kim et al., 2011; Ko et al., 2013; Lee et al., 2005; Park et al., 2007). 이 연구들은 대부분 실험실 규모에서 오염 토양으로부터 미생물학적 중금속 용출 여부를 파악하고 최적 용출조건을 설정하는 과정으로 수행되었다. 연구 결과, 미생물학적 용출법은 대부분 화학적 용출법에 비하여 우수한 중금속 제거효율을 보인 것으로 나타났다. 그러나 이러한 실험실 연구는 미생물의 활성도를 최대한 유도하기 위하여 현장적용성과 다소 동떨어진 조건, 예를 들면 토양 15 g에 미생물 접종액 300 mL을 가하는 등의 조건에서 수행되었다(Han and Lee, 2015). 오염 현장에서 반응조를 운전하는 경우를 예상하면 이렇게 낮은 고액비는 높은 효율성은 얻을 수 있으나 운전의 경제성을 확보하기 어렵다.
미생물학적 용출 기술을 오염된 대규모 현장 토양에 적용할 경우 사전에 해결해야 할 기술적 문제들이 많이 존재한다. 이에는 토양 슬러리의 고액비, 미립질 토양 적용성, 교반(agitation) 효과, 대용량 증균(enrichment) 효율성, Fe2+ 주입량 등이 포함되며, 이러한 요인들은 용출 공정의 효율성 및 경제성과 밀접하게 연관되어 결국 현장적용성 여부를 결정할 것이다.
이 연구의 목적은 위에서 언급한 여러 기술적 요인들의 영향을 규명하여 미생물학적 중금속 용출의 현장적용성을 높이려는 것이다. 최근 컬럼(column) 침출을 통하여 미생물학적으로 광물찌꺼기 등으로부터 중금속을 용출하는 연구가 보고되고 있으나(Borja et al., 2015; Seh-Bardan et al., 2012) 이 연구는 대용량 교반형 반응조에 적용하는 경우를 가정하여 수행하였다. 실험에 사용한 미생물은 A. thiooxidans 및 A. ferrooxidans를 사용하였으며 연구 대상 토양은 사격장 토양 및 제련소 주변 토양을 이용하였다.
토양 시료와 미생물 배양
실험에 사용한 사격장 토양은 경기도 파주시에 위치하며, 토양 pH는 5.5이었다. -80 mesh(< 0.18 mm)로 체질하여 왕수 분해한 후 ICP-OES(Optima 5300 DV)로 분석한 결과, Fe 4.4%, Pb 1,927 mg/kg, Cu 184 mg/kg, Zn 115 mg/kg의 함량을 보였다. 제련소 주변 토양은 충청남도 서천군에 위치하며 동일한 방법으로 화학분석한 결과, Fe 1.2%, Pb 380 mg/kg, Cu 187 mg/kg, As 107 mg/kg, Zn 82 mg/kg으로 나타났다. 토양 pH는 5.8이었으며, 토성은 모래 24.6%, 미사 62.8%, 점토 12.6%, 작열감량 3.9%, 양이온교환능력 10.4 meq/100 g의 값을 보였다. 실험에 사용한 토양은 현장의 미생물학적 특성을 보존하기 위하여 멸균하지 않았다.
황산화균인 A. thiooxidans(ATCC8085)는 American Type Culture Collection에서 분양받았다. A. thiooxidans는 medium 125에 황을 첨가하여 배양하였으며 배양액의 조성은 다음과 같다; ① medium 125: (NH4)2SO4 0.2 g, MgSO4·7H2O 0.5 g, CaCl2 0.25 g, KH2PO4 3 g, FeSO4·7H2O 0.0091 g, 증류수 1,000 mL, ② 원소 황 10 g. 철 및 황산화균인 A. ferrooxidans(KCTC2677)는 Korean Collection of Type Culture에서 분양받았으며 9K medium에서 배양하였다. 9K medium은 Solution A와 Solution B로 구성되며, Solution A는 (NH4)2SO4 3.0 g, KCl 0.1 g, K2HPO4 0.5 g, MgSO4․7H2O 0.5 g, Ca(NO3)2 0.014 g을 증류수에 녹여 700 mL을 조제하였다. Solution B는 FeSO4․7H2O 45.0 g을 증류수에 녹여 300 mL을 조제하였다.
토양 슬러리의 고액비
앞에서 예로 든 바와 같이, 실험실에서 미생물학적 용출 연구를 할 경우, 박테리아의 효과를 극대화하기 위하여 처리 토양에 비하여 많은 양의 미생물 접종액을 투입한다. 그러나 기술을 현장에 적용할 경우 이처럼 낮은 고액비를 유지하기는 어렵다. 반면 비용과 기간을 줄이기 위하여 처리 토양의 부피를 증가시키면 토양 완충능에 의해 pH 감소 속도가 매우 느려질 것이다. 따라서 토양과 접종액의 고액비 상승이 미생물학적 용출에 미치는 영향을 조사하는 것이 필요하다.
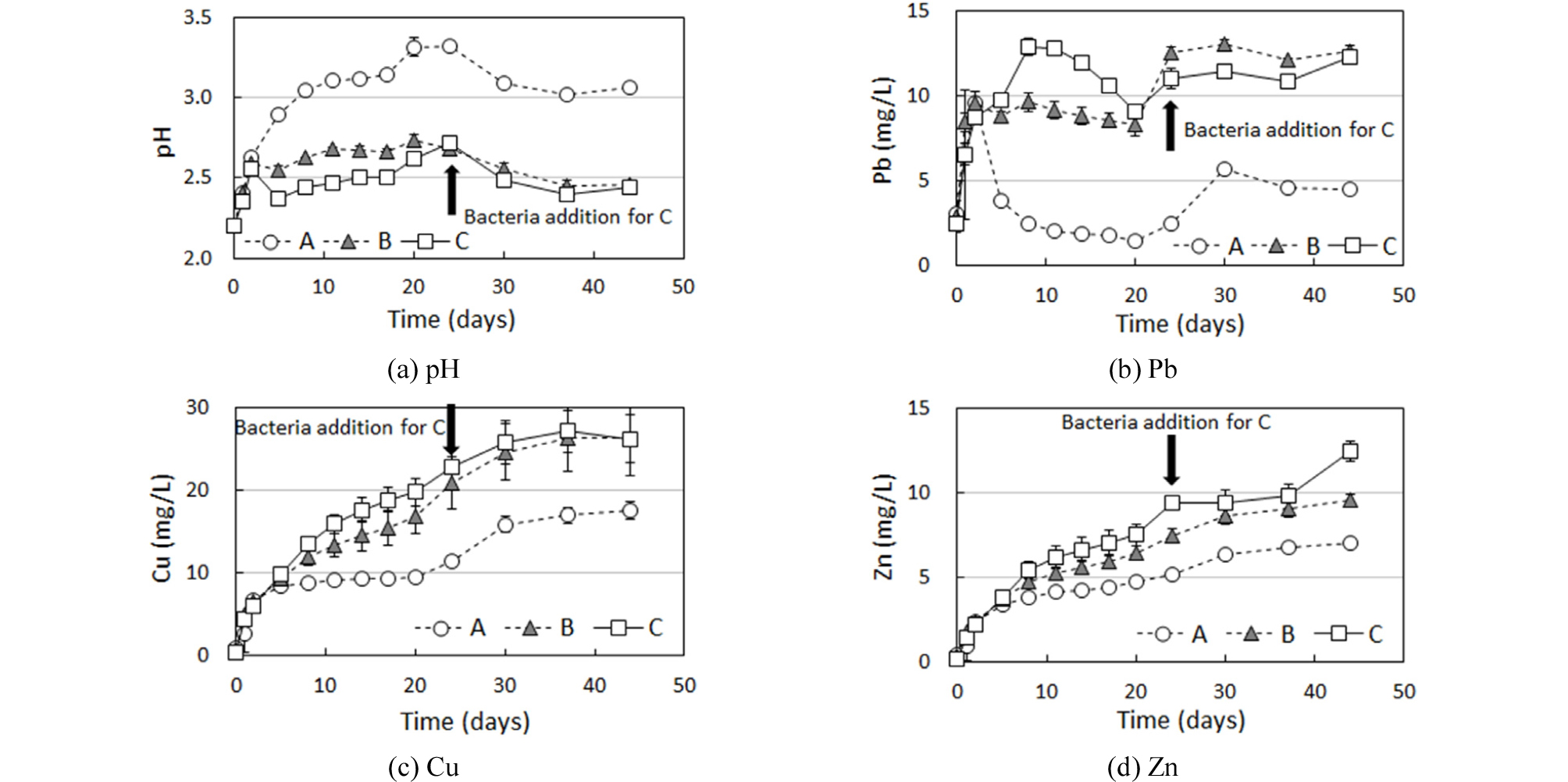
A. thiooxidans 배양액 300 mL에 사격장 토양 100 g을 투입하여 높은 고액비(1:3)를 갖는 슬러리를 제조한 후 용출 실험을 수행하였다. 추가적으로 황 투입 효과를 보기 위하여, A) 황을 투입하지 않은 비교시료(control), B) 황 3 g을 투입한 시료, C) 초기에 황 3 g을 투입하고 실험 24일 후 추가적인 미생물 접종액 10 mL을 투입한 시료로 구분하였다. 추가적인 미생물 접종은 슬러리 내에서 초기 접종하였던 미생물의 생장이 저하되었을 경우를 가정하여 수행하였다. 모든 실험은 중복 실험을 실시하였다. 초기 pH는 H2SO4를 이용하여 2.5로 조절하였으며 모든 실험은 항온배양기(한백, HB-201SF)에서 26°C 조건으로 진행하였다.
실험 결과, 낮은 고액비 시료에서 일반적으로 나타나는 pH 감소는 발생하지 않았으나, 황을 투입한 시료들(B와 C)에서 투입하지 않은 시료(A)에 비하여 한층 낮은 pH를 보였다(Fig. 1(a)). 이는 A. thiooxidans가 에너지원인 황을 산화하며 대사작용을 수행함을 나타낸다. 황을 주입하지 않은 시료(A)의 경우 초기 pH 2.2에서 24일 경과 후 최대 3.3까지 상승하였다. A 시료에서 24일 이후 pH 감소가 관찰되었는데, 이는 아마도 A. thiooxidans가 황 대신에 토양 내에 존재하는 다른 에너지원 – 예를 들면, thiosulfate 또는 tetrathionate 등을 산화하며 생장하였을 가능성이 있다. 그러나 토양 내의 이들 성분에 관한 분석은 수행하지 않았으므로 이를 밝히기 위해서는 추가 조사가 필요하다.
황을 주입하여 A. thiooxidans의 대사작용을 유도한 시료(B와 C)에서 pH 감소는 발생하지 않았으나 토양 완충능에도 불구하고 pH가 상승하지 않고 유지되었다. 실험 시작 후 24일 경과하였을 때 추가적으로 미생물 접종액 10 mL을 주입하였으나 pH 변화는 발생하지 않았다.
중금속(Pb, Cu, Zn)의 경우 황을 주입하지 않은 시료에 비하여 황을 주입한 시료에서 더욱 높은 함량의 중금속들이 토양으로부터 용출되어, 고액비 증가에도 불구하고 중금속 용출의 효과를 볼 수 있었다(Fig. 1(b)~(d)). 이는 시간이 경과해도 2.5 내외로 낮게 유지되는 pH의 효과 때문인 것으로 보인다.
토양 및 광물찌꺼기 내 중금속의 미생물학적 용출에 관한 그간의 많은 실험실 연구는 보통 1:10~1:20의 고액비 조건에서 수행되었다(Han and Lee, 2015; Han et al., 2009, Han et al., 2011; Kim et al., 2011; Ko et al., 2009, Ko et al., 2013; Lee et al., 2005; Nguyen and Lee, 2015). 고액비가 낮을수록 향상된 용출 효율을 유도할 수 있으나, 대량의 토양을 처리해야 하는 현장 적용 시에는 처리 토양에 비하여 미생물 접종액의 용량이 적을수록 접종액 준비에 소모되는 비용 및 시간을 절약할 수 있을 것이다. 이 실험의 결과 1:3 정도로 고액비를 높여도 일정 수준의 중금속 용출 효과를 볼 수 있었다. 따라서 효율과 경제성의 양 측면을 모두 만족하는 현장 적용을 위해서는 사전 연구를 통하여 가장 효과적인 고액비를 미리 결정하는 과정이 필요할 것이다.
미립질 토양 적용성 및 교반 효과
처리 토양이 점토질 등 미립질인 경우 투수성이 낮아 용출제의 접근이 어려우므로 효과적인 중금속 용출을 기대하기 어렵다. 또한 실험실 연구에서는 반응 속도를 향상시키고 미생물 생장에 필요한 O2 및 CO2의 원활한 공급을 위하여 대부분 토양 슬러리를 교반하는 경우가 많은데, 현장에서 대형 반응조를 교반하기 위해서는 별도의 에너지가 필요할 것이다. 이 연구에서는 실험을 통하여 미립질 토양의 용출 및 교반 효과를 조사하였다.
사격장 토양을 200 mesh(< 0.075 mm)로 체질한 후 실험에 사용하였다. 미립질 토양의 pH는 5.9였으며, 왕수 분해 후 측정한 금속 함량은 Fe 4.4%, Pb 1,951 mg/kg, Cu 186 mg/kg, Zn 117 mg/kg으로서 –80 mesh 토양과 매우 유사하였다.
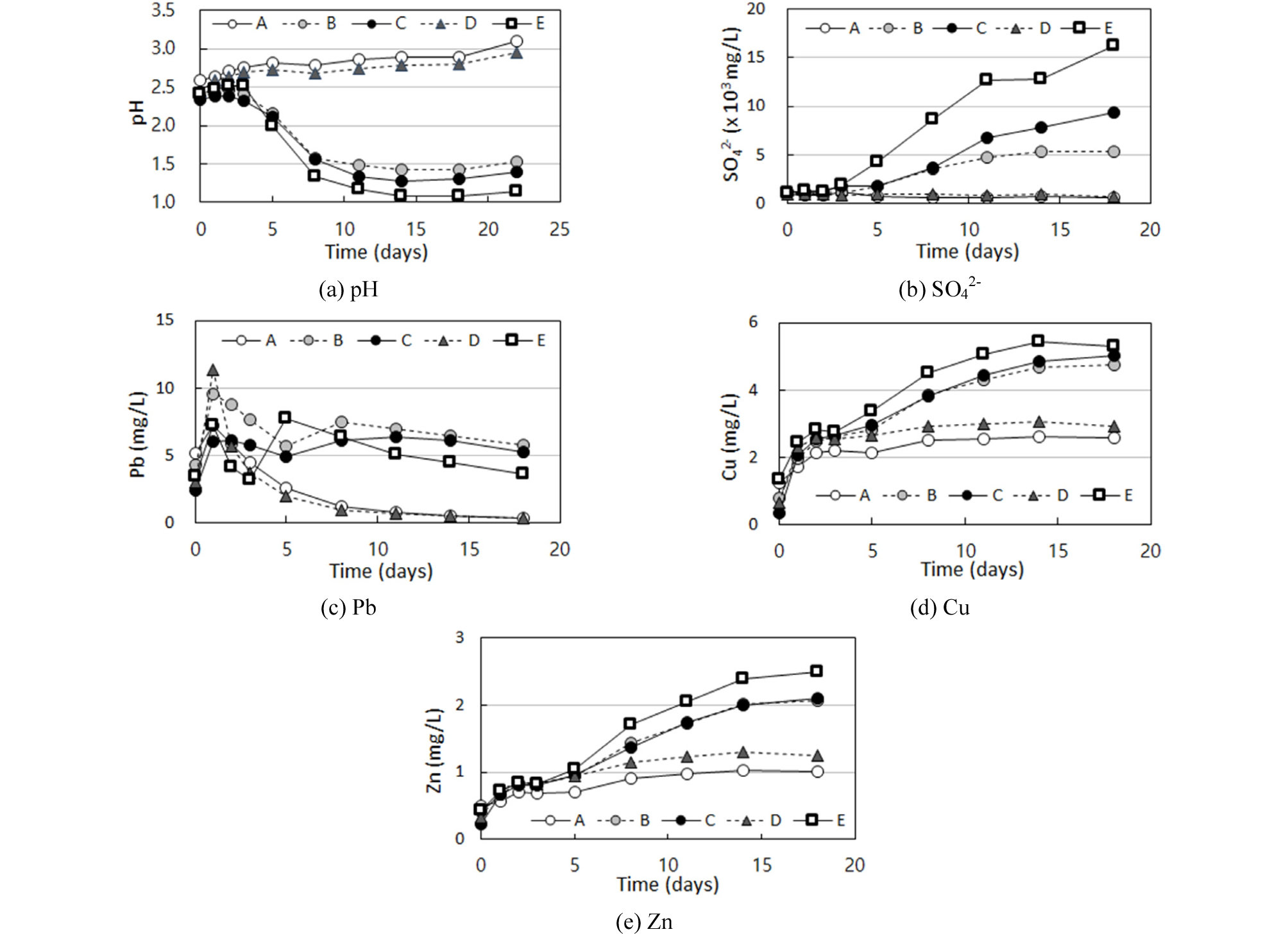
용출 실험은 medium 125 용액 300 mL에 토양 시료 15 g과 황 6 g을 넣은 후, A) 무생물적 비교시료, B) A. thiooxidans 접종액 30 mL, C) A. thiooxidans 접종액 50 mL을 넣고 교반하지 않은 시료와 D) 무생물적 비교시료, E) A. thiooxidans 접종액 30 mL을 넣고 교반한 시료로 구분하여 수행하였다. 주입한 미생물 시료는 멸균 탈이온수를 채워 최종 부피 50 mL이 되도록 하였다. 토양 시료 교반은 항온배양기(한백, HB-201SF)에서 150 rpm으로 수행하였다.
실험 결과, 교반 여부와 관계없이 미생물을 주입하지 않은 A와 D 시료의 경우 pH가 시간이 경과함에 따라 점차 증가하는 양상을 보였으며 22일이 경과하였을 때 pH 3.0~3.1로 증가하였다(Fig. 2(a)). 미생물을 주입한 B, C, E 시료는 시간에 따라 pH가 급격히 감소하였으며 특히 교반한 시료 E는 14일 경과 후 pH 1.1까지 감소하여 A. thiooxidans의 활발한 대사작용을 나타내었다.
SO42- 함량 역시 A. thiooxidans의 활발한 대사작용을 나타내어, 교반 여부에 관계없이 미생물을 주입하지 않은 A와 D 시료의 경우 SO42- 생성이 다른 시료들에 비하여 매우 낮았다(Fig. 2(b)). 반면 미생물을 접종한 시료에서는 시간에 따라 SO42- 함량이 증가하였으며, 미생물 접종량이 많았던 C 시료에서 B 시료에 비하여 더 많은 SO4>2-를 생성하므로써 미생물 접종량에 따라 SO42- 생성이 차이를 보임을 확인하였다. 가장 높은 함량의 SO42-는 미생물을 접종하고 교반상태를 유지한 E 시료에서 나타났다.
사격장 토양에서 가장 높은 오염도를 보였던 Pb의 경우, 미생물을 주입하였을 때 초기 1일까지는 Cu 및 Zn에 비하여 높은 용출 함량을 보였다(Fig. 2(c)). 그러나 시간에 따라 용출 함량이 점차 증가하는 Cu 및 Zn과는 달리 Pb는 일정 수준에서 유지 또는 감소하는 결과를 나타내었다. 이는 용액 내 함량이 증가한 SO42-와 용출된 Pb2+가 결합하여 용해도가 낮은 황산납(PbSO4)을 생성하며 침전한 것에 기인한 것이다(Han and Lee, 2015; Han et al., 2009). 이러한 결과는 오염된 토양, 퇴적물, 광물찌꺼기, 슬러지 등으로부터 Pb를 용출하려 할 경우 황산화균인 A. thiooxidans를 이용하는 방법에는 제한이 있을 수 있음을 나타낸다. Cu와 Zn의 경우, SO42-와 유사한 거동을 보여 미생물을 접종하고 교반한 경우에 월등한 용출효율을 보였다(Fig. 2(d)~(e)). 이는 교반과정이 미생물과 황, 토양의 접촉 기회를 높이고 O2 및 CO2 공급을 활발히 해주어 활성도를 높이기 때문일 것이다. 따라서 현장 적용시 교반과정을 생략해도 일정 수준의 중금속 제거효과를 기대할 수는 있으나 더욱 향상된 제거효율을 위해서는 교반과정이 수반되는 것이 좋다고 할 수 있다.
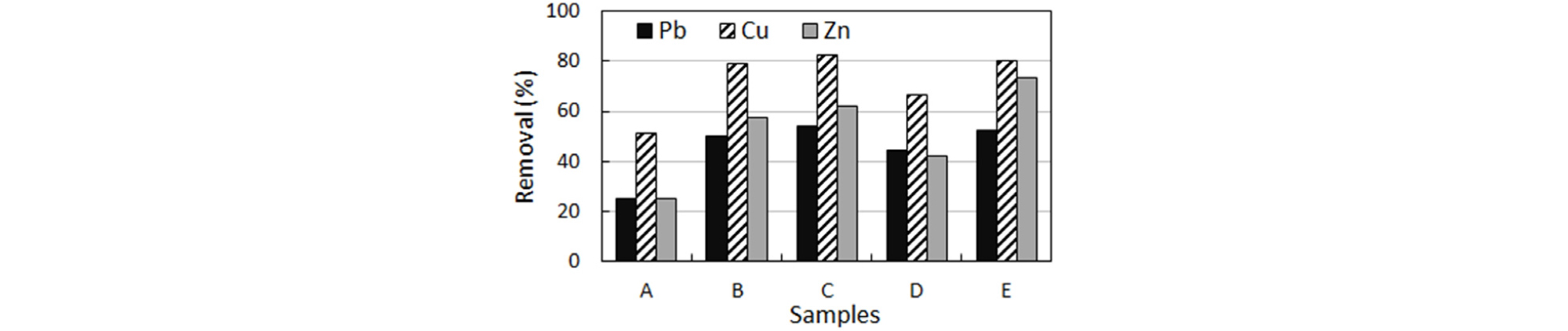
18일간의 용출 실험이 종료된 후 용액을 제거하고 잔류토양을 회수하여 자연 건조한 후 왕수분해를 실시하여 중금속 함량을 측정하였다. 처리 전 토양 내 함량과 비교하여 제거율을 계산한 결과, 최대 제거율은 Pb 54%, Cu 82%, Zn 73%이었다(Fig. 3).
교반하지 않고 무생물적으로 pH만 낮춘 화학적 용출의 경우(시료 A) 모든 중금속 용출량이 낮게 나타나 미립질 토양에서는 pH 조절에 의한 용출은 효율이 낮음을 나타내었다. 그러나 미생물학적 용출을 유도한 결과, Pb와 Cu의 경우에는 교반 여부와 상관없이 비슷한 용출 정도를 보였으며, Zn의 경우에는 교반을 수행한 결과에서 그렇지 않은 경우보다 높은 용출 효율을 나타내었다. 이 때 Fig. 2에 나타난 용출함량과 Fig. 3에 나타난 제거율 결과 간에 다소간의 차이를 보이는 것은 용출된 중금속이 모두 용존(dissolved) 상태로 존재하는 것이 아니라 콜로이드(colloid) 상태 또는 철 콜로이드 등에 흡착된 상태로 존재하는 부분이 상당량 있기 때문이다(Han et al., 2009). 콜로이드는 반응조에서 반응 후 상등액을 회수하는 과정에서 제거할 수 있으므로 용존상태의 중금속 제거와 동일한 효과를 거둘 수 있을 것이다.
대용량 증균 효율성
처리 토양의 규모가 커질수록 투입해야 하는 미생물 접종액의 부피도 증가한다. 이러한 경우 처리 현장에 대형 미생물 배양조를 설치하여 필요에 따라 즉각적으로 미생물을 공급할 필요성이 있다. 이 실험에서는 대용량 배양조건에서의 미생물 생장이 소규모 실험실 조건에서와 같이 효과적으로 발생하는지의 여부를 확인하였다.
이를 위하여 우선 계대배양시 접종량을 증가시키면 대용량 증균에 도움이 되는지의 여부를 확인하였다. 대부분 계대배양의 경우, 배양액 내에서 대수기(log phase) 또는 정지기(stationary phase)에 있는 미생물 일부를 신선한 배양액에 새로 접종하는 방식으로 수행된다. 이때 접종 미생물의 양을 증가한다면 원하는 pH까지 감소하는 시간을 단축할 가능성이 있다. 따라서 이 연구에서는 원심분리를 통해 A. thiooxidans를 최대한 농집하여 신선한 배양액에 접종한 후 배양액 pH 변화를 살펴 보았다. 실험을 위하여 3주간 배양된 pH 1.0의 A. thiooxidans 배양액 250 mL을 10,000 rpm으로 4°C에서 1 시간 동안 원심분리(한일, SUPRA R17)를 실시하였다. 원심분리 후 바닥에 농집한 미생물에 신선한 medium 125 용액 250 mL과 황 6 g을 공급한 후 pH를 2.0으로 조정하였다. 이는 일반적인 실험실 계대배양에 비하여 약 50배 농집된 접종량이다. 이후 시간에 따라 변화하는 pH를 1, 2, 3주에 각각 측정하였다.
일반 접종과 농집 접종의 pH 변화는 1주 경과시 1.2, 1.1, 2주 경과시 1.0, 1.0, 3주 경과시 1.0, 0.8의 값을 보였다. 농집 미생물을 접종한 경우 3주 경과시 다소 낮은 pH를 보였으나 일반적인 계대배양법과 그리 큰 차이를 보이지 않았다. 도리어 원심분리를 통한 농집에는 별도의 설비가 필요하고 기존의 계대배양법보다 시간이 소요된다는 단점이 있으므로, 이 결과만으로는 농집하여 접종한 경우의 특별한 이점을 찾기 어려웠다.
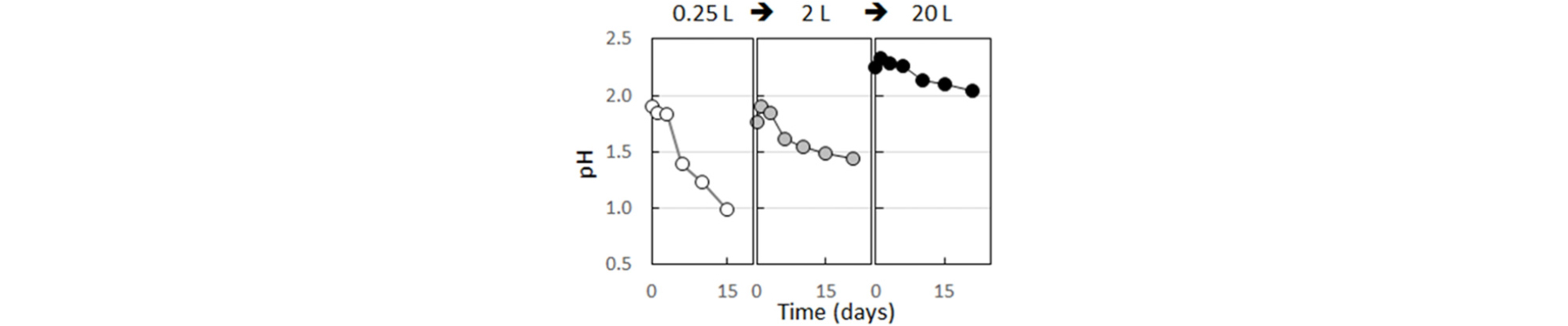
한편, 미생물 배양 규모를 순차적으로 확대하기 위하여 배양액 용량을 0.25 L → 2 L → 20 L로 증가시켰다. 투입되는 medium 125, 황, 미생물 접종액의 양은 0.25 L 경우의 0.1 L, 1 g, 10 mL를 기준으로 모두 동일한 비율로 증가시켰다. 이 때 순차적으로 증가하는 배양액의 초기 pH는 따로 조절하지 않았다. 0.25 L 용량의 A. thiooxidans 배양액에서 초기 pH 1.9는 15일 경과 후 1.0까지 감소하였다(Fig. 4). 이 배양액으로 계대배양을 실시한 2 L 배양액에서는 초기 pH 1.8이 15일 경과 후 1.5로 감소하였다. 배양액 용량이 8배 증가하면서 동일 시간의 pH 감소폭이 적어진 것을 확인하였다.
다시 이를 20 L 배양액에 접종한 경우, pH 감소폭은 더욱 적어 21일 경과한 후에도 pH 2.0으로 측정되었다. 이 결과는 배양액의 화학적 조건이 같더라도 용량이 커질수록 pH 감소폭도 적고 최종 pH도 상승함을 나타낸다. 따라서 현장 적용용 대용량 A. thiooxidans 접종액을 준비할 경우 소용량에 비하여 장기간의 배양기간이 필요할 수도 있음을 예상하여야 할 것이다.
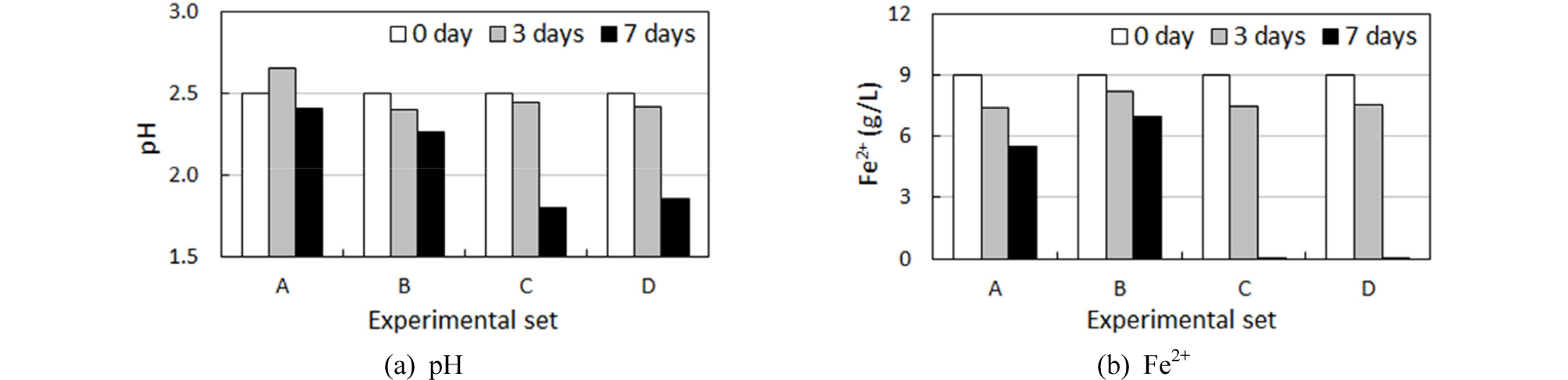
한편, A. thiooxidans와 함께 널리 이용되는 철산화균인 A. ferrooxidans에 의한 증균 효과도 살펴보았다. 이 실험에서는 대용량 증균 효과 뿐만 아니라 교반 및 CO2 주입 등의 추가적인 조건을 적용하였다. 미생물 배양액 용량은 0.1 L(1 단계) → 0.3 L(2 단계) → 1 L(3 단계) → 30 L(4 단계) → 1,000 L(5 단계)로 순차적으로 증가시켰다. 투입되는 9K medium, Fe2+, 미생물 접종액의 양도 모두 동일한 비율로 조정하였다. 이 때 30 L(4단계) 배양액 실험에서는 교반 및 CO2 공급의 영향을 함께 살펴보았다(Table 1). 4단계까지의 실험에는 A. ferrooxidans를 접종하지 않은 비교시료도 포함하여 결과를 비교하였다.
Table 1.
Experimental conditions of sequential increase in culture medium volume
1, 2단계 실험 결과, 미생물 시료에서 3일 경과 후 초기 pH 2.5에서 pH 1.8까지 감소한 반면, 무생물 비교시료의 경우 변화가 없었다. 또한 미생물 시료에서는 투입한 Fe2+가 모두 Fe3+로 산화되었으나 비교시료의 경우 초기 Fe2+ 농도에서 큰 변화를 보이지 않았다. 3단계 실험에서는 3일 경과하였을 때 미생물 접종시 pH 2.5에서 pH 2.0으로 감소하였으며, 비교시료에 비하여 매우 많은 양의 Fe2+를 산화시켜 270 mg/L의 Fe2+가 잔류하였다. 그러나 A. thiooxidans와 동일하게 배양액 규모가 증가하면 pH 감소 및 Fe2+ 산화능력이 저하되는 것이 나타났다.
교반과 CO2 투입의 영향을 고려한 4단계 실험의 결과, 초기 3일간은 모든 실험 조건에서 큰 변화를 보이지 않았으며 특히 미생물 시료에서도 pH가 크게 감소하지 않았다. 그러나 실험 기간을 7일로 연장한 결과, 교반을 수행한 미생물 접종 시료(C와 D)에서 급격한 pH 감소를 보인 반면, 교반하지 않은 A, B 시료에서는 미생물 주입 여부에 관계없이 pH 감소폭이 매우 적었다(Fig. 5(a)). 별도의 CO2 공급은 추가적인 pH 감소효과를 보이지 않았다. Fe2+ 산화능력 역시 3일 경과 시까지는 A. ferrooxidans를 주입한 시료와 비교시료 간 차이가 크지 않았으나, 교반 시료는 7일 후부터 매우 향상된 Fe2+ 산화를 나타냈다(Fig. 5(b)). 이 결과는 현장 적용을 위한 대용량 증균이 필요할 경우 배양액의 교반과정이 반드시 요구될 수도 있음을 나타낸다.
5단계 실험에서는 1,000 L 용량의 A. ferrooxidans 배양을 시도하였다. 이를 위하여 교반장치가 설치된 2,000 L 규모의 내산성 재질 배양조 두 개를 설치하였다. 동일 조건에서 순응(acclimation)한 미생물의 작용을 보기 위하여 1차 배양조에서 8일간 배양한 미생물을 2차 배양조로 접종하여 pH와 Fe2+ 산화를 조사하였다.
1차 배양에서는 초기 pH 3.0에서 8일 경과 후 pH 2.2로 감소하였으나 2차 배양에서는 7일 경과 후 pH 1.9까지 감소하였다(Fig. 6(a)). 이는 아마도 1차 배양에서 주어진 조건에 순응한 A. ferrooxidans가 동일 조건인 2차 배양에서는 대사작용이 상대적으로 신속하게 진행되기 때문인 것으로 보이며, 이는 대규모 배양을 효과적으로 수행할 수 있는 가능성을 나타내는 것이다. Fe2+ 함량 역시 시간이 경과함에 따라 더욱 빠르게 감소하는 모습을 보였다(Fig. 6(b)). 특히 4단계 실험에서 Fe2+의 완전한 산화에 7일이 소요된 것과 비교하였을 때, 무려 1,000 L의 배양액에서 7~8일만에 많은 양의 Fe2+ 산화가 이루어졌다는 것은 특기할 만하다.
Fe2+ 주입량 효율 비교
A. ferrooxidans의 에너지원으로 공급하는 Fe2+는 비용을 증가시키고, 이 때 생성되는 이차 Fe(III) 광물은 다른 중금속과 흡착 및 공침 현상을 일으켜 중금속 용출 효율을 저해할 수 있다. 따라서 A. ferrooxidans의 에너지원으로써 공급하는 Fe2+ 함량의 최적 조건 도출은 원활한 미생물 생장, 경제성 확보, 용출효율 극대화라는 측면을 모두 만족시키기 위하여 반드시 필요하다. 이 연구에서는 A. ferrooxidans의 에너지원이 되는 Fe2+의 함량을 다양하게 변화시키며 실험을 진행하였다.
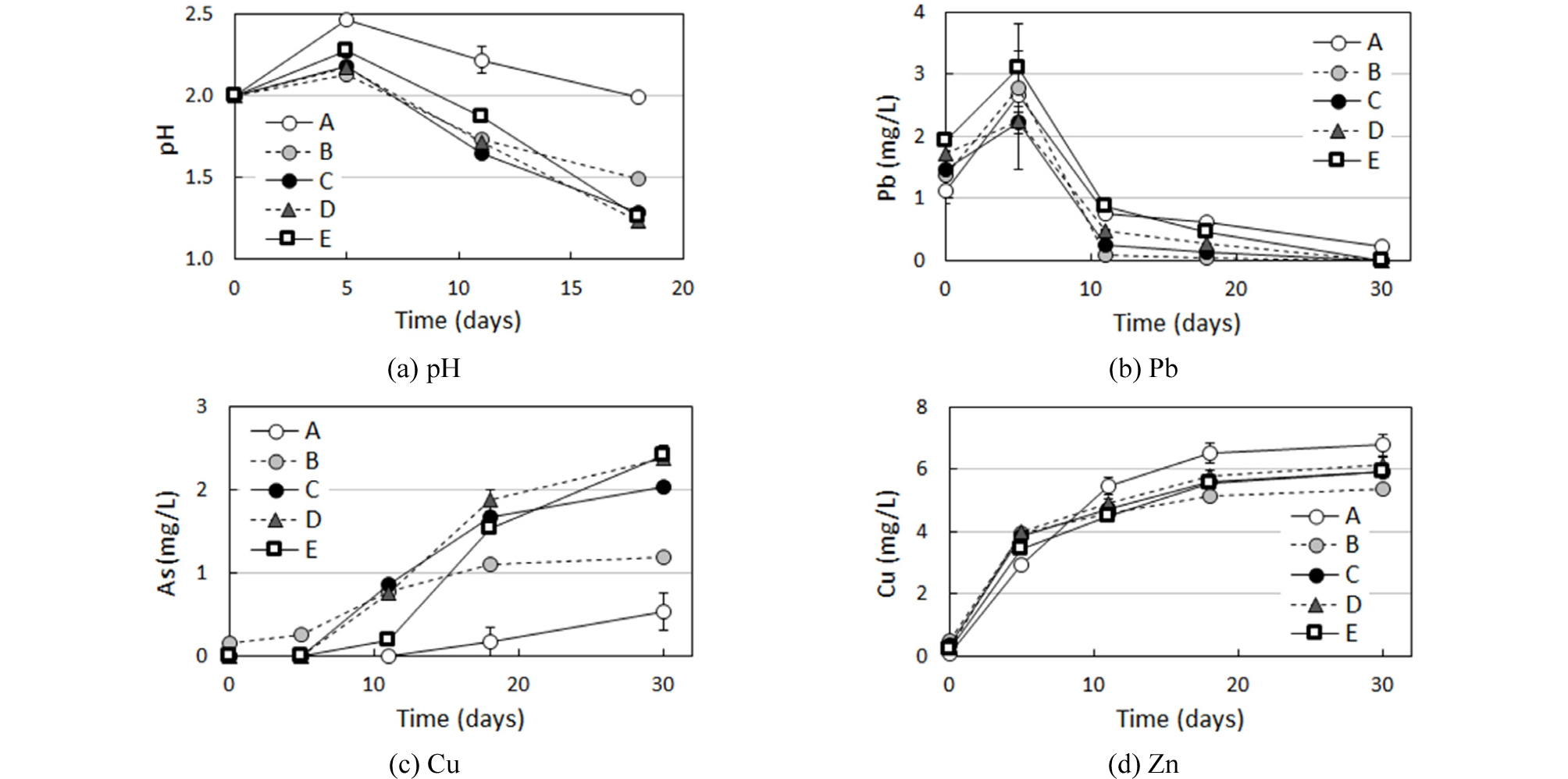
제련소 주변 오염 토양 시료 15 g에 Fe2+ 9 g이 포함된 Solution A 용액 300 mL을 넣어 슬러리를 제조한 후 A. ferrooxidans 30 mL을 접종한 시료와 멸균된 증류수 30 mL을 넣어준 비교시료(실험 A)로 나누어 용출 실험을 진행하였다. 또한 Fe2+의 함량변화에 따른 용출 효율의 차이를 확인하기 위해 3 g, 6 g, 9 g, 12 g의 Fe2+를 주입한 시료(각각 실험 B, C, D, E)를 동시에 운용하였다. 모든 실험은 중복실험을 실시하였고 초기 pH는 2.0으로 조정하였다.
시간에 따른 용액 내 pH 변화 결과, 무생물 비교시료의 경우 초기에 조정한 pH 2.0보다 시간이 경과함에 따라 점차 증가하는 모습을 보였으나, 실험 경과 5일 이후부터 점차적으로 pH가 감소하는 모습을 보였다(Fig. 7(a)). 반면 A. ferrooxidans 및 Fe2+를 주입한 B, C, D, E 시료의 경우, 실험 초기에는 토양 완충능에 의해 pH가 증가하는 경향을 보였으나, 실험이 진행되면서 점차 감소하여 최종적으로 비교시료에 비해 매우 낮은 pH를 나타내었다. Pb의 경우 전체 시료에서 동일한 용출 양상을 보였다. 실험 초기에는 주입한 Fe2+ 함량과 비례하여 용출량이 증가하였으나, 5일 경과 후부터 급격히 용출량이 감소하였고 실험 30일째에는 용존 Pb가 거의 정량되지 않았다(Fig. 7(b)). 이는 앞에서 밝힌 바와 같이, 9K medium 중 Solution B에 포함된 SO42-가 용출된 Pb2+와 결합하여 PbSO4를 형성, 침전하였기 때문으로 보인다. As의 경우, 비교시료인 A에 비해 미생물 시료인 B, C, D, E에서 높은 용존 함량을 보였다(Fig. 7(c)). Fe2+ 3 g/L를 주입한 시료의 경우, 비교시료에 비해 높은 용출량을 보였으나 다른 미생물 시료에 비해 낮은 용출 효율을 보였다. Cu의 경우 비교시료인 A에서도 높은 용출효율을 보여 미생물 시료와 차이가 없었으며 이는 pH 2.5 이하의 산성 조건에서 Cu가 잘 용출될 수 있음을 나타낸다(Fig. 7(d)).
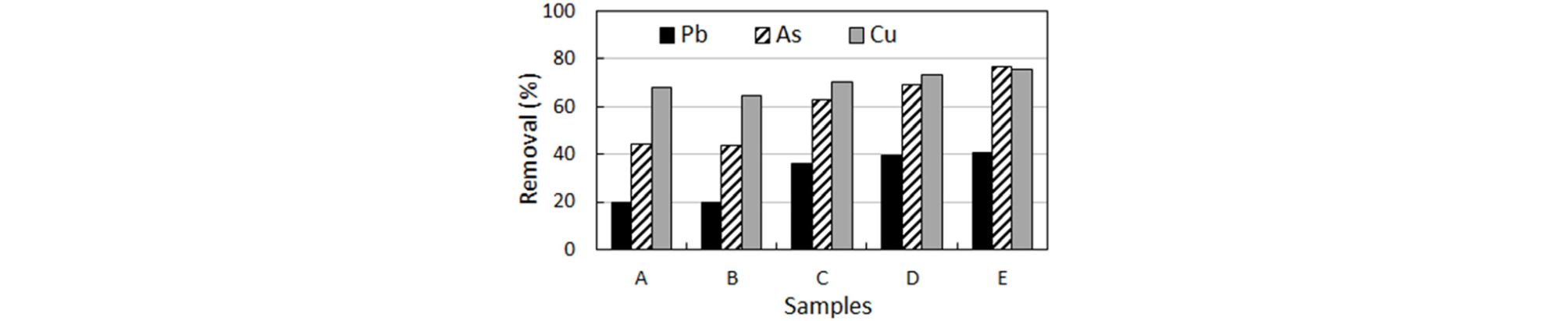
30일간의 중금속 용출실험이 종료된 후 잔류 토양을 왕수분해하여 중금속 함량을 분석하고 처리 전 토양의 중금속 함량과 비교하여 용출효율을 계산하였다. Pb의 경우, 비교시료인 A에 비해 미생물 시료인 C, D, E에서 높은 용출 효율을 보였으며 C, D, E 시료 간 용출 효율의 차이는 크지 않았다. 반면에 미생물 시료 중 Fe2+ 3 g/L를 주입한 B 시료의 경우 다른 미생물 시료에 비해 매우 낮은 효율을 나타내었다(Fig. 8).
As의 경우에도 비교시료에 비해 Fe2+를 6 g/L 이상 공급한 미생물 시료에서 매우 높은 용출량을 보였다. 이는 다른 중금속과 지구화학적 거동을 달리하는 As의 토양 오염에 대해서도 A. ferrooxidans를 이용한 미생물학적 용출법의 적용 가능성을 보여주는 것이라 할 수 있다. Cu의 경우에도 E 시료에서 가장 높은 용출 효율을 보이는 등 As 및 Pb와 동일한 경향을 보였으나 비교시료와 미생물 시료간의 차이는 크지 않았다.
위와 같은 결과로 보아, A. ferrooxidans를 이용한 미생물학적 용출의 현장 적용 가능성을 확인하였으며 향후 현장 적용 시 대량의 Fe2+가 주입된다는 점을 고려하였을 때, Fe2+ 함량 6 g/L 정도의 공급으로 As 60% 이상, Cu 70% 이상의 제거효율을 보임을 알 수 있었다.
결 론
중금속으로 오염된 광물찌꺼기, 토양, 퇴적물 등을 황 및 철산화균을 이용한 미생물학적 용출법을 통해 처리하는 실험실적 연구는 다수 수행된 바 있다. 이 연구는 미생물학적 용출법을 현장에 적용하려 할 때 직면할 수 있는 여러 기술적 문제를 해결할 방안을 모색하기 위하여 수행하였다. 현장에서 용출법을 적용하는 방안으로는 오염 토양을 굴착하지 않고 원위치에서 미생물학적으로 용출시킨 후 동전기적(electrokinetic) 방법으로 제거하는 방안도 고려할 수 있으나(Lee et al., 2009), 여기서는 처리 토양 현장 주변에 대용량 미생물 배양조와 반응조를 설치하고 오염 토양을 굴착하여 세척하는 과정을 예상하였다.
실험 결과, 교반 과정이 효과적인 중금속 용출을 위해 필요한 것으로 나타났다. 또한 순차적으로 용량을 증가하며 미생물을 배양하고 최종 용량에서 계대배양을 거듭할수록 미생물 활성도를 최적화하는데 소요되는 시간이 감소하는 것으로 나타났다. 미생물학적 용출법은 미립질 토양에도 적용 가능한 것으로 나타났다. 그리고 A. ferrooxidans를 이용할 경우 에너지원으로서 보통 9 g/L의 Fe2+ 투입이 요구되나 현장 조건에 따라 이보다 적은 양의 Fe2+ 투입량으로도 높은 제거효율을 얻을 수 있었다. 최적 Fe2+ 투입량 결정은 현장 토양을 대상으로 한 사전 실험실 연구에서 얻을 수 있을 것이다. pH, 온도, O2, CO2 조건을 현장에서 조절해 줄 필요가 있으므로 배양조 및 반응조에는 교반장치 및 pH 조절장치 등이 포함되는 것이 유리할 것이며 추가적으로 동절기에 운전할 경우를 대비하여 온도조절장치 또는 설비가 설치되면 좋을 것이다.
토양 내 토착 미생물 중 호산성 철 및 황산화균이 존재할 것이므로 이들의 생장에 유리한 조건을 형성하였을 때 이들 미생물이 활성화될 것을 이용할 수도 있다. 배양 조건인 낮은 초기 pH 및 배양액 공급 등은 중성 pH 조건에서 생장하는 다른 토양 내 토착 미생물에게는 분명히 불리한 조건이나, 철 또는 황산화를 통해 에너지를 얻는 호산성균에게는 배타적으로 생장할 수 있는 좋은 조건이 될 것이다. 이 연구에서는 토양 내 존재하는 토착 미생물 군집 조성에 대한 분석을 수행하지 않았으나, 인도의 구리광산 광물찌꺼기에 대한 메타지놈(metagenome) 분석 결과, Sulfobacillus, Leptospirillum, Acidithiobacillus 등의 호산성 철 및 황산화균이 동정되었으며(Gupta et al., 2017), 중국의 구리 광물찌꺼기와 러시아의 금 광물찌꺼기에서는 Acidithiobacillus 속이 가장 많이 존재하는 것으로 밝혀졌다(Zhang et al., 2016; Mardanov et al., 2017). Cd로 오염된 중성 pH의 토양에 대한 메타지놈 분석에서도 Thiobacillus 속이 검출되었다(Feng et al., 2018). 그러나 현장에서 토양 또는 광물찌꺼기를 처리할 경우, 원하는 pH 및 산화환원전위 조건 등을 만족하기 위해서는 상대적으로 오랜 시간이 필요하므로 인위적으로 철 및 황산화균을 접종하는 것이 한층 유리한 조건이라 생각한다.
이외에 시약으로서 Fe2+를 공급하는 방안 뿐만 아니라 황철석 등 용이하게 얻을 수 있는 Fe2+ 공급원을 이용하는 방안, medium 125 또는 9K medium 등 외부에서 공급하여야 하는 영양분 대신 토양 자체에 있는 염류를 영양분으로 이용하는 방안도 고려할 수 있다(Lee et al., 2005).
황산화균을 이용하여 Pb를 용출하여 제거하려 할 경우 단점은 SO42-가 Pb2+와 결합하여 PbSO4를 형성하며 침전한다는 것이고, 철산화균을 이용할 경우 철백반석 등의 이차광물을 형성하여 용존된 중금속을 흡착 또는 공침전한다는 단점이 있다. 그러나 최종 처리 토양을 조사해보면 높은 제거효율을 얻을 수 있었으며 이는 중금속이 상등액 내 콜로이드로 존재하는 부분이 많기 때문으로 상등액을 제거할 때 같이 제거되므로 결과적으로 양호한 제거효과를 볼 수 있을 수 있을 것으로 예상한다.