서 론
주체(Host)와 객체(Guest) 시스템으로 구성되는 포접화합물(Inclusion compound)의 일종인 크러스레이트 하이드레이트(Clathrate hydrate)는 주체 분자 간의 수소 결합을 통해 형성된 동공(Cage) 구조 내에 객체 분자가 포집된 결정성 구조를 일컫는다(Sloan, 2003). 일반적으로 다양한 결정구조가 존재하는데 자연계에 가장 널리 알려진 하이드레이트 구조로는 구조 I(Structure I), 구조 II(Structure II), 구조 H(Structure H)가 있다(Sloan, 2003). 하이드레이트 구조를 구성하는 동공은 주체 분자들의 수소 결합 형태에 따라 동공의 크기와 모양이 결정되게 되며, 동공을 구성하는 면의 종류와 개수를 이용하여 표시한다. 예를 들어, 12개의 5각면(Pentagonal Face)이 모여 동공 구조를 형성할 경우 512 동공, 12개의 5각면과 2개의 6각면(Hexagonal Face)이 동공구조를 구성할 경우는 51262 동공이라고 명명한다(Sloan, 2003).
구조 I 하이드레이트는 46개의 물 분자와 함께 2개의 512 동공, 6개의 51262 동공으로 구성되며, 구조 II 하이드레이트는 136개의 물 분자, 16개의 512 동공, 8개의 51264 동공으로 구성된다(Youn et al., 2016). 구조 I과 구조 II 하이드레이트는 입방정계 결정구조를 기본으로 각각 Pm3n과 Fd3m 공간군(Space group)을 지니며, 34개의 물 분자와 함께 3개의 512 동공, 2개의 435663 동공, 1개의 51268 동공으로 구성되는 구조 H 하이드레이트는 육방정계 P6/mmm의 공간군을 지니고 있다(Youn and Cha, 2018).
하이드레이트 구조의 형성(Formation)은 물과 가스가 존재하는 상황에서 일반적으로 낮은 온도와 높은 압력의 조건을 만족하는 열역학적 조건(Thermodynamic condition)에서 이루어지게 된다. 이를 만족하는 다양한 해상 및 육상 지역에서 막대한 양의 천연가스(Natural gas)가 하이드레이트의 형태로 저장되어 있다는 사실이 밝혀짐에 따라, 대체에너지원으로서의 하이드레이트에 관한 관심이 점점 증대되었다(Makogon, 1965; Macdonald, 1990; Milkov, 2004; Klauda and Sandler, 2005; Chong et al., 2016; Gil et al., 2017; Huh and Lee, 2017). 하지만 이러한 대체에너지원으로의 하이드레이트에 대한 시선과는 별개로, 산업계에서의 하이드레이트는 석유나 천연가스의 수송 과정 중 송유관(Pipeline)을 막게 하는 주범으로 여겨짐에 따라 극복해야 할 과제로 여겨지고 있다. 하이드레이트 형성을 통한 송유관 막힘 현상을 해결하기 위한 방법으로 억제제(Inhibitor)의 투입이 제시되었으며, 메탄올(Methanol)은 대표적인 열역학적 하이드레이트 억제제(Thermodynamic hydrate inhibitor)로 알려져 있다(Hammerschmidt, 1934; Cha et al, 2013a; Cha et al., 2013b).
메탄올의 투입에 따라 하이드레이트 형성을 위한 열역학적 조건은 더 높은 압력과 낮은 온도로 이동하게 되며, 이는 메탄올과 물의 강력한 수소 결합을 통한 동공 구조 형성의 방해에 기인한 것이라 알려져 있다(Hammerschmidt, 1934; Cha et al., 2013a; Cha et al., 2013b). 하지만 최근의 연구결과에서 하이드레이트 합성 방법에 따라 달라지기는 하지만 동공 내에 메탄올이 포집될 수도 있다는 연구결과가 알려지면서, 메탄올의 전통적인 역할에 대한 재해석이 이루어진 바 있다(Shin et al., 2013). 또한, 불화암모늄(Ammonium fluoride)을 물로 구성된 동공 구조에 포함 시킬 경우, 메탄올과 같은 강력한 열역학적 하이드레이트 억제제가 동공에 매우 쉽게 포집 된다는 연구결과도 연이어 발표된 바 있다(Shin et al., 2014; Shin et al., 2017). 메탄올의 하이드레이트 동공 내 포집은 구조 I 하이드레이트에서 뿐만 아니라, 구조 II나 구조 H 하이드레이트에서도 가능함을 확인하였다. 물로 구성된 동공 구조에 불화암모늄의 투입은 하이드레이트 시스템에서의 결정 공학(Crystal engineering) 도입을 가능하게 하였으며, 하이드레이트 동공 구조를 이해하고 성질을 개선하기 위한 중요한 발견으로 여겨지고 있다. 수소 결합을 기반으로 한 하이드레이트 동공 구조는 온도 변화, 즉 열적 거동에 따라 민감하게 반응하기 때문에 하이드레이트의 미시적(Microscopic)/거시적(Macroscopic) 거동을 이해하기 위해서는 열팽창 거동(Thermal expansion behavior)에 대한 이해가 필수라 할 수 있다.
따라서 이 논문에서는 불화암모늄이 포함된 크러스레이트 하이드레이트의 열팽창 거동에 대한 연구를 수행하였다. 불화암모늄과 물로 구성된 동공 구조 안에 프로필렌 옥사이드(Propylene oxide), 2-메틸-2-프로펜-1-올(2-Methyl- 2-propen-1-ol), 그리고 메탄올을 포집시켜 형성된 하이드레이트 구조를 X선 회절(X-ray diffraction) 실험을 통해 분석하였다. 또한 온도에 따른 X선 회절분석 실험을 수행하여 형성된 하이드레이트의 격자 상수(Lattice parameter), 열팽창률(Themal expansivity)를 분석하여 객체 분자의 크기와 모양으로 인한 하이드레이트의 열팽창 거동을 분석하였다.
실험방법
이 연구에 사용한 불화암모늄(Ammonium fluoridem, NH4F)은 98.0 mol%의 순도를 가진 제품을 Sigma-Aldrich로부터 구매하여 사용하였다. 마찬가지로 2-메틸-2-프로펜-1-올(2-Methyl-2-propen-1-ol, C4H8O), 프로필렌 옥사이드(Propylene oxide, C3H6O), 메탄올(Methanol, CH3OH)은 각각 98.0, 99.5, 99.9 mol%의 순도를 가진 제품을 Sigma-Aldrich로부터 구매한 후 이용하였다.
이 연구 논문에서 하이드레이트 샘플을 제조하기 위하여 불화암모늄을 초순수물(ultra-high purity deionized water)에 녹여 25 mol%의 농도로 수용액을 제조하여 사용하였다. 먼저, 불화암모늄을 초순수물에 천천히 결정이 모두 녹을 때까지 저어주며 녹여주었다. 그 뒤, 25 mol%의 불화암모늄 수용액을 액체질소(Liquid nitrogen)에 마이크로 피펫(Micro pippet)을 활용하여 방울로 떨구어주어 급랭(Quenching)시켰으며, 얼어붙은 불화암모늄 수용액 샘플은 액체질소의 조건에서 100 µm의 고운 분말(powder) 시료로 분쇄하여 203.15 K의 저온 냉동고에 5시간 보관하였다. 메탄올과 2-메틸-2-프로펜-1-올, 그리고 메탄올과 프로필렌 옥사이드는 각각 2:1의 몰 비율로 혼합하여, 203.15 K의 저온 냉동고에 5시간 보관하여 냉각시켜 주었으며, 분쇄된 불화암모늄 수용액 샘플 2 g을 4 mL의 혼합 시약(메탄올과 2-메틸-2-프로펜-1-올, 메탄올과 프로필렌 옥사이드)에 첨가하여 20 mL의 바이알(Vial) 병에 담아 잘 혼합하여 저온 냉동고에서 약 5일간 보관하며 하이드레이트 샘플을 형성시켰다. 제작된 하이드레이트 샘플은 진공펌프(Vacuum pump)를 활용하여 6시간 동안 과량의 액상 샘플을 제거하기 위한 작업을 수행하였으며, 그 뒤 액체질소의 온도에서 100 µm의 고운 분말 시료로 다시 분쇄하였다.
제작된 분말 하이드레이트 샘플은 포항 가속기 연구소(Pohang accelerator laboratory, PAL)의 9B 빔라인을 활용하여 고분해능 분말 회절(High-resolution powder diffraction) 분석을 통하여 구조 분석 연구를 수행하였다. θ-2θ 회절법을 사용하여 5~125°의 범위에서 측정이 이루어졌으며, 0.15173 nm의 파장(Wave length)을 이용한 방사광 가속기 빔을 사용하였으며, 측정온도는 하이드레이트의 해리를 막기 위해 80 K에서 진행되었다.
결과 및 토의
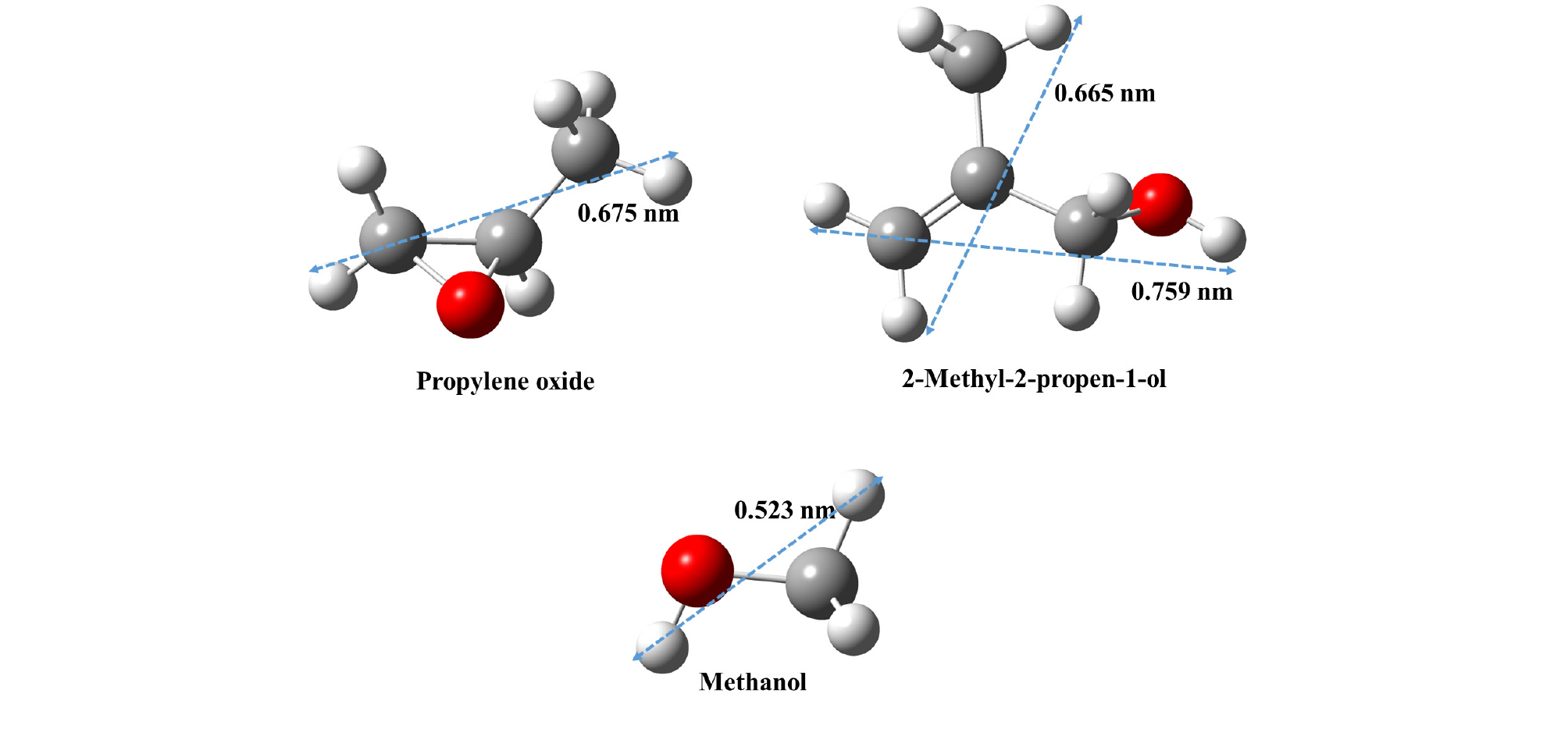
하이드레이트 동공은 일반적으로 물 간의 수소 결합, 이 연구에서는 물, 불화암모늄으로 구성된 주체 구조 사이의 수소 결합으로 결정되는 만큼 동공의 크기 대비 포집 되는 객체 분자의 크기와 모양은 하이드레이트 구조의 예측에 중요한 변수로 작용한다(Sloan and Koh, 2008). 이에 따라 밀도범함수(Density functional theory, DFT) 이론을 기반으로 B3LYP 기법, 6-311++G(d, p)의 기저 세트(Basis set)의 범위까지 분자의 형태와 크기에 대한 최적화를 Gassian 03 프로그램(Frisch et al., 2004)을 통해 수행하였으며, 그 결과는 Fig. 1과 같다.
구조 I 하이드레이트를 구성하는 512와 51262 동공의 크기는 문헌에 따르면 일반적으로 약 0.510 nm와 0.590 nm로 보고되고 있어, 메탄올(0.523 nm)의 포집은 가능한 것으로 예측되지만 2-메틸-2-프로펜-1-올(0.759 nm)과 프로필렌 옥사이드(0.675 nm)의 경우 힘들 것으로 판단된다(Sloan and Koh, 2008). 그에 반하여 구조 II 하이드레이트를 구성하는 51264 동공의 크기는 약 0.67 nm로 보고되어, 분자 구조의 왜곡(distortion) 또는 수소 결합을 통한 주체 – 객체의 화학적 결합(Chemical interaction) 등에 의해 포집이 가능할 것으로 기대된다(Sloan and Koh, 2008).
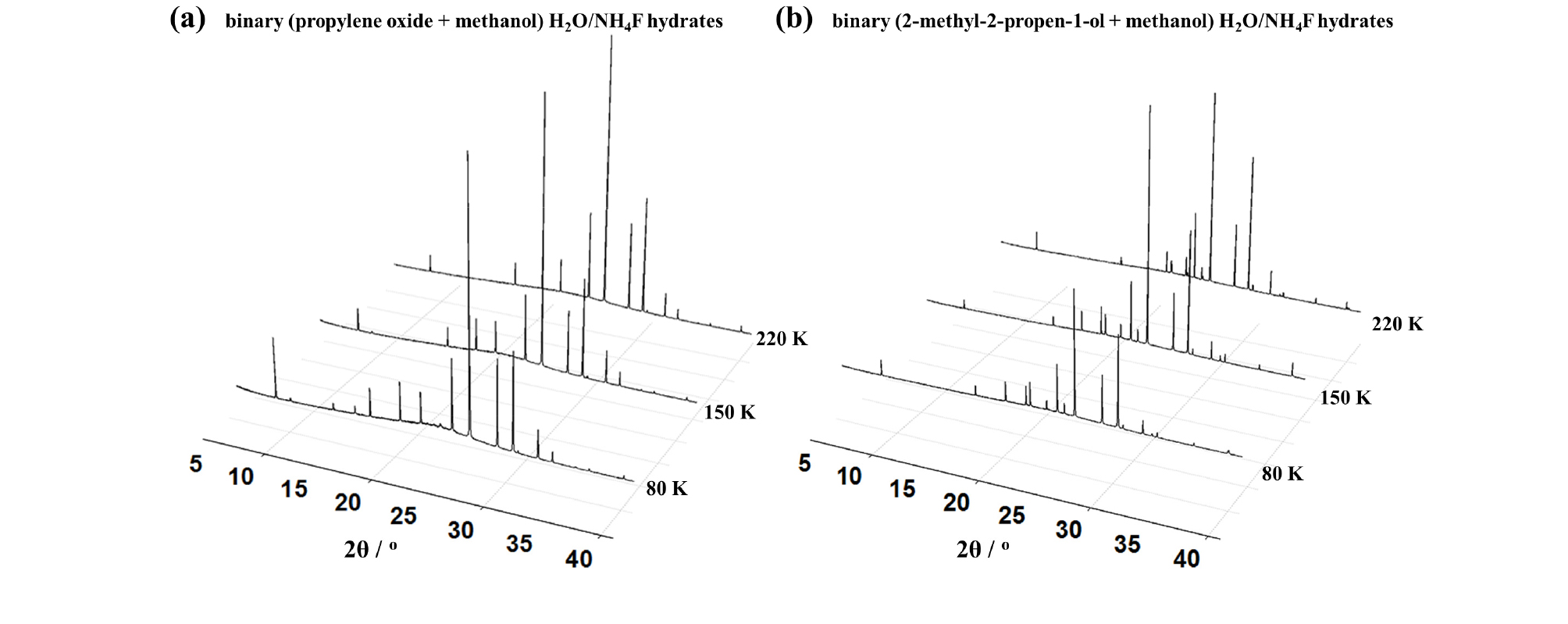
이에 따라 물과 불화암모늄을 주체 구조로, 각각 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트와 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트 샘플에 대한 고분해능 분말 회절 분석 측정 결과는 Fig. 2와 같다. 하이드레이트 샘플의 측정은 샘플의 손상을 막기 위하여 80 K의 온도에서 먼저 수행하였으며, 온도 변화에 따라 열적 거동을 파악하기 위하여 150 K, 220 K의 온도에서 추가적으로 실험을 진행하였다. 측정 결과, 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트, 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트 샘플 모두 온도 변화에 상관없이 본래의 구조 변화는 발생하지 않는 것으로 판단된다. 또한 온도 변화가 진행되는 동안, 피크의 세기(Intensity) 변화는 발생하였지만 관찰되지 않던 새로운 피크(Peak)가 보이는 특징적인 변화는 분석되지 않았다. 따라서 온도 변화에 따라 초기에 생성된 하이드레이트의 구조 변이(Structural transition)나 해리(Dissociation)는 발생하지 않았다고 여겨진다.
80 K에서 측정된 고분해능 분말 회절 분석 결과를 토대로 제조된 하이드레이트의 구조, 격자상수(Lattice constant)를 FULLPROF 프로그램(Rodríguez-Carvajal, 1993)을 활용하여 Le Bail Fitting을 기반으로 한 Profile Matching 분석을 수행하였으며, 그 결과는 Fig. 3과 같다(Ahn et al., 2019a; Ahn et al., 2019b; Ahn et al., 2019c; Min et al., 2019). Le Bail Fitting을 기반으로 한 Profile Matching 분석은 동공 내 하이드레이트의 객체 점유 현상까지 정확하게 분석하지는 못하지만, 하이드레이트의 결정구조 및 격자상수 분석에도 유용하게 사용되고 있다(Ahn et al., 2019a; Ahn et al., 2019b; Ahn et al., 2019c; Min et al., 2019).
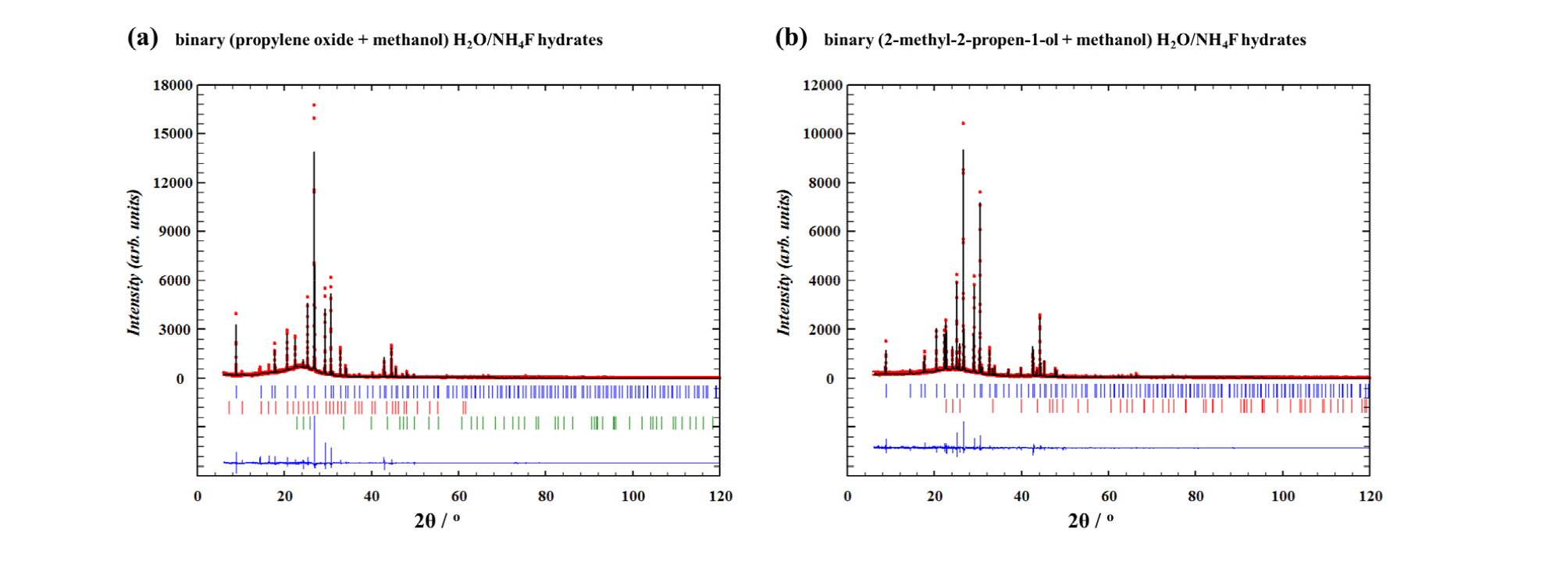
Fig. 3.
High-resolution synchrotron powder X-ray diffraction patterns of (a) the binary (propylene oxide + methanol) H2O/NH4F hydrates at 80 K (red dot, experimental results; black solid line, refinement by Rietveld analysis with the profile matching mode; blue bars, Bragg peak position of structure II hydrate; red bars, Bragg peak position of structure I hydrate; green bars, Bragg peak position of hexagonal ice) and (b) the binary (2-methyl-2-propen-1-ol + methanol) H2O/NH4F hydrates at 80 K (red dot, experimental results; black solid line, refinement by Rietveld analysis with the profile matching mode; blue bars, Bragg peak position of structure II hydrate; red bars, Bragg peak position of hexagonal ice).
Fig. 3a에 나타난 그림은 물과 불화암모늄이 포함된 주체 구조에 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트에 대한 분석 결과로 빨간 점은 실제로 측정된 고분해능 분말 회절 분석 결과를 나타내고 있다. 그림의 검은 선은 하이드레이트 구조를 예측한 결과를 토대로 Le Bail Fitting한 결과를 나타내며, 그림 하단의 파란 선은 실제 측정 결과와 예측 결과 사이의 차이를 의미한다. 파란색 막대는 구조 II 하이드레이트의 결과로부터 나타난 브래그 피크(Bragg peak)의 위치를, 빨간색 막대는 구조 I 하이드레이트의 결과로부터 나타난 브래그 피크를, 마지막으로 녹색 막대는 물과 불화암모늄으로부터 생성된 육방정계 구조(Hexagonal structure)로 인해 나타난 브래그 피크를 포함하고 있다. 물과 불화암모늄이 포함된 주체 구조에 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트의 구조는 객체 분자의 크기로부터 구조 I 하이드레이트가 형성되기에는 힘들다는 사실을 분자 크기 분석 결과(Fig. 1)로부터 확인하였기에, 구조 I 하이드레이트의 형성은 프로필렌 옥사이드는 포함하지 않는 메탄올이 포집된 하이드레이트 구조가 불순물(Impurity)로 생성된 것이라 여겨진다. 또한 육방정계인 물과 불화암모늄의 구조 또한 불순물로 소량 검출된 것으로 여겨지며, 주된 분말 회절 분석 결과는 프로필렌 옥사이드와 메탄올이 포집된 구조 II 하이드레이트의 형성을 나타내고 있다. 이는 프로필렌 옥사이드와 물로 구성한 하이드레이트의 구조가 구조 II를 나타낸다는 문헌의 보고를 기초로 하였을 때, 그리 놀라울 만한 결과는 아닌 것으로 판단된다. 구조 II 하이드레이트(Fd3m)로 분석된 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트의 격자상수는 분석결과 a = 1.696 nm으로 분석되었으며, 이는 일반적으로 구조 II 하이드레이트의 격자상수로 알려진 a = 1.720 nm와 비슷한 값으로 문헌의 결과와 유사한 것을 확인할 수 있었다(Sloan and Koh, 2008). 하지만 프로필렌 옥사이드와 물만으로 형성된 구조 II 하이드레이트의 격자상수는 a = 1.714 nm로 보고되고 있는 만큼, 주체 구조에 첨가된 불화암모늄의 기여로 인하여 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트의 격자상수는 작아진 것으로 여겨진다(Sloan and Koh, 2008; Jones and Nevers, 2010).
Fig. 3b는 물과 불화암모늄이 포함된 주체 구조에 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트에 대한 분석 결과로 Fig. 3a의 결과와 유사하게 구조 II 하이드레이트(Fd3m)로 분석된 하이드레이트의 구조 형성이 주로 분석되었다. 소량의 물과 불화암모늄으로 구성된 육방정계 구조가 검출되었으며, 2-메틸-2-프로펜-1-올과 메탄올이 포집된 구조 II 하이드레이트의 격자상수는 a = 1.708 nm로 나타났다. 이 전의 연구 결과에서 물로 구성된 주체 구조에 2-메틸-2-프로펜-1-올과 메탄 가스가 포집된 하이드레이트의 격자상수가 a = 1.725 nm로 나타났던 결과와 비교하여 보았을 때, 상당히 수축된 구조 II 하이드레이트의 형성을 관찰할 수 있다(Ahn et al., 2019a). 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트와 유사하게 물과 불화암모늄을 기반으로 형성한 주체 구조의 경우, 순수하게 물로 구성된 하이드레이트 구조에 비하여 상대적으로 수축된 격자상수 값을 나타내는 것으로 확인되었다. 이는 물과 물 간의 수소 결합 길이에 비하여 수축된 물과 불화암모늄, 불화암모늄과 불화암모늄 간의 수소 결합 길이에 기인한 현상이라고 분석된다(Shin et al., 2013; Shin et al., 2014; Shin et al., 2017). 이 연구에서 분말 회절 패턴은 Le Bail Fitting을 기반으로 한 Profile Matching을 기반으로 분석을 수행하였기에, 2-메틸-2-프로펜-1-올, 프로필렌 옥사이드, 메탄올의 하이드레이트 내 동공 포집을 직접적인 증거로 규명하지는 못하였다. 하지만, Fig. 1과 같이 메탄올(0.523 nm), 2-메틸-2-프로펜-1-올(0.759 nm), 프로필렌 옥사이드(0.675 nm)의 분자 크기와 형태 및 이전 연구 결과의 발표에 따르면 각각 메탄올은 구조 II의 512 동공에, 2-메틸-2-프로펜-1-올(0.759 nm)과 프로필렌 옥사이드(0.675 nm) 51264 동공에 포집될 것이라 유추되며 추후 연구에서는 Direct Space Method를 기반으로 한 분석과 NMR, Raman 등의 분광기기를 활용한 직접 증거의 제시가 필요할 것이라 여겨진다(Sloan and Koh, 2008; Shin et al., 2017; Ahn et al., 2019a).
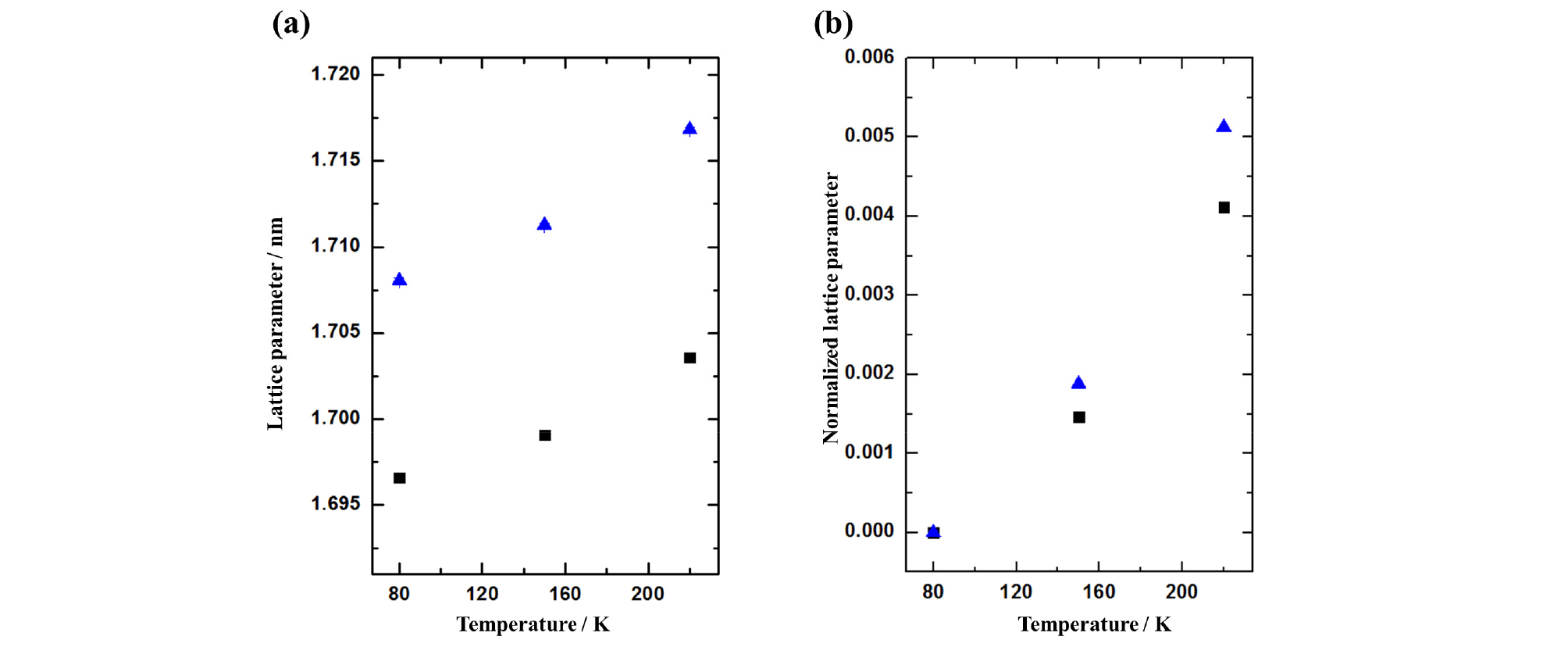
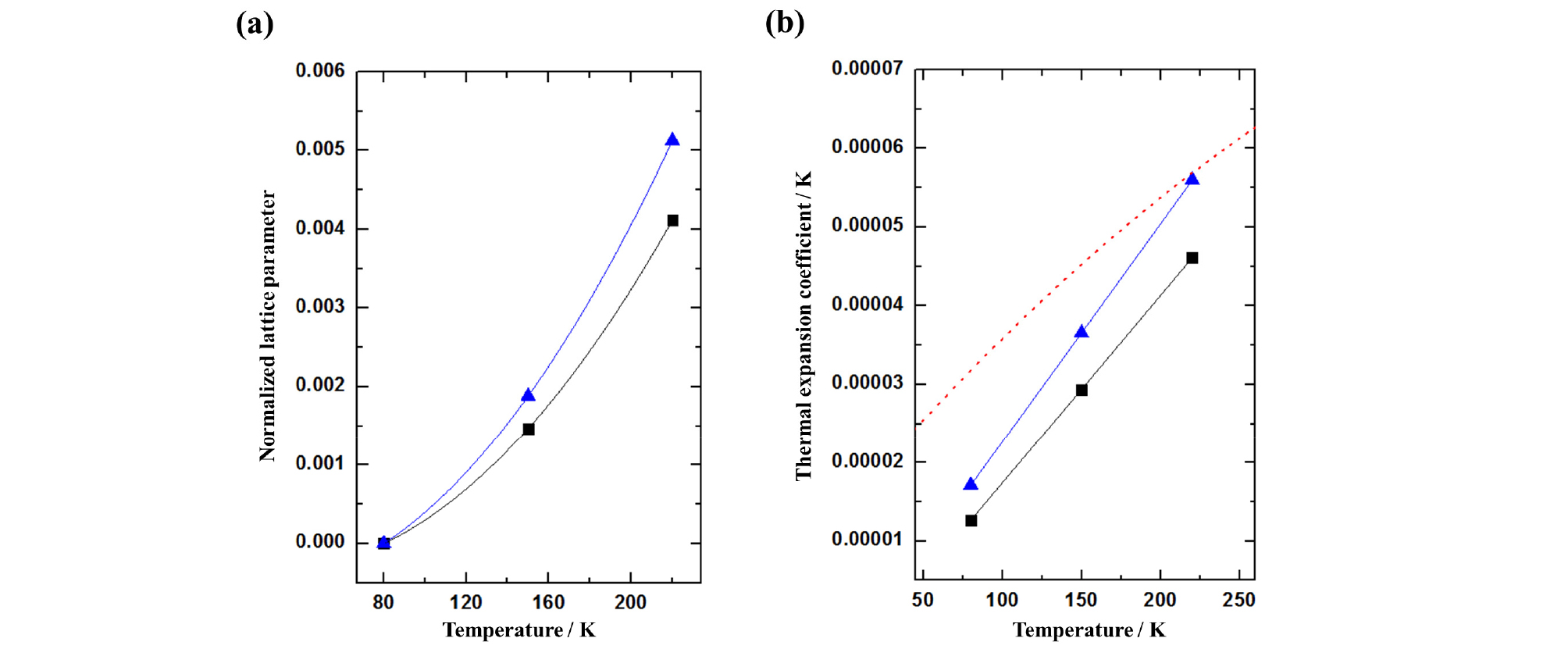
150 K, 220 K에서 측정된 두 하이드레이트 샘플의 분말 회전 패턴 또한 같은 방식으로 분석하였으며, 이로부터 분석된 격자상수의 값을 Fig. 4a에 나타내었다. 온도의 변화에 따라 두 하이드레이트 샘플 모두 서서히 하이드레이트 구조가 팽창되는 것을 확인할 수 있으며, 80 K에서의 결과와 비슷하게 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트 구조가 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트에 비하여 큰 격자상수를 나타내고 있음을 알 수 있다. 온도 상승에 의한 하이드레이트 구조의 팽창 정도를 비교하기 위하여, 80 K에서 측정된 두 하이드레이트의 격자상수를 기준으로 팽창된 격자상수의 값을 정규화(Normalize)하였으며 그 결과는 Fig. 4b와 같다. 정규화된 격자상수 비교 결과는 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트가 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트에 비하여 더 큰 열팽창 정도를 나타내는 것으로 확인되었다. 이는 Fig. 1에서 비교할 수 있듯이 2-메틸-2-프로펜-1-올의 분자 크기(0.759 nm)가 프로필렌 옥사이드의 분자 크기(0.675 nm)보다 큰 영향으로 발생한 것이라 분석된다(Sloan and Koh, 2008). 일반적으로 하이드레이트 구조의 격자상수는 더 큰 유기분자가 포집되었을 때 더 큰 격자상수를 나타내는 것으로 보고되고 있으며, Fig. 4의 결과를 통해 이와 동일한 경향을 따라가고 있음을 확인할 수 있다(Udachin et al., 2002). Fig. 4a에 따르면 80 K, 150 K, 220 K에서 두 하이드레이트의 격자상수 차이는 약 0.01 nm 정도로 확인되었으며, 이는 문헌에서 보고되고 있던 순수한 물로부터 형성된 프로필렌 옥사이드 하이드레이트와 2-메틸-2-프로펜-1-올과 메탄 가스가 포집된 하이드레이트 사이의 격자상수와도 유사하다.
불화암모늄이 포함된 두 하이드레이트의 열팽창 거동을 확인하기 위하여, 열팽창 계수를 계산하여 두 하이드레이트의 열팽창률을 비교하였다(Hester et al., 2007). 열팽창 계수의 계산은 문헌에서 보고되는 과정에 따라 진행하였으며, 격자상수(a)의 역수와 격자상수를 온도에 대하여 편미분한 곱으로 정의하고 있다(식 1).
| $$\alpha=\frac1a(\frac{\partial a}{\partial T})_{P,n}$$ | (1) |
열팽창 계수(α)는 온도에 대한 물질의 부피 의존성이 굉장히 클 때 큰 값을 보통 가지게 되며, 이에 따라 열팽창 계수를 온도의 함수로 정의하게 된다면 식 (2)로 표현할 수 있다.
| $$\alpha=a_1+a_2\;(T-T_0)+a_3\;(T-T_0)^2$$ | (2) |
T0는 이 연구에서 고분해능 분말 회절 실험을 진행한 기준 온도인 80 K를 설정하였으며, 식 (1)과 (2)를 활용하여 이를 풀면 다음의 식 (3)을 얻게 된다.
| $$\frac{a-a_0}{a_0}=\exp\;\lbrack a_1\;(T-T_0)\;+\;\frac{a_2}2\;(T-T_0)^2\;+\;\frac{a_3}3\;(T-T_0)^3\rbrack-1$$ | (3) |
a0값은 80 K에서 해당 하이드레이트 구조의 격자상수를 기준으로 하였다. Hester et al.(2007)에 따르면 순수한 물을 기반으로 형성된 구조 II 하이드레이트의 정규화된 격자상수의 식은 식 (3)을 기반으로 a1 = 6.77 × 10-5, a2 = 1.23 × 10-7, a3 = -1.88 × 10-10로 분석되었다. 식 (3)을 통하여 얻어낸 계수를 활용하여, 하이드레이트의 열팽창 계수로 적용하면 Fig. 5b의 점선으로 표현된 구조 II 하이드레이트의 일반화된 열팽창 계수 값을 얻게 된다.
비슷한 과정에 따라 불화암모늄이 첨가된 2-메틸-2-프로펜-1-올과 메탄올, 프로필렌 옥사이드와 메탄올 하이드레이트에 대한 열팽창 계수를 온도의 함수로 표현하면 다음의 식 (4), (5)로 표현할 수 있다.
| $$\alpha=\;(1.712\times10^{-5})\;+\;(2.775\times10^{-7})\;\times\;(T-T_0)\;+(7.384\times10^{-13})\;\times\;(T-T_0)^2$$ | (4) |
| $$\alpha=\;(1.264\times10^{-5})\;+\;(2.389\times10^{-7})\;\times\;(T-T_0)\;+(5.939\times10^{-13})\;\times\;(T-T_0)^2$$ | (5) |
이 두 하이드레이트에 대한 열팽창 계수를 마찬가지로 Fig. 5b에 나타내었다. 앞서 언급한 바와 같이 순수하게 물로 구성된 하이드레이트의 열팽창 계수(점선으로 표현된 Fig. 5b)에 비하여, 불화암모늄이 첨가된 두 크러스레이트 하이드레이트 구조의 경우 상대적으로 작은 열팽창 계수를 확인할 수 있다. 또한 상대적으로 큰 유기분자를 포함하고 있는 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트의 경우, 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트에 비하여 더 큰 열팽창 계수를 가짐을 확인할 수 있다.
결 론
이 연구에서는 불화 암모늄(NH4F)이 포함된 크러스레이트 하이드레이트의 열팽창 거동에 관한 연구를 수행하였다. 하이드레이트 주체(Host) 구조는 불화 암모늄과 물로 구성하였으며, 프로필렌 옥사이드(Propylene oxide), 2-메틸-2-프로펜-1-올(2-Methyl-2-propen-1-ol), 메탄올(Methanol)의 유기분자를 객체 분자로 하이드레이트 시스템을 구성하였다. 열팽창 거동을 확인하기 위하여 고분해능 분말 회절 분석을 통해 얻은 하이드레이트의 패턴을 분석하였으며, 형성된 하이드레이트 구조는 구조 II 하이드레이트(입방정계 Fd3m)로 분석하였다. 불화 암모늄을 물과 함께 하이드레이트 주체 구조에 포함시킨 하이드레이트의 구조는 기존의 순수 물로 구성된 하이드레이트의 격자상수(Lattice parameter)에 비하여 더 작은 값을 가지는 것으로 나타났으며, 2-메틸-2-프로펜-1-올과 프로필렌 옥사이드는 구조 II 하이드레이트의 51264 동공에, 메탄올은 512 동공에 포집 됨을 확인하였다. 객체 분자의 크기, 모양 효과로 인하여 2-메틸-2-프로펜-1-올과 메탄올이 포집된 하이드레이트의 격자상수는 프로필렌 옥사이드와 메탄올이 포집된 하이드레이트의 격자 상수보다 큰 것으로 확인되었으며, 열팽창률 또한 그 영향을 받아 더 큰 값을 가짐을 확인하였다.



 ).
).
 ).
).
