서 론
광산지역 대부분의 휴·폐광산들은 사후처리 없이 적절한 관리가 이루어지지 못한 채 방치되어 산성광산배수와 함께 중금속 유출을 일으켜 주변지역 지하수, 하천 및 토양의 오염을 발생시키므로 이에 대한 복구의 필요성이 요구된다. 이는 생명체에 축척되어 치명적인 피해를 유발할 수 있다. 현재 사용되고 있는 토양의 안정화제는 주로 석회석, 석회고토, 제강슬래그 등으로 토양을 개량하는 효과가 있지만 장기적으로 자연생태계 파괴, 산림 훼손 등의 문제를 야기할 수 있기 때문에 이를 대체할 친환경적 재료의 개발이 필요하다(Heo et al., 2010).
생광물화(Biomineralization)기술은 생체 또는 자연계에서 광범위하게 이루어지고 있는 CO2 고정 또는 전환 현상을 모방한 기술로 미생물의 신진대사 작용을 통해 이산화탄소를 탄산염(CaCO3)형태로 고정시키는 방법이다(Dupraz, S. et al., 2009).
탄산염화 반응은 식 (1)과 같이 수중에 용존된 이산화탄소가 Bicarbonate 이온으로 전환되며, 이렇게 전환된 Bicarbonate 이온은 식 (2)와 같이 Carbonate 이온으로 전환된다. 이러한 환경에서 Ca이온과 같은 2가 이온이 존재하면 식 (3)과 같이 Carbonate 이온과 반응하여 탄산칼슘으로 침전한다(Lee, S. W. et al., 2010).
이 기술에서의 미생물 작용과 역할에 대해서는 다음과 같은 대략적인 작용을 통해서 관련 맺을 수 있다. 첫째로, 미생물의 신진대사 시 생성되는 물질이 반응에 관여한다. 둘째, 세포막을 통한 이온교환 작용이 생광물화에 기여하고, 마지막으로 세포 밖에 있는 고분자 물질에 의한 작용이다. 즉, 미생물에 의해서 만들어지는 고분자 화합물은 칼슘이온을 끌어들이거나 결정화하는데 제어할 수 있는 인자가 된다(Min, D. H. et al., 2011).
생광물화 기술에는 다양한 미생물 종이 사용될 수 있으며, 미생물 종에 따라 침전되는 탄산염의 결정 형태가 다양한 것으로 알려져 있다(Lian, B. et al., 2006; Jansson, C. and Northen, T., 2010).
생광물화균 중 Myxococcus xanthus 의 경우 비병원성이고, 경작지와 같은 유기물이 풍부한 토양에서 많이 발견된다. 이 미생물은 황산염(barite, taylorite), 탄산염(calcite, Mg-calcite, vaterite), 인산염(struvite, newberyite)을 형성시킬 수 있다(Gonzalez-Munoz, M. T. et al., 2000; Mendez- Vilas, A, 2007).
M. xanthus 균은 탄산칼슘의 세포 외 침전을 유발하며, 신진대사 활동에 의해 CO2와 NH3를 생성하여 세포 주변의 pH를 증가시킨다고 알려져 있다(식 4) (Piñar. G. et al., 2010). 또한, 아미노산의 산화적 탈아미노 반응(oxidative deamination)에 의해 세포주변을 알칼리화 한다(Rodriguez, N. C. et al., 2003).
선행 연구에서 SAR(Simulated Acid Rain)을 이용하여 초기 pH를 4.0, 4.5, 5.0으로 조절한 액체배지에서 M. xanthus 를 적용한 실험의 결과 최종 pH가 최대 7.3까지 증가하여 중화능력이 확인되었다. M. xanthus의 대사과정에 의해 발생하는 NH4+의 농도도 함께 증가하여 pH 상승이 M. xanthus 균에 의한 것임을 확인하였다(You, 2016).
따라서 본 연구에서는 생체모방형 토양개량제인 생광물화균 M. xanthus를 활용하여 위와 같은 생광물화 반응 메커니즘에 의한 산성 토양의 안정화제로서 적용 가능성을 확인하고자 하였다.
실험방법
토양시료 채취
연구에 활용할 토양시료 및 현황조사를 위해 환경부에서 실시하는 연도별 토양측정망 및 토양오염실태조사 결과(Ministry of Environment, 2015~2017)와 한국광해관리공단의 기술개발 보고서(Mine Reclamation Corp., 2014), 광해방지사업 시의 토양정밀조사, 광산실태조사 자료를 활용하였다. 자료 분석을 통해 토양시료 채취지역을 선정하고 현장조사 및 토양시료 채취를 실시하였다.
본 연구에서는 실제 산성화된 지역의 토양을 대상으로 한 실험을 통해 현장 적용성을 평가하였다. 이에 따라 연구에 활용된 토양시료는 현장 pH 측정으로 pH 4~6범위의 토양을 선별 채취하였으며, 각 시료는 풍건 후 10 mesh(2 mm) 체거름을 통해 분석 및 실험에 사용하였다.
또한, 현장조사를 통해 채취된 시료 중 중금속오염 토양(2점), 산성토양(1점)에서 토착미생물을 분리하였다(토착미생물 A, B, C). 분리된 토착미생물을 활용하여 액체배지 내에서의 산성 중화 가능성을 평가하고 이와 병행하여 실제 산성토양에서 중화실험을 통해 활용 가능한 토착미생물을 발굴하기 위한 연구를 수행하였다.
생광물화균 M. xanthus 배양
본 연구에서는 선행 연구(Park, 2014; You, 2016)를 통해 액체 배지와 인공토양에서 중화능력을 확인한 생광물화균인 Myxococcus xanthus(ATCC® 25232™)를 Americain Type Culture Collection에서 분양 받아 SP broth에서 배양하였으며 배양액의 조성은 다음과 같다; SP Broth : 1.0 g raffinose, 1.0 g sucrose, 1.0 g galactose, 5.0 g soluble starch, 2.5 g casitone(BD 225930), 0.5 g MgSO4·7H2O, 0.25 g K2HPO4, 증류수 1,000 ml.
SP broth에서 배양된 M. xanthus는 CT medium(1% Casitone, 0.1% MgSO4·7H2O in 10 mM phosphate buffer (pH 6.5))을 제조하여 121°C에서 20분간 고압멸균(Autoclave)한 후 배양액 5 ml를 접종하여 30°C, 160 rpm 조건 하에 진탕 배양기(shaking incubator; Vision scientific, VS- 8480)에서 24시간 동안 배양하여 연구에 사용하였다.
토착미생물 추출
토착미생물의 분리는 1) 0.85%(w/v) NaCl solution과 soil을 5:1로 섞어 미생물을 solution 내로 용출, 2) 상등액 2 ml를 LB배지 100 ml에 넣어 농화배양 후 범용 영양 한천배지(LB, NB, TSB, R2A)에 도말하여 토양 내 토착미생물 종분석을 실시 (농화배양 배지조성 및 배양 조건 : LB Broth, 호기성 상태 30°C 120 rpm), 3) 분리된 토착미생물의 종 다양성 분석을 위하여 차세대 염기 서열 분석(Next generation sequencing, NGS)을 진행 4) 다양한 영양 한천배지(LB, NB, TSA, R2A)에서 집락을 형성하는 균주를 분리, 배양하였으며, 각 single colony는 HiGeneTM Genomic DNA Prep Kit(BIOFACT, Korea)로 추출하여 16S rRNA gene sequencing을 수행하였다.
산성토양 중화실험
산성토양의 중화실험은 M. xanthus 와 추출된 토착미생물의 실제 산성토양에서의 중화능력을 확인하고 각 미생물의 중화 효율성을 비교하기 위해 M. xanthus 와 함께 토착미생물 A, B, C를 활용한 비교실험을 수행하였다.
먼저 미생물 배양 및 영양원으로는 Nutrient broth(NB) medium를 사용하였고 그 조성은 다음과 같다; Nutrient broth : 5.0 g peptone, 3.0 Beef exract, 증류수 1,000 ml. 미리 배양한 미생물 배양액에서 5%(v/v)에 해당하는 배양액을 채취하여 원심분리(5000 rpm, 15분)하고, 상등액을 제거하고 남은 미생물 침전물을 취해 0.85% NaCl 용액으로 2번 세척한 후 멸균한 NB 배지에서 배양하였다. 미생물을 접종한 NB배지는 30°C, 160 rpm 조건의 진탕 배양기에서 48 시간동안 배양하였다.
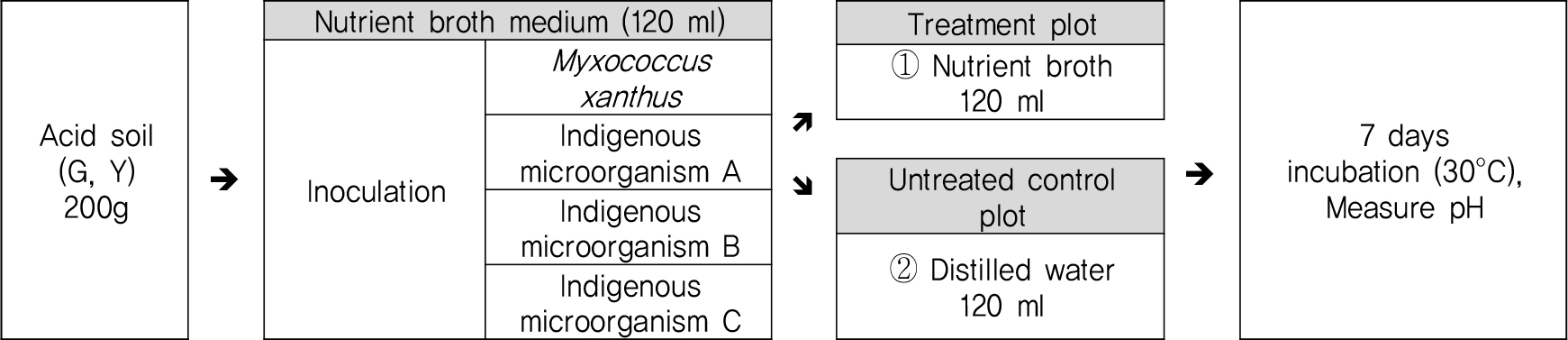
pH 4~6범위 내의 토양시료에 대해 Fig. 1과 같이 토양시료 200 g를 각각 500 ml 비커에 담은 뒤 미생물 투입은 M. xanthus를 배양한 NB 배지를 원심분리하여 상등액을 제거하고 남은 침전물을 0.85% NaCl 용액으로 2번 세척한 후 ① 미생물 침전물을 NB배지 120 ml와 함께 투입한 처리구 ② 미생물 침전물을 증류수 120 ml와 함께 투입한 무처리구로 구분하였다. 각 시료는 정치배양기를 활용하여 30°C, 호기성 조건에서 배양하여 24시간 마다 pH측정을 통해 변화를 확인하였다. 또한, 토착미생물 A, B, C를 동일한 조건으로 토양에 투입하여 영양배지 투입 유/무에 따른 중화능력을 확인하였다.
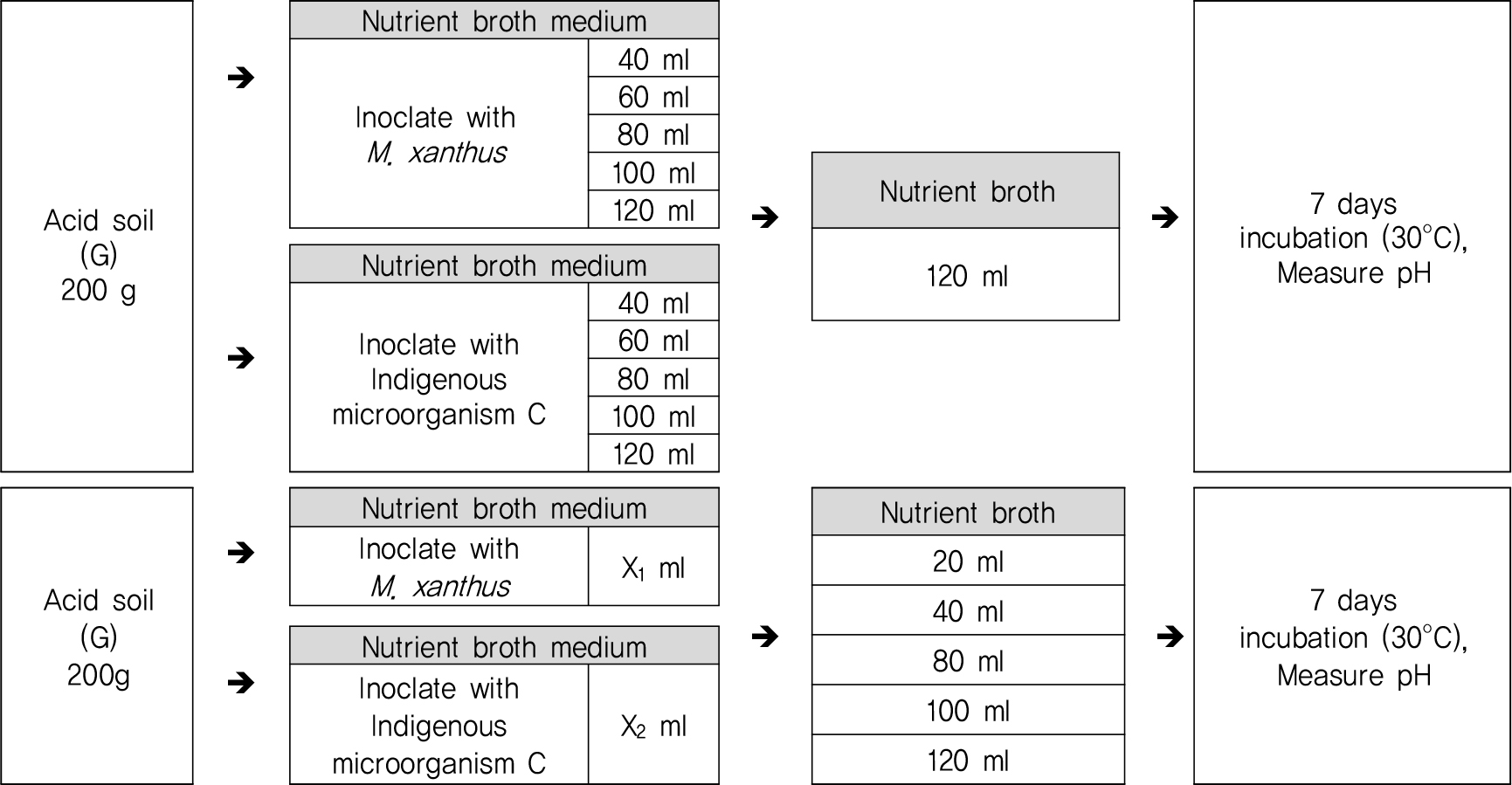
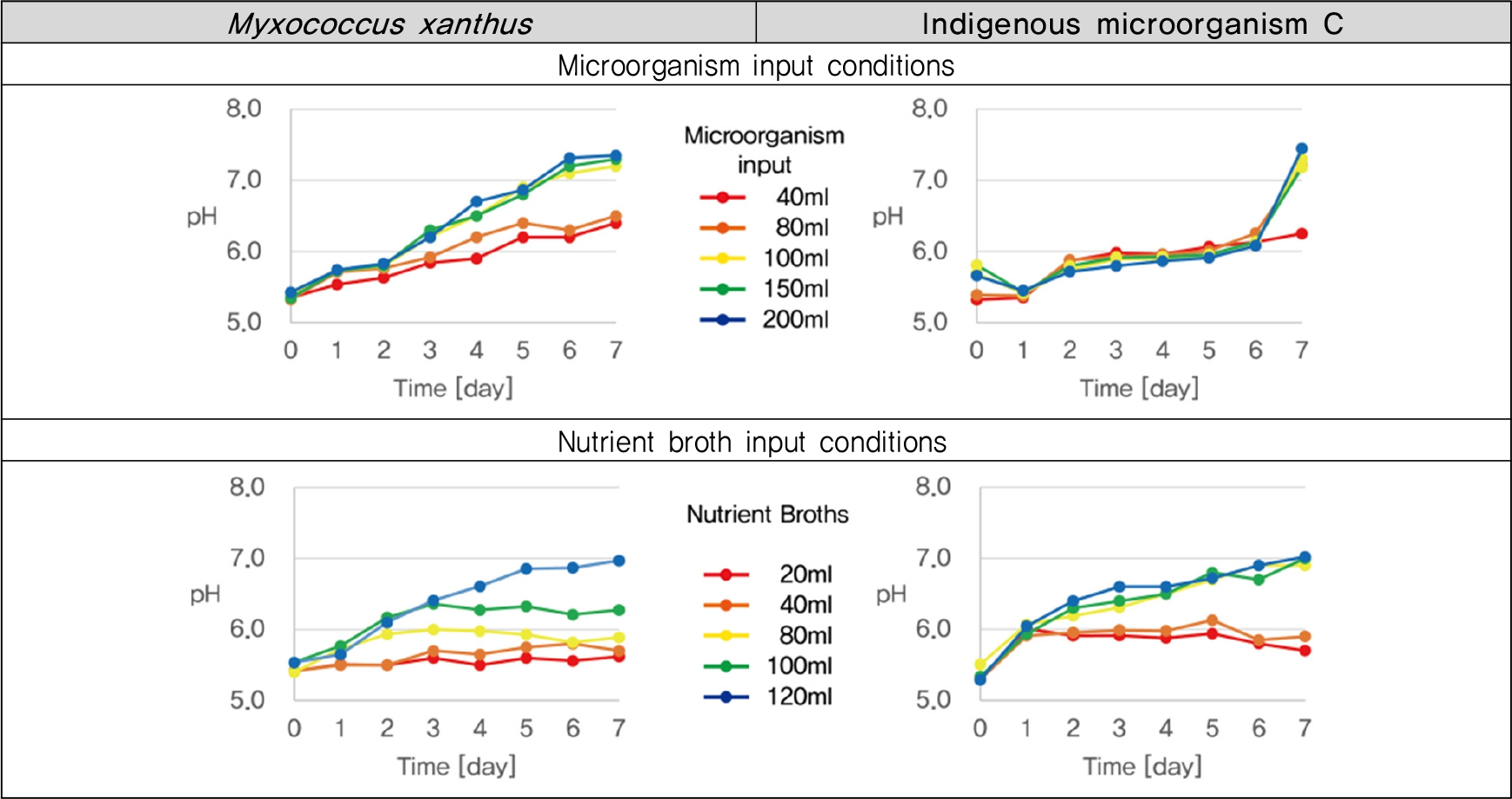
중화실험 결과를 종합하여 M. xanthus 와 토착미생물의 투입비 및 영양배지 배합비를 확인하고자 Fig. 2와 같이 미생물 투입양에 따른 중화능력을 확인한 후 산정된 미생물 투입양을 기준으로 영양배지 투입량을 산정하기 위한 실험을 수행하였다.
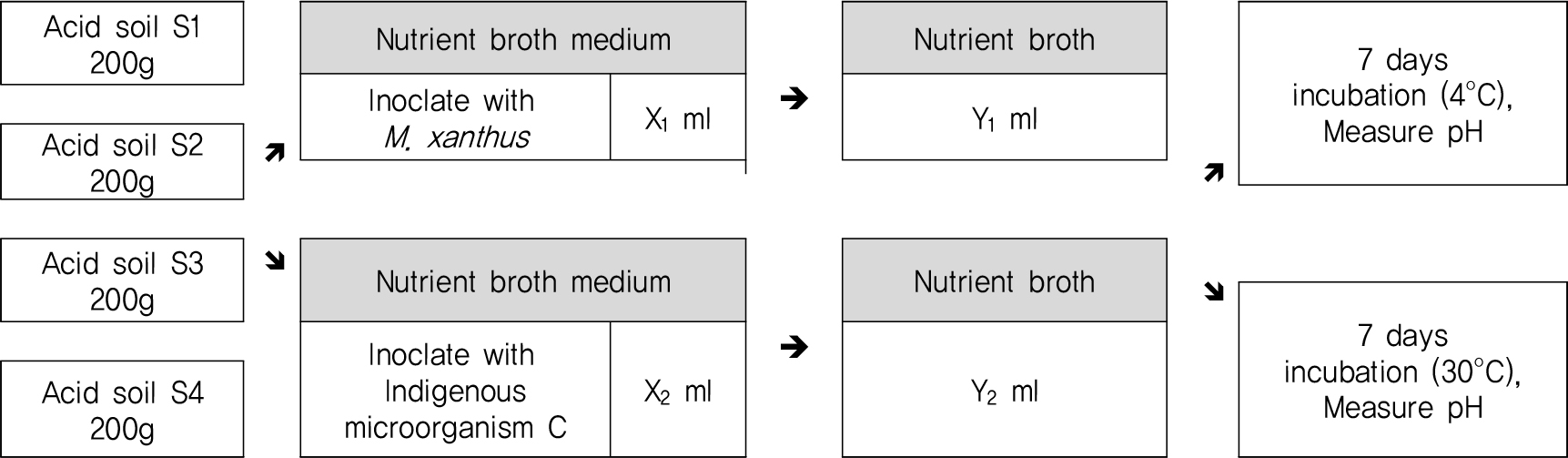
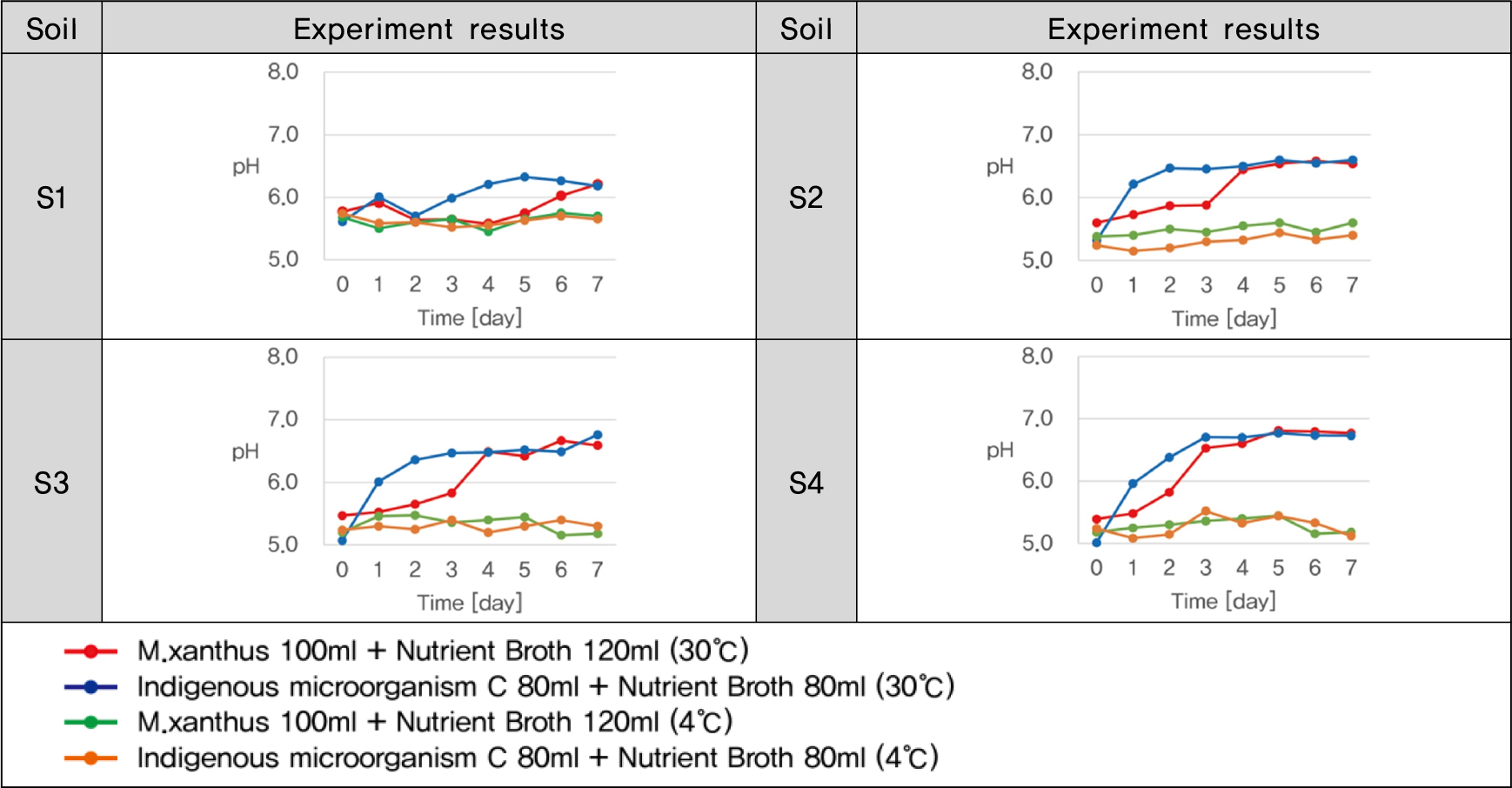
실험결과를 통해 산정된 투입비를 채취지점이 다른 4개의 토양(S1, S2, S3, S4)에 적용한 중화실험을 Fig. 3과 같이 실시하였으며, 또한 토양의 배양온도를 4°C로 조정한 미생물 처리구를 추가하여 배양온도 변화에 따른 중화능력의 차이를 확인하였다.
실험결과
토양시료
토착미생물 추출에 활용된 중금속오염토양(A, B), 산성토양(C)의 분석 결과는 Table 1과 같다. 각 토착미생물은 M. xanthus 와의 비교실험에 활용하였다.
pH 4~6범위 내의 현장 토양을 선별하여 활용하였으며 중화실험에 활용된 토양시료의 pH는 Table 2와 같다.
Table 1.
Analysis of soil samples from which indigenous microorganisms have been extracted
Table 2.
pH of soil samples
| Classification | pH | Classification | pH |
| G | 5.3 | S2 | 4.7 |
| Y | 4.7 | S3 | 4.6 |
| S1 | 4.8 | S4 | 4.1 |
토착미생물 추출 및 활용
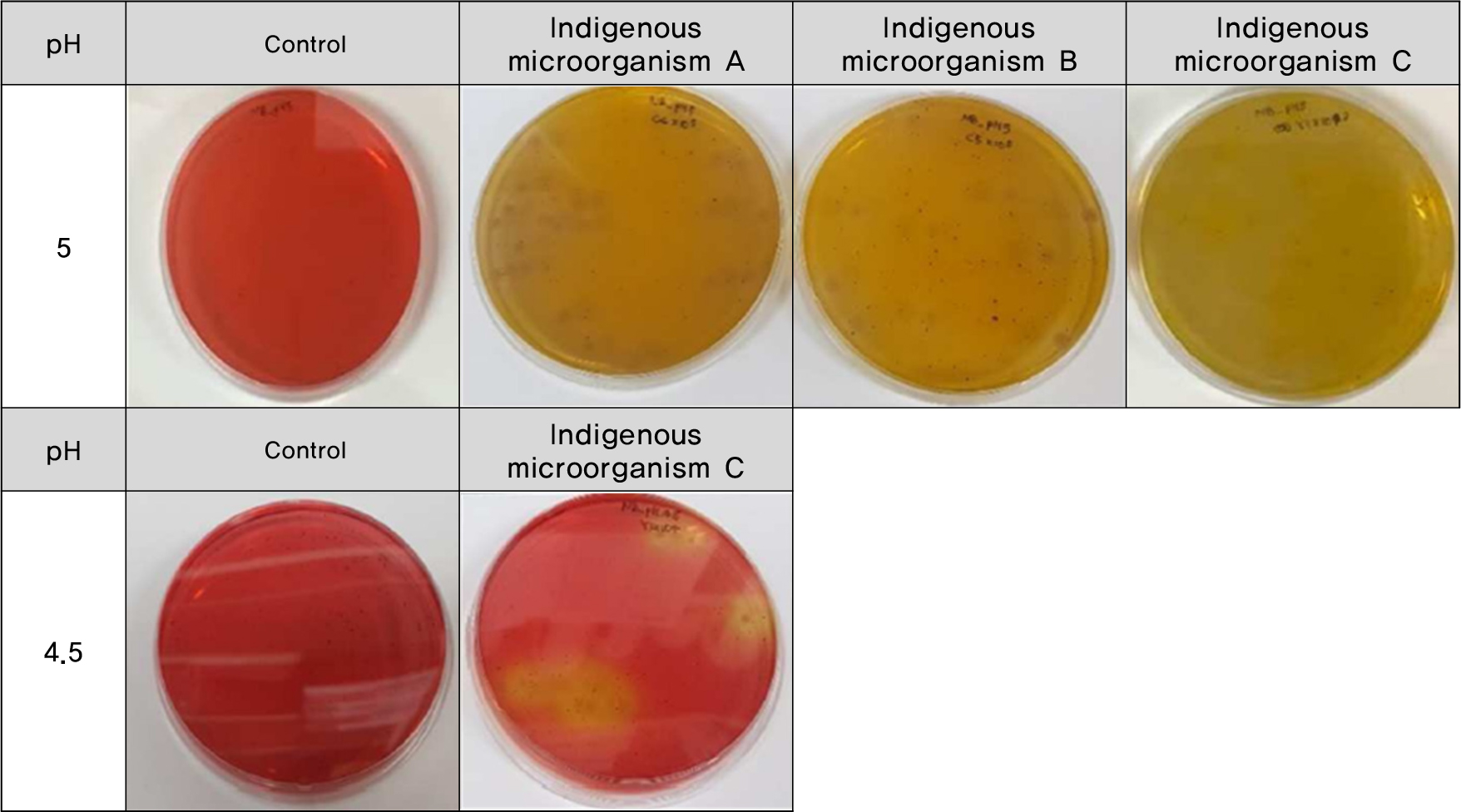
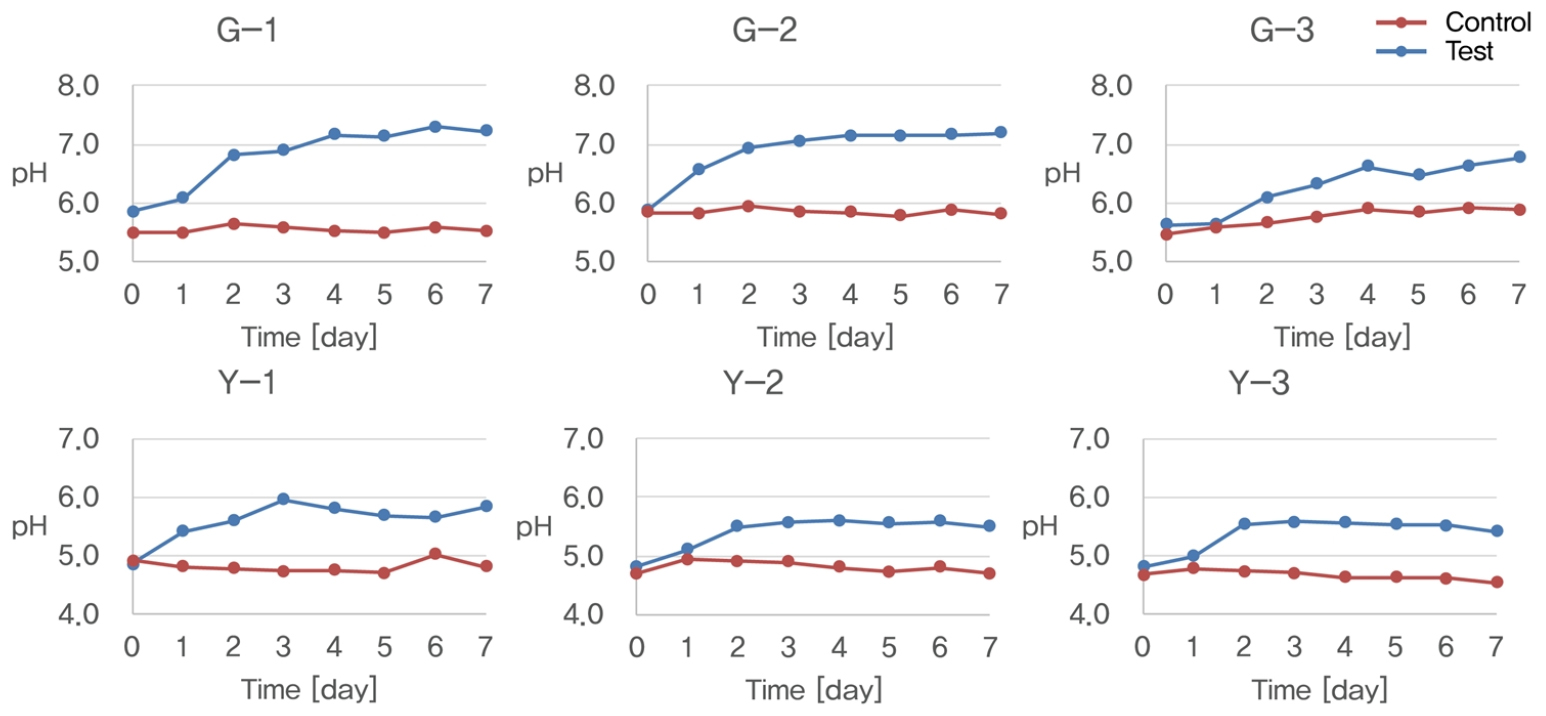
토착미생물 A, B, C를 대상으로 산성중화 가능성 균주를 확인하기 위한 실내시험을 수행하였다. 실내시험은 Methyl Red가 포함된 산성조건의 영양 한천배지에 혼합 토착미생물균주를 접종, 배양하여 미생물 집락 주변 배지의 색변화(적색 → 황색)를 관찰함으로써 산성중화 능력이 있는 미생물을 확인하였다. 그 결과 배지의 pH 값이 5일 때는 토착미생물 A, B, C 모두에서 중화능력이 있는 균주를 확인하였으나 pH 4.5 조건에서는 토착미생물 C만 중화반응을 보이는 것으로 확인되었다(Fig. 4).
산성토양 중화실험
M. xanthus 의 실제 산성토양(G, Y)에서의 중화실험 결과는 Fig. 5와 같다. 그 결과 M. xanthus 와 NB배지를 함께 투입한 처리구에서는 토양의 초기 pH 값 대비 0.6~1.5가 상승하여 최대 7.2까지 상승하였으나 NB배지를 넣지 않은 무처리구에서는 토양 pH가 상승하지 않고 초기 pH가 그대로 유지되는 것을 확인하였다.
산성토양 시료 G를 활용한 토착미생물 A, B, C 중화실험(Fig. 6)에서도 중화능력을 확인한 결과 토착미생물 A, B, C 모두에서 각각 0.9, 1.2, 1.9의 pH 상승이 확인되었다. 토착미생물 C의 경우 pH 상승이 가장 크게 나타났으며, 산성 중화 가능성 균주를 확인한 결과 pH 4.5의 조건에서도 중화 반응을 보이는 것으로 확인되어 토착미생물 C를 활용한 중화실험을 추가로 진행하였다.
M. xanthus와 토착미생물 C에 대한 투입비 확인 실험 결과(Fig. 7) M. xanthus는 투입량이 100 ml일 때 pH 상승이 가장 크게 확인되었으며 미생물이 추가로 투입되어도 더 이상의 중화는 진행되지 않았다. 또한 M. xanthus 투입량이 100 ml일 때 NB배지는 120 ml가 투입되어야 중화가 원활하게 진행되는 것으로 확인되었다. 토착미생물 C는 투입량이 80 ml 이상인 처리구와 미생물 투입량이 80 ml일 때 NB 80 ml 이상 투입된 처리구에서 유사한 pH 상승곡선이 확인되었다.
따라서 산성토양에서 M. xanthus와 토착미생물 C의 미생물 투입비와 영양배지 배합비 산정결과 ① M. xanthus : 배양액(100 ml) + NB배지(120 ml) ② 토착미생물 C : 배양액(80 ml) + NB배지(80 ml)의 조건에서 가장 효율적인 중화능력을 나타내는 것으로 확인하였다.
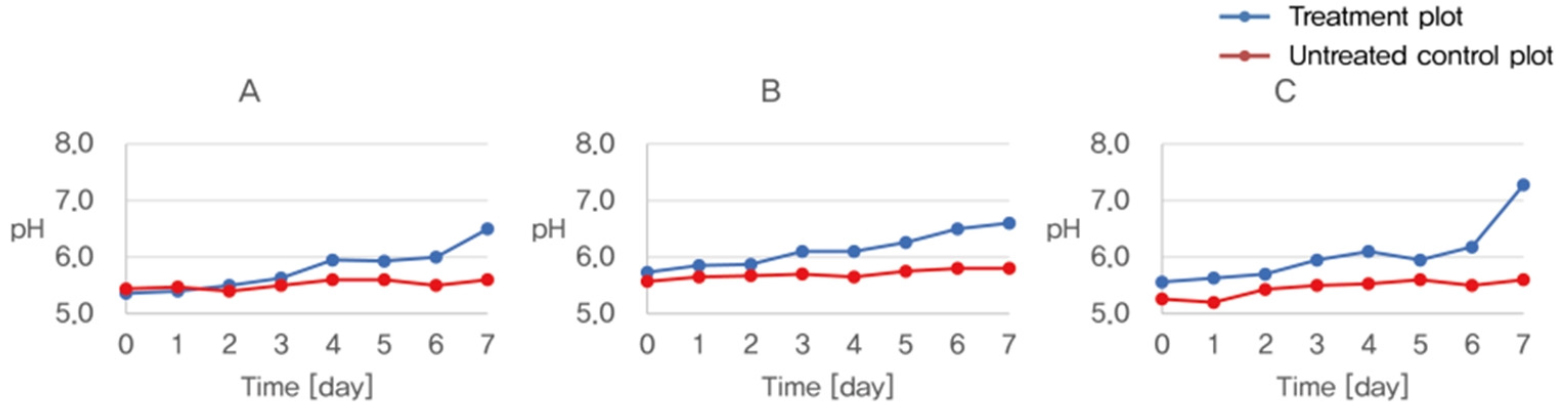
토양시료 S1, S2, S3, S4에 M. xanthus 와 토착미생물 C를 산정된 투입비로 하여 수행한 중화실험의 결과 토양 시료 S1, S2, S3, S4 모두 토착미생물 C의 중화가 M. xanthus 보다 더 빠르게 진행되어 그 값을 유지하는 것을 확인하였다(Fig. 8).
중화실험 결과와 투입비를 고려하였을 때 토착미생물 C를 토양에 적용하는 것이 경제적인 측면에서 더 효율적으로 보인다.
배양온도를 4°C 조정한 처리구의 pH를 측정한 결과 모든 실험구에서 초기 pH와 비슷한 값을 그대로 유지하는 것으로 확인되었다. 이는 저온으로 인해 미생물의 생장이 원활하게 이루어지지 못해 중화가 진행되지 못한 것으로 판단된다. 따라서 미생물을 활용한 중화를 현장에 적용하기 위해서는 계절적인 기후변화를 고려하여 처리시기를 고려해야 할 것으로 판단된다.
결 론
본 연구에서는 생체모방형 토양개량제인 생광물화균 M. xanthus를 실제 산성토양에 적용하여, 실험대상 토양의 pH 값을 초기대비 0.6~1.5가 증가시켜 최종 pH가 최대 7.2까지 상승하는 결과를 얻어, 생광물화균을 통한 산성토양의 중화능력을 확인하였다. 산성토양에서 추출한 토착미생물 C는 최대 1.9의 토양 pH 상승을 보였으며, pH 4.5 조건의 토양에서도 활성을 나타내는 것을 확인하여 실제 현장에 적용할 수 있는 가능성이 높은 것으로 판단되었다.
영양배지 유무에 따른 중화능력 평가실험에서는 영양배지 투입시에만 pH 상승이 일어나는 것으로 나타나, 미생물에 의한 중화가 진행되기 위해서는 필수적으로 미생물의 영양원 공급이 이루어져야 할 것으로 판단된다. 아울러, 4°C로 진행된 실험에서는 미생물에 의한 중화효과가 나타나지 않아, 현장에 미생물을 적용할 경우 계절적인 온도변화를 감안하여 적절한 처리 시기를 설정해야 할 것으로 보인다.
본 연구는 실험실 조건에서 단기간에 진행되었다. 생광물화균을 통한 산성토양중화를 현장에 적용하기 위해서는 1) 현장에서 발생되는 다양한 환경변수에 대한 영향, 2) 장기적인 토양의 재산성화 가능성, 3) 중화능을 갖춘 토착미생물에 대한 분리·동정, 4) Pilot test를 통한 중·장기적 관찰이 후속연구로 필요할 것으로 보인다.