서 론
산화바나듐(V2O5)은 철강 산업, 화학 산업, 항공기 산업 그리고 배터리 산업 등에서 바나듐 원료로 광범위하게 사용되고 있다(Moskalyk and Alfantatazi, 2003; Dassisti et al., 2016; Goso et al., 2016; Jiang et al., 2017; Zhang et al., 2018). 특히, 철강산업에서 오산화바나듐은 특수철강의 고장력, 경도, 피로저항 등의 물리적 특성을 향상시키기 위하여 합금 원료로 사용되는 페로바나듐(Fe-V) 합금철을 제조하기 위한 원료로 사용된다. 전 세계에서 생산되는 오산화바나듐 생산량의 85% 이상이 철강 산업에서 페로바나듐의 원료로 사용되고 있다. 뿐만 아니라 최근에 항공기 산업에서 알루미늄-바나듐(Al-V) 합금 개발과 배터리 산업에서 비발화성 및 대용량 에너지 저장장치인 바나듐 레독스흐름 배터리(Vanadium Redox Flow Battery) 개발이 활발히 진행되고 있다. 이와 같은 관점에서 향후에 고순도 오산화바나듐의 수요가 꾸준히 증가할 것으로 예측된다. 따라서 오산화바나듐의 고순도화 연구에 대한 관심이 점차로 커지고 있는 상황이다.
일반적으로 오산화바나듐의 품위가 99.2 wt% 이하인 공업용 오산화바나듐에는 바나듐 원료의 종류와 제조공정에 따라서 다르지만 불순물로 나트륨(Na), 칼륨(K), 칼슘(Ca), 알루미늄(Al), 규소(Si), 타이타늄(Ti), 철(Fe), 아연(Zn), 몰리브덴(Mo), 망간(Mn), 인(P), 황(S) 및 염소(Cl) 등을 함유하고 있다. 따라서 현재까지 알려진 공업용 오산화바나듐으로부터 이와 같은 불순물을 정제하기 위한 정제 방법에는 크게 습식법과 염소화 처리 후 습식 처리하는 방법 즉 염화법이 있다(Mjejri et al., 2017). 습식법에는 석출법, 용매추출법, 이온교환수지법 등이 있으며, 이와 같은 방법에서는 다단계의 공정이 필요하고, 다량의 화학물질을 사용하고, 다량의 폐수 발생과 공정 시간이 길다는 단점이 있다. 또한, 염화법은 오산화바나듐을 염소(Cl2), 사염화탄소(CCl4) 또는 염화알루미늄(AlCl3) 등을 이용하여 바나듐옥시클로라이드(VOCl3)로 전환하여 기화시켜 백필터에서 포집한 후 습식 처리하여 정제하는 방법으로 공정 중 발생하는 염화물에 의한 반응기의 침식과 대기오염에 대한 문제점이 있으며, 뿐만 아니라 다량의 폐수가 발생한다는 단점이 있다.
따라서 본 연구에서는 기존의 오산화바나듐의 정제 방법인 습식법과 염화법의 단점을 보완하기 위하여 공업용 오산화바나듐에 함유된 불순물 중 증기압이 높은 불순물을 가스상으로 휘발 제거하는 건식 정제 공정을 개발하기 위한 기초 연구를 수행하였다. 본 연구에서 개발하고자 하는 공정은 기존 공정과 비교해서 공정이 단순하고, 공정시간이 짧고, 화학물질의 사용이 없고, 또한 폐수 발생이 없는 경제적이면서 환경 친화적인 공정이라고 할 수 있다. 따라서 본 연구에서 개발된 공정은 향후에 공업용 오산화바나듐으로부터 고순도 오산화바나듐을 제조하는 정제공정 개발에 활용될 수 있을 것으로 기대된다.
본 론
이론적 배경
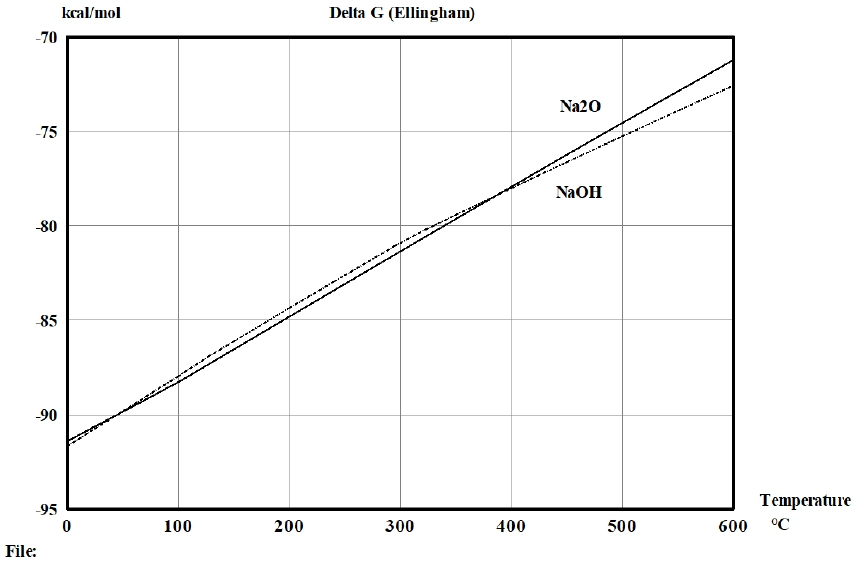
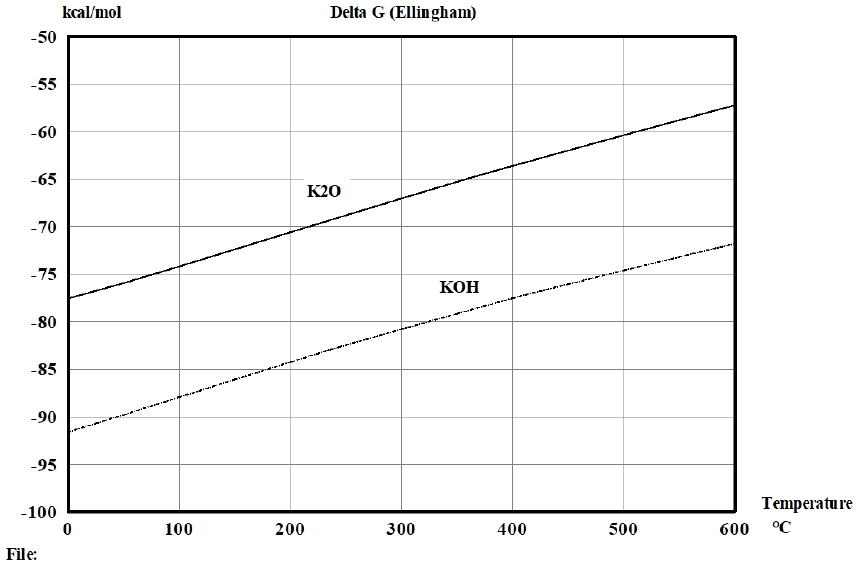
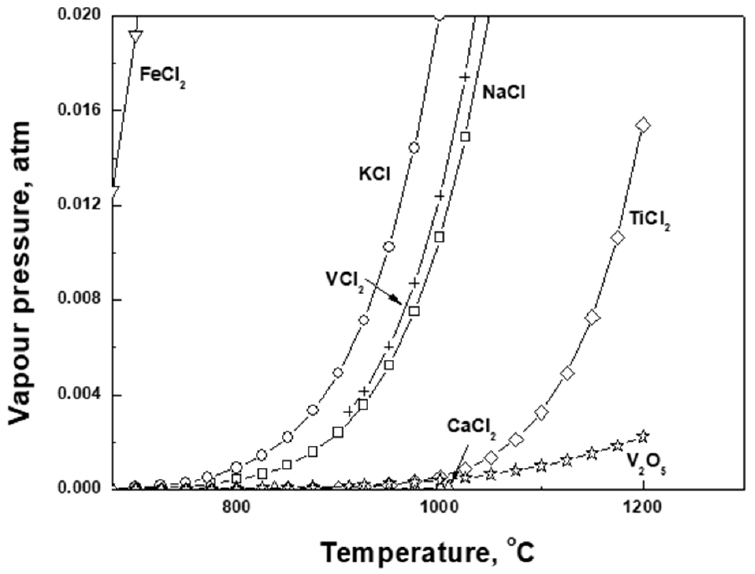
일반적으로 공업용 오산화바나듐은 나트륨(Na), 칼륨(K), 칼슘(Ca), 알루미늄(Al), 규소(Si), 티탄(Ti), 철(Fe), 아연(Zn), 몰리브덴(Mo), 망간(Mn), 인(P), 황(S) 및 염소(Cl) 등의 불순물을 함유하고 있다. 따라서 실험에 앞서 공업용 오산화바나듐으로부터 건식정제 기술의 하나인 휘발정제 기술을 활용하여 이러한 불순물을 제거할 수 있는지를 열역학적으로 조사하였다. 일반적으로 공업용 오산화바나듐는 암모니윰메타바나데이트(NH4VO3)를 대략 380~550°C 사이에서 열분해를 통하여 제조되고 있다(Ma et al., 2018). 또한, 현재 공업용 오산화바나듐에 함유된 Na와 K의 안정상은 불명확하지만 각각 Na2O와 K2O인 것으로 알려져 있다. 그러나 공업용 오산화바나듐에 함유된 Na와 K의 합계 함유량이 0.5 wt% 이하로 매우 미미하여 실험적으로 안정상을 확인하는 것은 매우 어려운 상황이다. 따라서 본 연구에서는 수소와 산소가 존재하는 조건에서 Na와 K의 안정상에 대한 온도에 따른 생성자유에너지를 Outokumpu Research Oy에서 개발한 화학프로그램인 HSC 5.1 version을 이용하여 계산하여 Na와 K의 안정상을 조사하였다. Fig. 1과 Fig. 2는 수소와 산소가 존재하는 조건에서 Na와 K 화합물의 안정상에 대한 생성자유에너지를 나타낸 것이다. Fig. 1과 2는 공업용 오산화바나듐을 제조하기 위한 암모니윰메타바나데이트(NH4VO3)의 열분해 온도인 380°C 이상에서 NaOH의 생성자유에너지는 Na2O의 생성자유에너지보다 작고, 전체적인 온도범위에서 KOH의 생성자유에너지는 K2O의 생성자유에너지보다 작다는 것을 보여준다. 따라서 공업용 오산화바나듐에 함유된 Na와 K의 안정상은 각각 Na2O와 K2O인 것 보다는 NaOH와 KOH인 것이 더 타당한 것으로 판단하였다. 이와 같은 열역학적 분석을 토대로 공업용 오산화바나듐에 함유된 NaOH, KOH, P4O10 등의 증기압을 V2O5의 증기압과 함께 Fig. 3에 나타냈다(Kubaschewski and Alcock, 1979). Fig. 3은 고려된 온도범위에서 공업용 오산화바나듐에 함유된 NaOH, KOH, P4O10 등의 증기압이 V2O5 증기압 보다 높기 때문에 감압 또는 상압상태에서 위와 같은 불순물을 기상으로 휘발제거가 가능하다는 것을 보여준다. 한편 염소와 여러 불순물을 함유한 공업용 오산화바나듐에 대하여 바나듐을 포함한 여러 불순물의 염화물에 대한 증기압을 계산하였다. Fig. 4는 공업용 오산화바나듐에 함유된 불순물의 염화물과 오산화 바나듐의 증기압 곡선을 보여준다(Kubaschewski and Alcock, 1979). Fig. 4는 FeCl2, KCl, NaCl, TiCl2 등 불순물의 증기압이 V2O5 증기압 보다 높기 때문에 감압 또는 상압상태에서 위와 같은 불순물을 기상으로 휘발제거가 가능할 것으로 분석되었다. 그러나 CaCl2 의 증기압은 비교적 매우 낮기 때문에 제거가 어려울 것으로 판단된다. 한편, 염화바나듐(VCl2)의 증기압은 비교적 높기 때문에 바나듐 일부가 기상으로 손실될 것으로 분석되었다.
실험 방법
본 연구에서는 중국산 공업용 오산화바나듐 분말을 사용하였다. Table 1은 본 연구에서 사용한 시료의 화학 분석데이터이다. Table 1에 제시된 바와 같이 공업용 오산화바나듐은 S, P, K, Na, Ca, Fe, Si 등의 불순물을 포함하고 있으며, 99.2 wt%의 V2O5 순도인 것으로 분석되었다.
Table 1.
Chemical analysis data of vanadium pentoxide powder used in this study (wt%)
| V2O5 | SO3 | SiO2 | NaOH | Al2O3 | P2O5 | KOH |
| 99.2 | 0.025 | 0.019 | 0.134 | 0.163 | 0.206 | 0.129 |
| CaO | Fe2O3 | TiO2 | MnO | ZnO | MoO3 | |
| 0.088 | 0.039 | 0.005 | 0.004 | 0.004 | 0.014 |
가열로는 실리콘 카바이드(SiC) 발열체의 전기저항로와 분위기 조절이 가능한 진공유도로를 사용하였다. 도가니는 알루미나도가니와 흑연도가니 두 종류를 사용하였다. 실험은 시료가 장입된 도가니를 로에 장입하고, 대기 분위기와 감압 분위기에서 목적 온도로 가열하여 일정시간 유지한 후, 로 안에서 냉각하였다. 실험온도는 600°C에서 1,100°C로, 진공도는 아르곤 분위기에서 7.9×10-2 기압에서 1.1×10-1 기압으로 조절되었으며, 유지시간은 15분에서 60분까지 변화시켰다. Fig. 5는 대기 분위기와 감압 상태에서 수행된 실험장치 사진이다.
반응 전, 후 시료의 S는 XRF(MXF-2400, Shimadzu, Japan)을 사용하여 분석하였고, 나머지 금속성분은 혼산(HF:HClO4:HCl=1:3:5) 분해로 완전히 분해하여 ICP(Jobin- Yvon Equipment Co., JY-38 plus)로 분석하였다.
실험 결과 및 고찰
Table 2는 알루미나 도가니를 사용하여 대기 분위기에서 1시간 동안 휘발정제 실험 후 얻어진 시료와 흑연 도가니를 사용하여 감압 분위기(7.9×10-2
Table 2.
Volatile refining analysis result according to volatilization temperature (wt%)
1.1×10-1 기압)에서 1시간 동안 휘발정제 실험 후 얻어진 시료의 ICP 분석결과를 나타낸 것이다. Table 2에서 보여 지는 바와 같이 대기 분위기에서는 700°C 이하에서 1시간 휘발정제를 할 경우 오산화바나듐의 품위가 99.5 wt% 이상인 것으로 확인되었다. 또한 감압 분위기에서는 전 온도구간에서 1시간 휘발정제를 할 경우 오산화바나듐의 품위가 99.6 wt% 이상인 것으로 확인되었다. 그러나 감압 분위기에서 실험 전, 후 시료의 무게감량이 온도에 따라서 대략 20% - 30%로 휘발온도가 증가할수록 오산화바나듐의 휘발량이 증가하는 것으로 확인되었다.
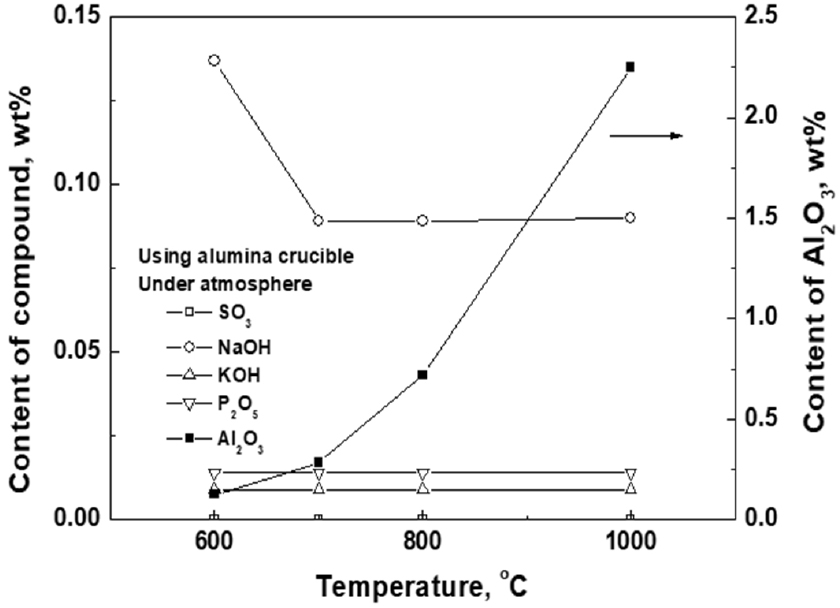
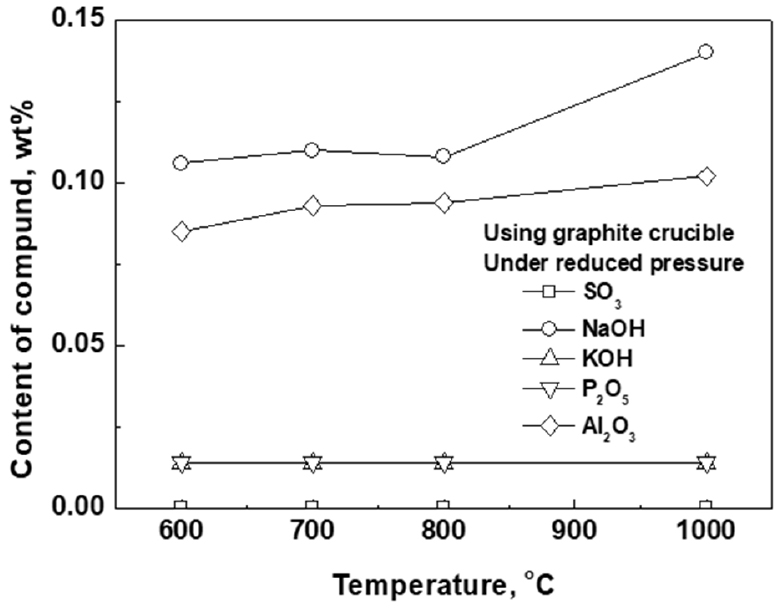
Fig. 6과 Fig. 7은 공업용 오산화바나듐의 휘발정제 온도에 따른 SO3, P2O5, NaOH, KOH와 Al2O3의 품위변화를 나타낸 것이다. 그림에서 나타난 바와 같이 휘발정제 온도에 상관없이 SO3, P2O5, NaOH, KOH 등의 품위는 초기 공업용 오산화바나듐 분말의 품위보다 비교적 낮아진 것으로 나타났다. 이것은 앞장에서 설명한 바와 같이 P2O5, NaOH, KOH 등의 증기압이 높고, SO3는 기체이므로 휘발정제 과정에서 형성된 후 바로 기상으로 제거되기 때문인 것으로 판단된다. 그러나 감압 분위기에서 온도가 증가할수록 NaOH와 Al2O3의 품위가 다소 증가한 것으로 나타나고 있으나 초기 공업용 오산화바나듐 분말에 함유된 NaOH와 Al2O3의 품위 보다는 작다. 또한 휘발온도 1,000°C에서 Al2O3의 품위가 초기 공업용 오산화바나듐 분말에 함유된 품위 보다 다소 높게 나온 것은 아마도 시료 분리과정에서의 오염에 기인한 것으로 판단된다. 한편, Al2O3의 품위는 감압 분위기에서 흑연 도가니를 사용한 경우에는 초기 공업용 오산화바나듐 분말의 품위보다 비교적 낮아지는 것으로 나타났으나, 대기 분위기에서 알루미나(Al2O3) 도가니를 사용한 경우에는 휘발온도가 증가할수록 Al2O3의 품위가 초기 공업용 오산화바나듐 분말의 품위보다 증가하는 것으로 나타났다. 이것은 휘발온도가 증가할수록 오산화바나듐에 의한 알루미나 도가니의 침식에 의한 것으로 판단된다. 한편 흑연도가니를 사용한 경우 Al2O3의 품위가 낮아지는 이유는 아마도 알루미늄이 양쪽성 금속으로서 바나듐과의 결합력이 작기 때문으로 추측된다. 따라서 향후 이 부분에 대해서는 추가적인 연구가 필요할 것으로 판단된다.
Table 3은 알루미나 도가니를 사용하여 대기 분위기와 감압 분위기(7.9×10-2 – 1.1×10-1 기압), 600°C에서 유지 시간에 따른 휘발정제 실험한 결과이다. Table 3에 나타난 바와 같이 로 안의 압력 조건에 상관없이 유지 시간 15분 이상에서 모두 오산화바나듐의 품위가 99.6 wt% 이상인 것으로 확인되었다. 이것은 앞에서 설명한 바와 같이 공업용 오산화바나듐 분말에 함유된 SO3, P2O5, NaOH 와 KOH 등의 불순물이 휘발하여 기상으로 효과적으로 제거되었기 때문이다. 한편 또한, 대기 분위기에서 보다 감압 분위기에서 불순물의 정제효과는 다소 증가하는 것으로 나타났다. 따라서 이상의 실험 결과 대기 분위기 또는 감압 분위기에서 오산화바나듐의 융용 온도 이하(670°C)인 600°C에서 15분 이상 휘발 정제함으로써 99.6 wt% 이상의 오산화바나듐 분말을 제조할 수 있을 것으로 판단된다. 향후 본 연구에서 개발한 오산화바나듐의 건식 정제공정은 비교적 간단한 공정일 뿐만 아니라 추가적인 화학약품과 폐수발생이 없기 때문에 기존 습식 정제공정과 융합하여 새로운 정제 공정을 개발하는데 응용될 수 있을 것으로 기대된다.
Table 3.
Volatile refining analysis result at the volatilization temperature of 600°C (wt%)
결 론
건식정제 기술의 하나인 휘발정제 기술로 공업용 오산화바나듐(V2O5) 분말로부터 V2O5 함유량이 99.6 wt% 이상인 고품위 오산화바나듐(V2O5) 분말의 제조가 가능함을 확인하였다. 특히 공업용 오산화바나듐에 함유된 SO3, P2O5, NaOH, KOH 같은 불순물이 휘발정제에서 효과적으로 제거됨을 확인하였다. 공업용 오산화바나듐의 휘발정제를 위한 최적 조건은 로내의 압력조건에 상관없이 휘발온도 600°C, 유지시간 15분 이였다. 본 연구에서 개발된 정제기술은 기존의 습식법과 염화법과 비교해서 공정이 매우 단순하고, 공정시간이 짧고, 화학물질의 사용이 전혀 없으며, 또한 폐수 발생이 전혀 없는 환경 친화적인 공정이라고 할 수 있다. 따라서 본 연구에서 개발된 공정은 향후 공업용 오산화바나듐의 정제공정 개발에 활용될 수 있을 것으로 기대된다.