서 론
생태 환경에 오염된 잠재적 유해 원소들(Potentially harmful elements, PHEs)은 잠재적으로 축적되고 분해되지 않는 특성으로 인해 인간의 건강에 심각한 영향을 미치고 있어 상당한 관심을 끌었다(Audry et al., 2004; Jarup 2003). 안티몬(Sb), 카드뮴(Cd), 크롬(Cr), 니켈(Ni)과 같은 원소로 분류된다(Chandra Sekhar et al.,2004). 매우 독성이 강한 잠재적 유해원소인 크롬은 전기 도금, 채굴 및 다른 산업 공정에서 발생한다(Qi et al., 2016; Zhang et al., 2018a). 크롬은 주로 Cr(VI)와 Cr(III)의 형태로 존재하는 금속으로 대부분의 나라에서 오염물질로 지정되어 있는 물질이다(Zhou et al., 2016). 따라서 6가 크롬 오염을 제거하기 위한 효과적인 기술 개발이 중요하다. 6가 크롬 오염을 제어하기 위한 방법에는 화학 침전, 막분리, 흡착 등 여러가지가 있다(Zhang et al., 2018b). 이 가운데 흡착은 기술 적용에 따른 비용이 저렴하고, 처리 효율이 높은 것으로 알려져 있다.
그러나 기존 흡착제 합성에는 일방적인 에너지를 투입시키거나 복잡/다중 절차 및 인공 화학물질 사용을 요구하는 경우가 많다(Yoon et al., 2020). 최근 연구에서는 바이오매스 폐기물을 열분해하여 바이오차 복합체를 제조하고 있으며, 흡착제 합성 과정에서 귀중한 에너지 자원(열분해오일, 합성가스)을 획득하여 경제적·환경적 편익도 증대시켰다(Arora et al., 2021; Cho et al., 2021). 제조된 바이오차 합성물은 다공성 구조, 낮은 독성, 양이온 금속에 대한 높은 흡착 친화성을 가지고 있다(Chen et al.,2011). 또한 바이오 가스로부터 열분해 오일/합성 가스를 회수하는 측면에서 이산화탄소(CO2)의 사용이 다른 비활성 기체(Ar, N2)에 비해 열분해 대기 가스로 더 적합하다는 것을 발견했다(Lee et al., 2021; Liu et al.,2021). 일반적으로 바이오차(Biochar)는 700°C 미만의 온도에서 산소가 없는 상태에서 바이오매스의 열분해로 형성된 고탄소 고형 물질을 말한다(Park et al.,2011). 열분해 온도 및 반응 시간에 따라 바이오차의 다공성 구조, 표면적 및 알칼리성 특성 등을 변화시킬 수 있다. 그러나 열화학적 영향인자만으로 바이오차의 물리화학적 특성 및 환경적 기능을 개선하는 것에는 제한적이다.
최근에는 많은 연구자들이 바이오차 표면에 전이 금속 산화물을 이용하여 금속-탄소 복합체의 금속 바이오차를 제조하여 새로운 유용한 기능을 부여하는 연구들이 수행되고 있다(Amjed et al., 2021). Fe(III), Mn(IV), Zr(IV) 그리고 Ti(IV)과 같은 전이 금속 산화물은 음이온에 대한 높은 반응성과 친화력을 갖고 있어 바이오차와 결합되는 경우, 음이온성 오염물질들에 흡착 능력을 부여하는 것으로 보고되고 있다(Rahman et al.,2021; Wan et al., 2020; Wan et al., 2019). 기존의 금속 바이오차 합성은 주로 화학적 또는 전기적 침전이나 코팅 방법에 의해 수행되어 제조 비용이 증가하게 된다(Molday and Molday, 1984). 선행 연구에 따르면 바이오매스 고형물과 금속 고형물을 혼합하여 열분해 공정을 통해 금속 바이오차를 제조하는데 성공하였고, 이를 환경 소재로 활용한 바 있다(Yoon et al., 2019). 또한 CO2환경에서 제조 시 폐자원으로부터 발생하는 합성 가스 발생량도 증가하는 것으로 나타났다. 폐자원을 활용한 전이 금속 산화물과의 공동 열분해(co-pyrolysis)를 통해 에너지원과 금속 바이오차를 동시 생산 가능성을 확인한 것이다.
일반적으로 바이오차 제조공정에서는 열분해 환경으로 비활성기체 N2와 Ar 가스를 이용하는데 CO2를 이용하여 합성 가스 발생량과 금속 바이오차의 흡착 효율에 영향을 미치는지 알아보기 위해 실험을 수행하였다. 에너지 측면은 금속 바이오차 제조 과정에서 Micro-GC를 통해 합성 가스 발생량을 측정하고, 환경적 측면은 제조된 금속 바이오차의 6가 크롬[Cr(VI)] 흡착 효율을 비교하여 평가하였다.
본 연구에서는 나노 크기의 철 산화물(Iron(III) oxide, <50 nm; NIO)을 첨가제로 활용하여 커피찌꺼기(Coffee grounds, CG) 열화학적 변환에 미치는 영향을 에너지 및 환경적 측면에서 알아보고자 하였다.
연구방법
금속바이오차(NICG)
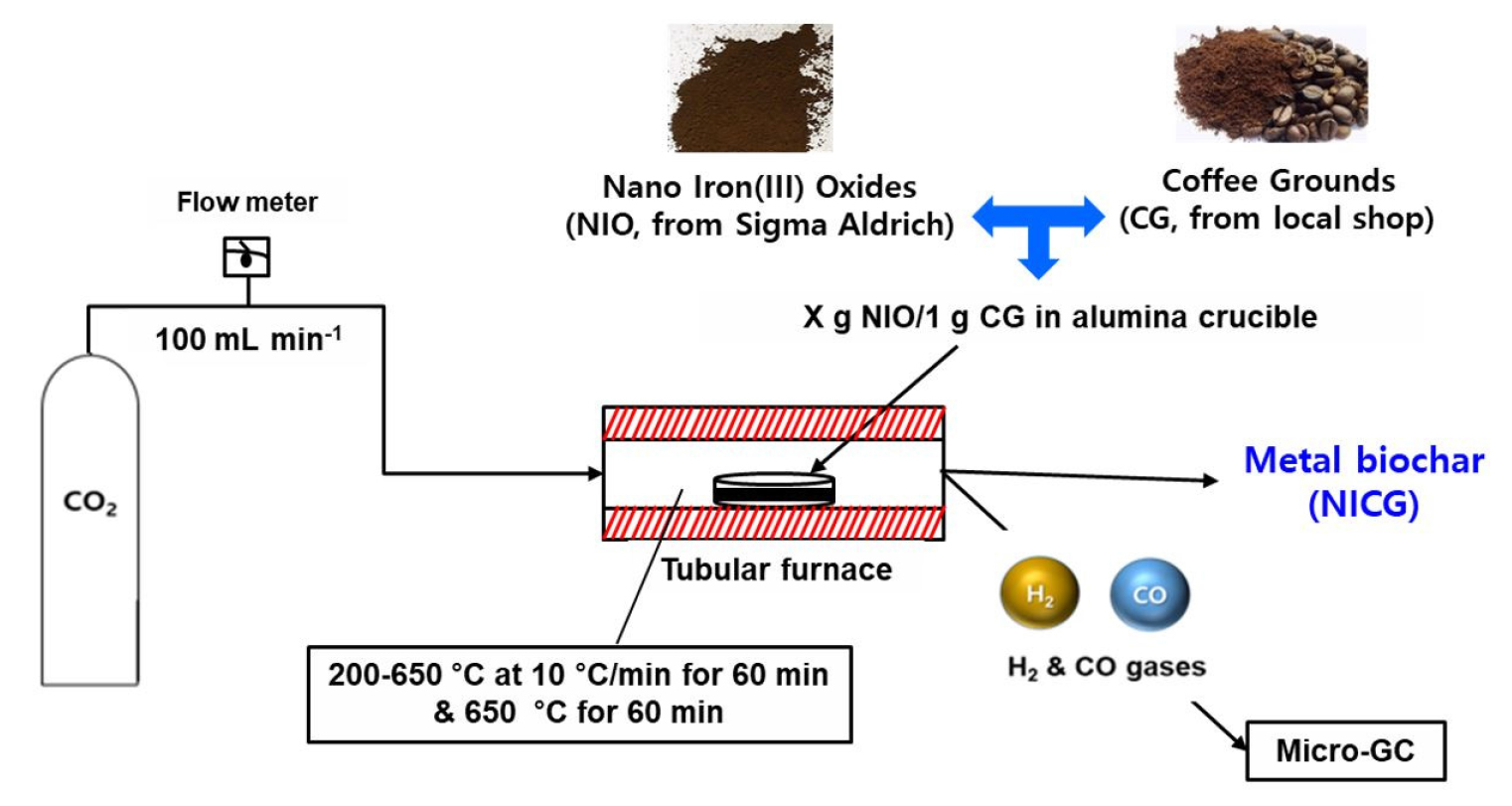
본 연구에서 사용된 NIO(Fe2O3, particle size <50 nm)는 미국 시그마알드리치(Sigma Aldrich)에서 구매했으며, 커피찌꺼기(CG) 분말은 대전의 한 커피숍에서 수거했다. 실험과정은 Fig. 1에 나타냈고 금속바이오차 제조를 위해 99.99% 고순도 이산화탄소 가스(주식회사 중앙산업가스, 한국)를 유량계를 통해 분당 100 mL씩 주입하였으며, 200도부터 650도까지 분당 10도씩 상승 속도로 온도를 높였다. CG와 NIO는 두 가지를 물리적으로 혼합하였고 CG는 1g으로 고정하고 NIO를 첨가하여 질량비에 따라 NICG3(NIO/CG ratio=1:3), NICG2(NIO/CG ratio=1:2), NICG1(NIO/CG ratio=1:1). 2NICG1(NIO/CG ratio=2:1), 3NICG1(NIO/CG ratio=3:1)로 명명하였으며, NIO를 첨가제로 사용하여 최대 3g까지 사용하여 실험을 수행하였다. 합성가스는 650°C 도달한 지점까지 마이크로 가스 크로마토그래피(Agilent 490 Micro GC, Agilent Technologies, Inc., USA)를 이용하여수소(H2)와 일산화탄소(CO)를 분석하였다. 제조한 금속바이오차의 형태를 알아보기 위해 FE-SEM(Merlin Compact, Zeiss, Germany) 분석을 수행하였고, 열화학적 변환을 거친 금속 성분들의 광물학적 특성을 보기 위해 X-선회절분석기[X-ray diffraction(XRD), X-Pert PRO MPD, Japan]를 이용하여 분석하였다.
흡착 실험
회분식 흡착 실험을 위해 K2Cr2O7(Merck, Germany)을 증류수(De-ionized Water) 1 L에 녹여서 1,000 mg L-1 (1,000 ppm)의 6가 크롬용액을 제조하여 사용하였다. CG, NIO, NICG1를 이용하여 용존 6가 크롬 제거 실험을 진행하였으며, 다음의 실험으로 구분하여 진행하였다. 첫 번째는 초기 pH 영향 실험, 두 번째는 흡착 속도 실험, 세 번째는 용액 내 6가 크롬 농도에 따른 흡착 평형 실험이다. pH에 의한 흡착 영향을 보기 위해서는 20 mL 튜브에 2 g L-1로 pH 2~9로 조정(NaOH 및 HCl 이용)된 용액과 CG, NIO, NICG1를 넣고 24시간 동안 end-over-end shaker을 이용하여 30 rpm의 속도로 상온에서 교반하였다. 이 때, 용존 6가 크롬의 농도는 10 mg L-1로 하였고, 이 6가 크롬 용액에 KCl(Merck, Germany)을 추가로 넣어 KCl 농도는 0.01 M이 되도록 하여 사용하였다. 반응 시간에 따른 흡착 속도 영향을 보기 위한 흡착실험은 용존 6가 크롬의 농도를 10 mg L-1, pH 5로 조정하여 20 mL 튜브에 2 g L-1으로 CG, NIO, NICG1와 함께 넣고 교반기를 이용하여 30 rpm의 속도로 상온에서 교반하며, 5, 10, 20, 30, 45, 60, 90, 120, 240, 360 min로 시료를 회수하였다. 초기 6가 크롬의 농도에 따른 흡착 평형 영향을 보기 위해서는 20 mL 튜브에 농도별(5, 10, 20, 30, 45, 60 mg L-1)로 pH 5로 조정한 용액과 2g L-1으로 CG, NIO, NICG1와 함께 넣고 교반기를 이용하여 30 rpm의 속도로 상온교반하였다. Table 1에 각각의 실험조건에 대해 정리하였다.
Table 1.
Description of adsorption experiments parameters
분석 방법
채수한 시료는 pH미터(HQ40d, HACH, USA)를 이용하여 측정하고, 0.45 µm의 주사기 필터를 이용하여 여과 후 6가 크롬의 농도를 8023 hach 발색법(ChromaVerⓇ 3 Chromium Reagent, Cat.1271099)을 활용하여 UV-visible sepectrometer (DR5000, Hach, USA)로 측정하였다.
반응 시간별 흡착제(NICG1)에 흡착된 6가 크롬의 양(qt)은 다음의 식 (1)를 이용하여 계산하였다.
여기서, qt는 t시간 때에서 흡착된 6가 크롬의 양(mg g-1), C0와 Ct는 시료의 용존 6가 크롬의 초기 농도 및 t시간에서의 농도(mg L-1), V와 W는 용액 부피(L)와 흡착제의 건조 질량(g)이다.
본 연구에서는 qe는 흡착제의 평형흡착량으로 24시간 이후의 조건으로 적용하여 식 (2)에 의해 계산하였으며, 용존 6가 크롬 제거율은 식 (3)에 의해 계산하였다.
여기서, RR은 용존 6가 크롬 제거율(%), C0는 시료의 용존 6가 크롬의 초기농도이고 Ce는 24시간에서의 농도(mg L-1)이다.
Lagergren에 의해 제안된 유사 1차 반응속도식(pseudo- first-order)과 유사 2차 반응 속도식(pseudo-second-order)은 식 (4)와 (5)를 사용하였다.
여기서, kad와 k2는 각각의 흡착속도 상수이다.
흡착데이터를 Langmuir(식 (6)) 및 Freundlich(식 (7)) 흡착등온식에 적용시켜 파라미터를 도출하였다.
여기서, 평형상태에서 용액속의 용존 6가 크롬 농도(mg L-1)는 Ce, 평형상태에서 흡착제에 흡착된 6가 크롬의 양(mg g-1)은 qe이다. qm은 흡착제의 단위질량당 6가 크롬의 최대 흡착용량(mg g-1)이고 b는 흡착의 친화도(L mg-1)를 나타내는 Langmuir 모델 상수이며 KF는 흡착용량이고 n은 흡착강도를 나타내는 Freundlich 모델 상수이다.
결과 및 고찰
금속 바이오차 제조 과정 중 합성 가스 발생량 비교 및 물리화학적 특성 분석
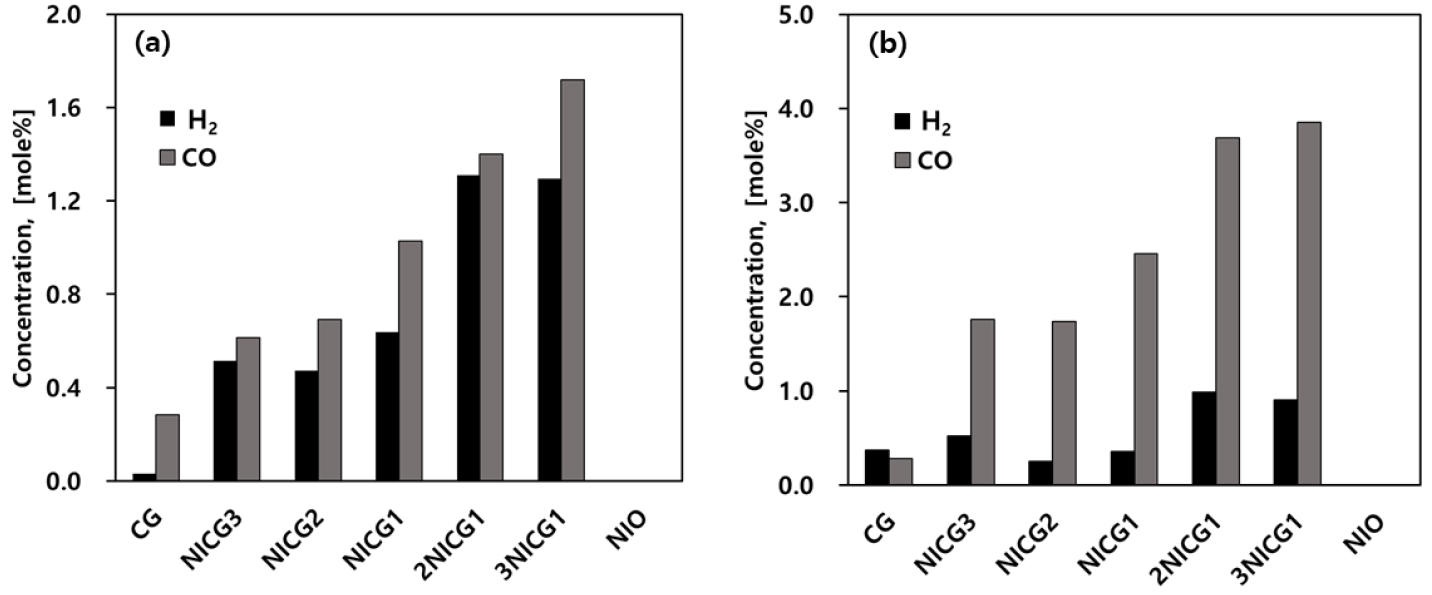
금속 바이오차 제조 과정 중 합성 가스 발생량을 200- 650°C 승온 중 실시간으로 분석하여 모니터링하였으며, 수소가스 최고 도달 시점인 550°C와 일산화탄소 최고 도달 시점인 650°C 측정한 합성 가스의 발생량 비교 실험 결과는 Fig. 2와 같이 나타내었다. 첨가제가 없는 경우 커피찌꺼기로부터 발생한 합성 가스 수소와 일산화탄소 농도는 550°C에 각각 약 0.03 mole%와 0.28 mole%, 650°C에 0.37 mole%와 0.28 mole%를 보였다. 첨가제인 NIO가 존재했을 때, 합성 가스의 발생량은 모든 실험 조건에서 상당히 향상되었다. 수소의 생성의 생성 속도와 발생 농도 수준은 모두 NIO가 최대 3g까지 증가함에 따라 증가하였고, 3NICG1은 CG보다 이른 550°C에 1.30 mole%로 가장 큰 값에 도달하였고, CG보다 약 43배 증가하였다. 또한 일산화탄소의 발생량은 NIO가 최대 3g까지 증가함에 따라 0.28 mole%에서 3.86 mole%로 증가했다. NIO만 첨가하였을 때에는 합성 가스가 전혀 발생하지 않지만, 커피찌꺼기와 NIO를 함께 사용하였을 때 합성 가스가 더 높은 것을 알 수 있는데 합성 가스 발생량이 증가한 것은 NIO가 CG 분해를 촉진시키는 촉매 역할을 한 증거이다.
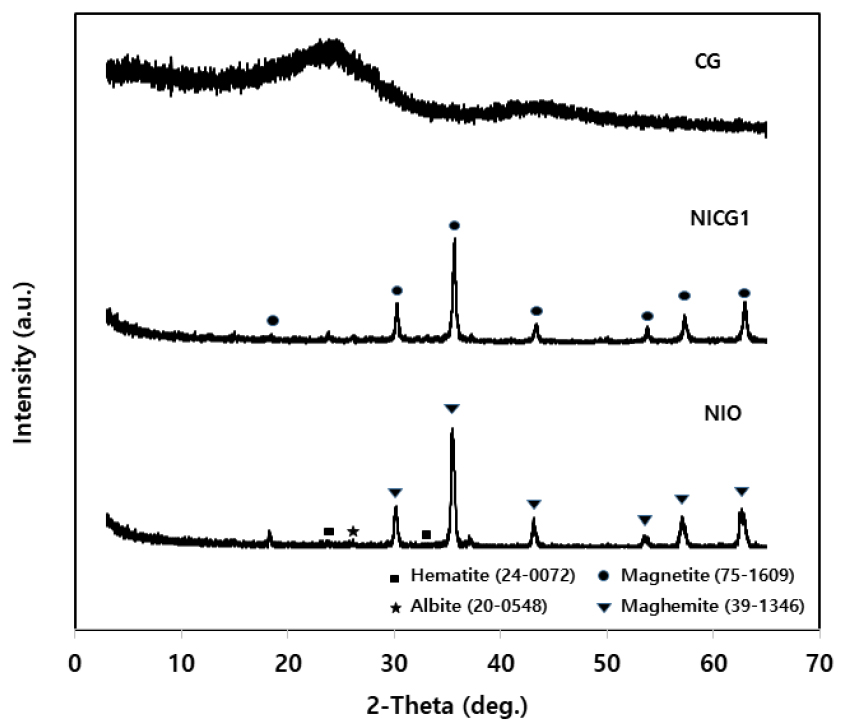
NIO에 의한 합성 가스 생성의 증진을 보다 정확하게 파악하기 위하여 NIO 및 co-pyrolysis 처리된 CG/NIO 시료의 XRD 결과를 Fig. 3에 제시하였으며, co-pyrolysis 결과, NIO의 산화상태가 Fe3+ [적철석(JCPDS No. 24-0072)와 자적철석(JCPDS No. 39-1346)]에서 Fe2+/Fe3+ 산화 상태의 자철석(JCPDS No. 75-1609]의 1개의 철상으로의 상변환이 일어났고 이는 환원 물질과의 상호작용에 의해 발생한 것으로 추정된다.
GC-MS 및 XRD 결과에 따르면 합성 가스의 발생에 NIO를 첨가하는 것이 발생량에 미치는 긍정적인 영향은 NIO(예: 타르 또는 CnHm + 3Fe2O3 → H2 + CO + 2Fe3O4 + Cn-1Hm-2)에 의해 촉매 작용되어 밀집된 커피찌꺼기 탄화수소(타르 포함)의 분해를 가속시키는 데에 기인할 수 있다(Xu et al.,2021). 이전 Kwon의 연구결과에서 질소 환경 하에서 바이오매스/산화철의 co-pyrolysis 후 금속 Fe(Fe2O3 → Fe3O4 → FeO → Fe)가 형성되는 것을 보여준 것과는 달리 이산화탄소 환경 하에서는 Fe2O3가 금속 Fe까지 단계적 환원이 없었다는 점에 주목해야한다(Kwon et al., 2021). 이러한 측면에서 Fe3O4의 환원은 이산화탄소의 지속적인 주입에 의해 억제되었을 수 있음을 시사했다. 또한 형성된 FeO는 Fe3O4/FeO 산화환원 순환(Song et al., 2019)를 통해 단기간에 이산화탄소와 즉시 반응(3FeO + CO2 → Fe3O4 + CO)할 가능성이 높았고, 따라서 이 반응은 H2 발생량 대비 상당한 CO 생성(~3.86 mole%)을 설명할 수 있었다.
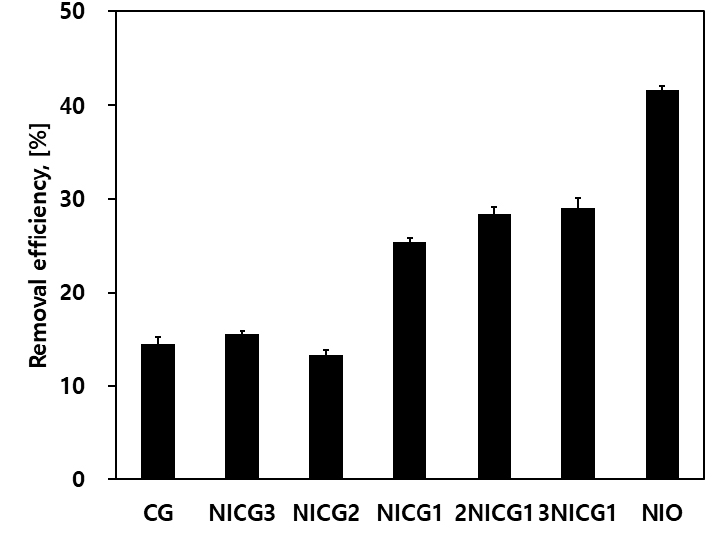
Fig. 4는 CG, NIO, NICG1의 FE-SEM 사진으로 20 μm와 200 nm를 나타내었다. CG는 구형이며 표면은 공극이 존재하였고, NICG1의 사진을 보면 CG의 공극에 나노 철 산화물인 NIO가 둘러싸여 있는 형태인 것을 확인할 수 있었다. 제조된 금속 바이오차를 이용하여 6가 크롬의 흡착 시험을 한 결과, Fig. 5과 같이 첨가제인 NIO가 가장 높은 제거 효율을 보였고 NIO와 CG의 비율이 1:1까지 흡착 효율이 증가하다가 그 이후에는 더 이상 증가하지 않아 큰 영향을 주지 않았다. 따라서 본 흡착 특성 연구에는 금속 바이오차 NICG1만 이용하여 다음의 실험을 통해 흡착능력을 비교 분석하였다.
흡착 특성
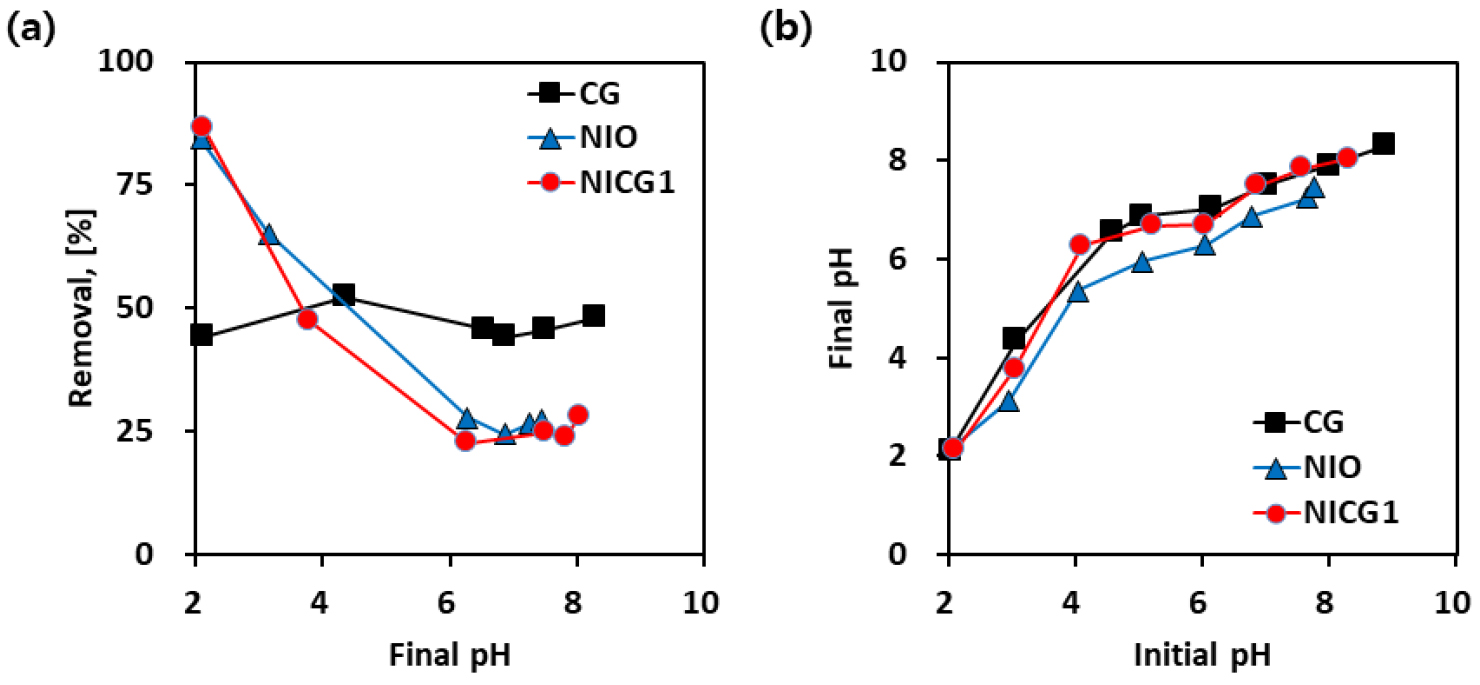
NICG1에 의한 6가 크롬의 흡착 거동에 대한 pH 영향 연구는 금속 바이오차의 첨가에 의해 용액 pH가 변화할 수 있으므로 초기 pH가 아닌 최종 pH(즉 평형 pH)에서 이들의 제거효율을 측정할 필요가 있다. pH 영향은 최종 pH 값을 2에서 9로 변화시켜 수행하였으며, 그 결과는 Fig. 6과 같다. Fig. 6(a)를 보면 CG는 pH변화에 큰 영향을 받지 않고 약 45% 이상의 제거 효율울 보였다. 이 이유에 대해서는 다음의 반응속도 모델과 함께 설명하고자 한다. NIO와 NICG1은 pH 6이하의 낮은 pH에서 흡착이 이루어졌고 pH 2에서 가장 높은 흡착 능력을 보였다. 6가 크롬은 H2CrO4, HCrO4-, CrO42-, Cr2O72-의 여러 형태를 가지고 있으며, pH 2-6사이에서는 HCrO4-가 우세종이며, CrO42-는 pH > 6에서 6가 크롬의 주요 형태이다(Su et al.,2019). 따라서 음이온종인 6가 크롬은 산성 pH 조건에서 흡착에 유리하였고, pH 6이상에서는 OH-이온의 증가로 경쟁 작용에 의해 감소한 것으로 보인다. 또한 흡착 반응 이외에 6가 크롬의 환원에 의해 제거가 일어날 수 있는데, NICG1의 XRD분석결과 자철석 성상을 띠는 것을 확인하였다. Choi의 연구에 따르며 낮은 pH에서 자철석은 일부 용해될 수 있으며 이에 의해 발생한 2가 철 이온으로 환원반응에 의해 6가 크롬이 빠르게 제거된다고 보고되어 있어 자철석에 의한 환원반응에 의해 제거되었을 가능성이 있다(Choi et al., 2008). Fig. 6(b)를 보면 초기 pH가 2-4인 경우를 제외하고 최종 pH는 7-8부근에서 수렴되었다.
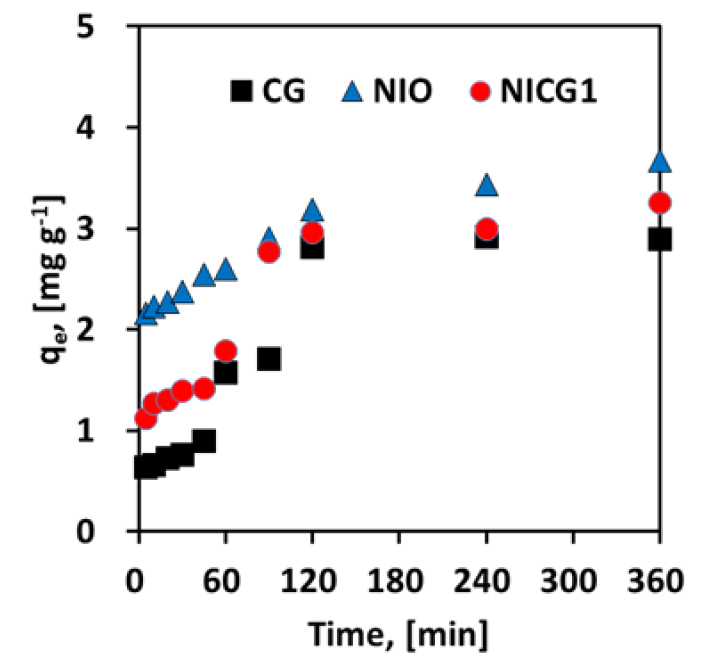
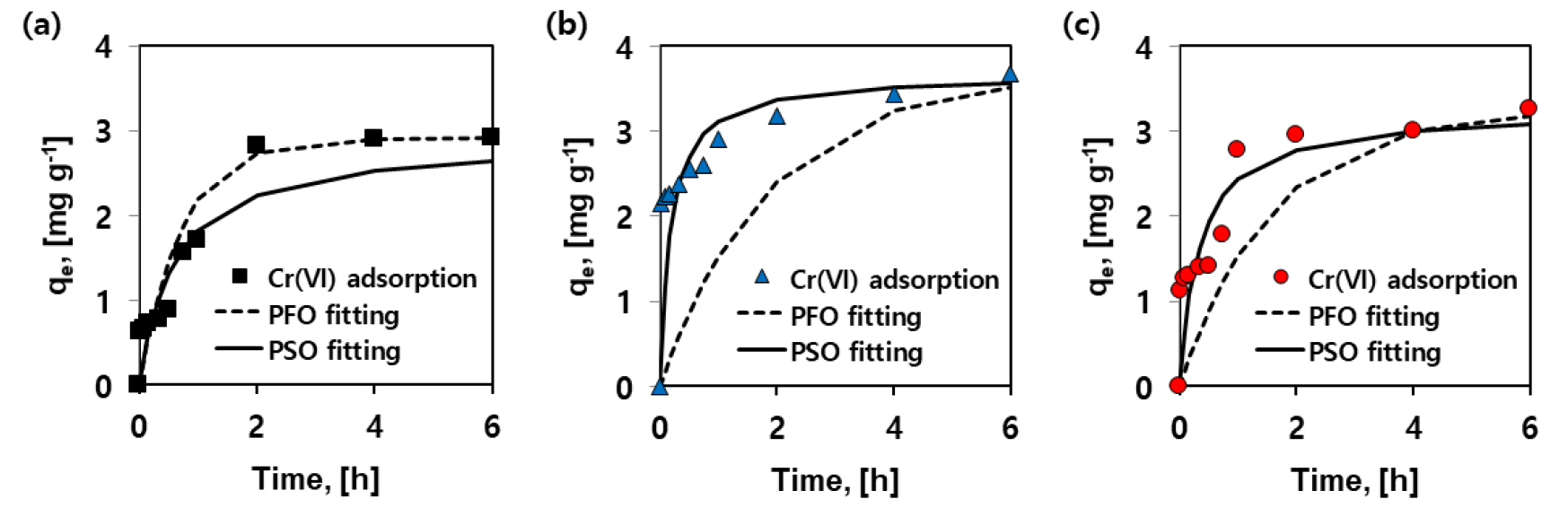
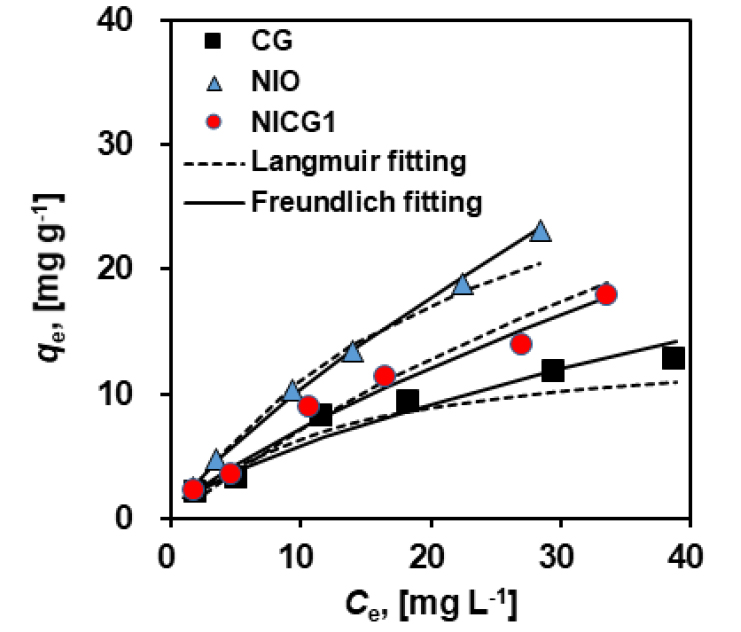
Fig. 7은 시간에 따른 NICG1에 의한 6가 크롬의 흡착량을 보여준다. 360분 경과 후 CG 에 의한 용존 6가 크롬 흡착량은 2.90 mg L-1, NICG1 3.25 mg L-1, NIO 3.67 mg L-1로 첨가제인 NIO가 가장 큰 흡착을 보였다. 6가 크롬 흡착은 반응 초기에 계속해서 서서히 증가하는 경향을 보였고, 이는 2시간 정도에서 평형을 이루었다. Fig. 8은 반응속도 모델을 이용하여 나타낸 결과로 Lagergren의 흡착속도 반응식에 의해 계산되었다. Table 2를 보면 CG의 경우에는 NIO, NICG1과는 달리 유사 1차 속도식에 더 적합한 경향을 보여 물리적 흡착(Physical adsorption)이 더 잘 일어난 것으로 보였는데 CG의 열분해에 의해 발생한 기공에 물리적 충진현상에 의해 흡착이 일어났을 것으로 판단된다. 이는 Fig. 6에서 CG의 흡착이 pH영향을 크게 받지 않는 이유로 볼 수 있다. NICG1의 흡착속도는 유사 1차 속도식의 경우 qe는 3.18 mg g-1, k1은 0.64 min-1로 계산되었고, 유사 2차 속도식의 경우 qe는 3.08 mg g-1, k2는 0.92 g mg-1 min-1로 계산되었다. 반응속도 모델은 상관계수값을 비교한 결과(Pseudo-first order: R2 = 0.7797, Pseudo-second order: R2 = 0.9878), 유사 2차 속도식에 더 잘 맞는 경향을 보여 화학적 흡착(Chemical adsorption)이 일어난 것으로 추정된다. 전반적으로 6가 크롬 흡착 메커니즘이 이온교환, 정전기적 흡착을 통해 이루어지고 이 과정 중 일부는 3가 크롬으로 환원되거나 금속 산화물을 통한 6가 크롬의 환원 프로세스 조합일 수 있음을 보여주었다(Li et al.,2018; Zhang et al., 2013). 흡착 등온 실험은 pH 5, 흡착제 용량 1 g L-1, 초기 농도 5-60 mg L-1의 조건에서 24시간 동안 교반 반응하였고, Fig. 9은 초기 용존 6가 크롬의 농도에 따른 NICG1의 흡착 특성을 보여주고 있다. Freundlich와 Langmuir 등온흡착식을 적용하여 NICG1의 6가 크롬 흡착 성능을 계산한 결과를 Table 3에 나타내었다. Langmuir 등온흡착식에 의해 계산된 NICG1에 대한 6가 크롬의 최대 흡착량은 20.04 mg g-1이었고, Freundlich 등온흡착식을 이용한 NICG1에 대한 6가 크롬의 흡착능력(KF)은 1.33, 흡착강도(n)는 1.36, Freundlich 흡착등온식 상수(KF)는 흡착제의 흡착능력을 나타내며 값이 클수록 흡착능력이 양호함을 의미하며, n은 흡착 강도를 나타내는 것으로 일반적으로 n이 2 이상일 때 흡착 잘 이루어지며 n이 1 이하인 물질은 흡착이 잘 이루어지지 않는다(Treybal, 1980). NICG1은 Freundlich 흡착등온식에 더 잘 맞는 것으로 나타났고 단층 흡착(monolayer adsorption)이 아닌 다층 흡착(multilayer adsorption)이 일어난 것으로 판단된다.
Table 2.
Pseudo-first-order and pseudo-second-order kinetic parameter for Cr(VI) removal
결 론
본 연구에서는 이산화탄소 환경 내에서 커피찌꺼기(CG)와 나노 철 산화물(NIO)의 공동 열분해(co-pyrolysis)를 하여 연료인 합성 가스(H2 & CO)와 흡착제 금속 바이오차(NISG1)의 부가가치 있는 생성물들을 얻을 수 있었다. CG 열화학적 변환 가스 발생량(H2: ~0.37 mole% & CO: ~0.28 mole%)에 비해 첨가제 NIO 사용시 H2와 CO의 발생량은 각각 1.3 mole%와 3.9 mole%까지 크게 증가시키는 것으로 나타났다. 6가 크롬의 흡착에 대한 pH 영향을 살펴본 실험에서 NICG1과 NIO는 pH2에서 가장 높은 흡착 성능을 보였지만 pH가 증가할수록 급격히 감소하였다. 흡착 동역학 분석 실험 결과, NICG1는 pseudo-second-order 모델에 적합함을 알 수 있었으며, 이를 통해 정전기적 인력과 같은 물리적인 힘에 의한 흡착보다는 화학적 반응을 통한 흡착이 우세하게 작용하는 것으로 판단되었다. 흡착 등온선 분석 실험 결과, Freundlich 등온흡착 모델에 더 적합하였으며, 이를 통해 다층흡착의 기작에 의하여 6가 크롬이 제거되는 것으로 볼 수 있었다. 결론적으로 NIO만 첨가하였을 때에는 합성 가스가 전혀 발생하지 않지만, 커피찌꺼기와 NIO를 함께 사용하였을 때 합성 가스가 더 높게 발생하여 회수된 유용 자원은 경제적 가치가 있어 추후 금속 바이오차 제조 시 활용할 경우 제조 공정에 투입되는 에너지와 인력에서 나오는 비용을 상쇄할 수 있다고 생각되며 유용 자원 회수 후 고체 생성물을 큰 흡착 기능 손실 없이 흡착제로 활용할 수 있다는 점에서 환경적/경제적 측면을 모두 만족시킬 수 있다고 판단한다.