서 론
리튬(Li)은 지구상에 존재하는 가장 가벼운 금속원소로서 매우 높은 전기화학적 활성, 높은 비열용량, 낮은 열팽창계수 등의 우수한 특성을 가지고 있다(Xu et al., 2020; Martin et al., 2017; Liu et al., 2019; Maxwell, 2015; Gil-Alana and Monge, 2019). 특히, 에너지밀도가 높아 전기화학적 전위가 높기 때문에 리튬이온전지(Lithium ion batteries, LIBs)의 원료물질로 사용되고 있다(Song and Zhao, 2018). 리튬이온전지의 원료 물질인 리튬(Li)의 수요량은 리튬이온전지를 이용하는 전기자동차(electric vehicles, EV)와 에너지 저장 장치(energy storage systems, ESS) 시장의 급격한 확장으로 인하여 크게 증가하였다(Gil-Alana and Monge, 2019; Song and Zhao, 2018; Grosjean et al., 2012). 전 세계 리튬 시장은 2022년 492.31 LCE(lithium carbonate equivalent) kt로 평가되었으나, 2027년에는 1,193.75 LCE kt로 증가할 것으로 예상되고 있다. 특히, 전기자동차 시장의 급속한 성장은 리튬이온전지 시장의 확대로 이어졌으며, 이에 따라 리튬 수요량도 매우 빠르게 증가하고 있다. 하지만 리튬이온전지의 중요한 원료인 리튬은 2023년을 기점으로 수요/공급 균형이 무너졌으며, 현재 상업적으로 회수하여 공급되고 있는 리튬 자원의 공급은 이미 한계에 도달했기 때문에 또 다른 리튬 공급원의 확보가 커다란 이슈가 되어 주목받고 있다(Mordor Intelligence, 2021).
현재 리튬의 상업적인 생산은 리튬함량이 높은 염호(Li conc. > 1000 ppm)와 리튬정광(Li2O > 7%)을 대상으로 진행되고 있다(Vikström et al., 2013; Meng et al., 2021). 염호로부터의 리튬화합물 생산은 리튬이온의 농도가 약 1000 ppm 이상인 염호를 대상으로 자연증발농축법을 적용하고 있으며, 염호를 자연증발 pond로 이송하여 수개월에서 수년 동안 증발농축을 진행하며, 이 과정을 통해 농축된 리튬용액(> 2%)에 함유된 불순물 성분(+2/+3가 금속이온)의 경우 알칼리 용제를 첨가하여 분리 후 용액의 정제/탄산화반응을 거쳐 탄산리튬을 제조하고 있다. 염호리튬의 주요 매장지 및 생산지로는 칠레, 아르헨티나 등의 남미국가에 제한적으로 분포하고 있다(Meng et al., 2021). 리튬광물의 경우 황산법과 석회법을 이용하여 리튬화합물을 생산하고 있으며 황산법은 리튬정광의 하소 및 황산배소 반응을 통해 정광에 함유된 리튬성분을 수용성 리튬화합물인 황산리튬으로 전환시킨 후 수침출을 통해 리튬 이온을 분리한다. 그리고 황산배소/수침출 과정에서 함께 침출된 다른 금속이온들을 분리/정제한 후 탄산화반응 및 수산화 반응을 적용해 탄산리튬 및 수산화리튬을 제조 하고 있다(Tadesse et al., 2019; Choubey et al., 2016). 석회법은 리튬정광을 생석회(CaO)와 혼합 및 고온에서 열처리한 후 전환물의 수침출 과정에서 고/액 비율 조절 및 반복적인 수침출 과정을 통해 고농도 리튬 용액을 제조한 후, 증발/결정화시켜 불순물이 분리/정제된 수산화리튬 분말의 감압건조 및 스팀건조를 통해 수산화리튬 무수화물 및 일수화물 등을 제조하고 있다(Roskill, 2016). 리튬광물로부터 리튬화합물의 상업적인 생산은 황산법에 의존하고 있으며 석회법을 적용한 리튬회수방법의 경우 황산법과 비교시 리튬성분의 전환율 및 회수율이 낮은 것으로 판단되고 있다.
리튬염호 및 광물로부터 공급되고 있는 리튬화합물의 경우 양극재 제조산업에서 요구되는 리튬수요량을 충족시킬 수 없기 때문에, 리튬함량이 다소 낮은 염호(Li conc. < 1000 ppm), 리튬정광(Li2O < 7%)과 같은 저품위 리튬자원 등으로부터 확보하고자 하는 시도가 활발히 진행되고 있으며 또한 폐리튬이온전지와 리튬이온전지 제조 과정에서 발생하는 폐리튬자원을 이용하여 리튬을 회수하는 방법에 대한 관심이 크게 증가하고 있다. 최근 지열수, 유전염호 등의 저품위 리튬염호로부터 리튬화합물을 확보할 수 있는 회수기술에 대한 관심이 증가하고 있으며(Mohr et al., 2012; An et al., 2012; Liu and Agusdinata, 2020), 이로부터 리튬을 직접적으로 추출할 수 있는 DLE(Direct Lithium Extraction) 기술에 대한 중요성이 증가하고 있다. DLE 기술로 흡착법, 침전법, 용매추출법, 막여과, 전기흡착 등의 비증발 리튬추출기술 등이 제시되고 있으며 기존의 자연증발농축 기반의 리튬회수기술을 적용하기 어려운 저품위 리튬용액을 대상으로 적합한 것으로 평가되고 있다. 최근 친환경 리튬회수기술의 중요성이 확대되면서 자연증발 농축공정과 비교시 리튬회수과정에서 발생하는 폐슬러지 배출량을 현저히 줄일 수 있는 장점을 지니고 있으나 최근까지 상업화에 도달하지 못한 상황이다(Khalil et al., 2022). 이는 리튬 외 다양한 금속이온이 함유되어 있는 염호로부터 선택적인 리튬추출 뿐만 아니라 리튬화합물 회수과정에서 요구되는 고농도 리튬용액 제조 시 공정비용이 높아 현재까지 경제성을 만족시키지 못한 것으로 판단된다. DLE 기술 개발 방향으로 리튬의 선택적 추출 및 저비용/친환경 리튬농축이 가능한 리튬회수기술이 요구되고 있으며 이를 극복하기 위한 대체기술 및 연계공정 개발을 위한 많은 시도들이 진행되고 있다.
본 론
광물리튬 생산기술 현황
광물로부터 리튬을 추출하는 공정으로는 대표적으로 황산법과 석회법이 있으며 Fig. 1은 황산법(Acid roasting)을 적용한 리튬화합물 제조공정으로 황산법은 주로 스포듀민 정광(spodumene, Li2O 7.5~8.5%)을 하소 처리시켜 상전이반응(α-spodumene to β-spodumene) 후 이를 황산과 반응시켜(황산배소) 수용성인 황산리튬으로 전환 후 수침출로 분리하는 방법이다. 스포듀민의 황산배소 후 생성되는 황산리튬의 수침출시 리튬과 함께 마그네슘, 칼슘, 붕소, 철, 알루미늄 등의 금속이온들이 침출, 혼입되기 때문에 수침출 후 여액에 포함된 불순물들을 소다회, 가성소다 등과 같은 알칼리 용제 처리를 통해 불순물 침전물을 여과 후 수산화칼슘 또는 탄산나트륨과의 반응으로 수산화리튬 또는 탄산리튬을 제조하고 있다. 불순물 정제과정에서 침전방법을 통해 제거되지 않은 금속이온은 막여과, 이온교환수지 등을 활용한 정제방법을 통해 리튬화합물의 순도 제어가 가능하다.
Fig. 2는 석회법(Lime roasting)을 적용한 리튬화합물 생산 공정도를 보여주고 있으며 석회법은 스포듀민 또는 레피돌라이트 정광을 석회와 혼합/배소시켜 리튬을 산화리튬으로 전환시키고 이를 수침출시켜 수산화리튬 용액을 잔사로부터 분리한다. 분리된 수산화리튬 용액을 대상으로 막여과 또는 막전기투석 등의 방법을 통해 용액을 정제한 후 이를 증발 결정화시켜 수산화리튬 분말을 분리하고 감압건조 또는 스팀건조시켜 수산화리튬 무수화물 또는 수산화리튬(LiOH·H2O)을 생산하고 있다(Roskill, 2016).
상업적으로 석회법보다 주로 황산법이 적용되고 있으며 그 외 헥토라이트 등과 같이 리튬을 함유한 점토질을 대상으로 황산칼슘, 탄산칼슘 등과 고온반응(~1050°C) 시켜 수용성인 리튬화합물로 전환 후 수침출하여 리튬용액으로 분리 및 정제과정을 거쳐 탄산리튬 또는 수산화리튬으로 제조하는 방법이 있으나 공정의 효율성 및 경제성이 낮은 제약을 지니고 있다. 이외에도 Table 1에 보인 바와 같이 리튬정광 분말을 대상으로 다양한 (염)배소, 침출반응을 적용한 리튬추출기술들이 제시되고 있으나 현재까지 황산법을 제외하고 상업적인 생산단계에 도달하지 못한 상황이다(Tran and Luong, 2015).
Table 1.
Reaction conditions applied to (salt) roasting/leaching of Li mineral concentrate and Li recovery efficiency by raw material (Tran and Luong, 2015)
염호리튬 생산기술 현황
리튬염호는 Li 성분을 함유한 지열수 또는 지하층의 광물로부터 침출 형성된 지하수의 증발/농축과정을 거쳐 고농도로 농축된 이온들을 함유하고 있는 호수형태로 형성되어 육상염호, 온천염호, 유전염호 등으로 존재한다. 염호 내 존재하는 Li의 매장량은 광물보다 높은 비중을 차지하고 있으며(Mohr et al., 2012; An et al., 2012; Liu and Agusdinata, 2020). 대표적인 리튬염호의 경우 칠레, 아르헨티나, 그리고 볼리비아에 집중되어 있다.
칠레의 Atacama, 아르헨티나의 Hombre Muerto 염호로부터 상업적으로 리튬화합물을 생산하고 있으며(Kampf et al., 2005). Table 2에 보이는 바와 같이 리튬이온의 농도는 낮지만 중국, 미국, 인도 등 전 세계적으로 분포하고 있다. 하지만 경제성을 지닌 자연증발농축 방식의 생산기술은 고농도 리튬염호에 제한적으로 적용될 수 있어 전 세계 생산량의 60%이상이 자연증발농축 공정 적용이 가능한 남미의 염호로부터 공급되고 있다(Garrett, 2004; Li et al., 2019; Garcés and Álvarez, 2020; Naumov and Naumova, 2010). Table 3은 전 세계 염호별 리튬 매장량을 보여주고 있으며, 볼리비아의 Uyuni 염호가 약 9백만 톤, 칠레의 Atacama에 약 6백만 톤 이상 매장되어 있고 남미 3국의 매장량이 전 세계 매장량의 70% 이상을 차지하는 것으로 확인되고 있다(Yaksic and Tilton, 2009; Flexer et al., 2018). Fig. 3은 고품위 리튬염호를 대상으로 자연증발농축 방법을 적용해 탄산리튬을 제조하는 공정도이다(Roskill, 2016).
Table 2.
Composition and concentration distribution of brines (Garrett, 2004)
Table 3.
Major deposits of brine (Flexer et al., 2018)
염호를 증발조(evaporation pond)로 이동시켜 리튬이온의 농도가 2~6%에 도달할 때까지 수개월이상 자연증발/농축 후 소석회 등의 알칼리 용제를 사용해 불순물을 분리/정제 후 탄산나트륨을 반응시켜 탄산리튬으로 제조하는 방법이 적용된다. 염호에 함유된 성분중 염화나트륨, 염화칼륨은 증발/농축시 단계별 침전으로 분류되지만 마그네슘의 경우 별도의 침강 공정(알칼리용제 첨가)으로 분리 후 제거된다. 염호리튬 추출공정은 공정비용이 낮은 장점이 있으나 태양열과 바람을 이용한 증발/농축이 기본 공정으로 증발률 및 기후 조건 의존도가 높고, 장시간의 공정시간이 요구되며 농축과정과 분리/정제 과정에서 과량의 폐슬러지가 발생하여 환경부담이 높은 제약을 지니고 있다(An et al., 2012; Stamp et al., 2012). 염호리튬 회수과정에서 마그네슘 함량이 높은 염호일수록 채산성이 낮으며 이는 자연증발/농축과정 후 잔류하는 마그네슘 제거를 위해 불순물 분류 공정에서 알칼리 용제 사용량이 높아 공정비용 상승요인으로 작용하기 때문인 것으로 판단된다. 최근 리튬화합물의 수요급증과 더불어 남미지역 저품위 염호개발에 대한 관심 또한 높아지고 있으나 환경부담 상승으로 인해 개발이 지연되고 있는 상황이다.
DLE(Direct Li Extraction) 기술 현황
염호로부터 리튬화합물의 회수공정에서 장시간의 공정시간 및 기후 조건에 열약한 기존의 자연증발농축 공정을 대체하기 위한 리튬추출기술들이 제시되고 있으며 특히 중국, 미국 및 남미에 위치한 저품위 염호(Li conc.<1000 ppm)를 대상으로 활발한 연구가 진행되고 있다. 최근 저품위 염호를 대상으로 DLE(Direct Li Extraction) 기술들이 검토되고 있으며, DLE 기술은 용어의 의미와 동일하게 리튬함유 용액으로부터 직접적으로 리튬을 선택적으로 추출/분리하는 비증발 리튬추출기술로 알려져 있다(Khalil et al., 2022).
Fig. 4는 DLE 기술 공정 흐름도를 보여주고 있으며 DLE 기술로 요구되는 주요 특징으로는 기존의 자연증발농축 공정과 비교시 공정시간이 빠르고, 90% 이상의 리튬회수 및 리튬이온의 선택적(>80%) 추출이 가능하며 지열수, 유전염호 등과 같은 비전통적인 리튬자원에 적용이 가능하고, 리튬추출 후 염호의 재주입이 가능한 환경성 등의 요구사항을 만족시켜야 한다(Grant, 2020).
대표적인 DLE 기술로는 용매추출법(Song et al., 2020; Shi et al., 2020; Meshram et al., 2014), 침전법(Yanagase et al., 1983; Xiao and Zeng, 2018; Yang et al., 2018; Mulwanda et al., 2021), 흡착법(Abe and Chitrakar, 1987; Miyai et al., 1994; Ryu et al., 2013; Hong et al., 2018; Park et al., 2014; Xiao et al., 2015) 등이 검토되고 있으며 이외에도 막여과(Gong et al., 2018; Guo et al., 2016), 전기흡착(Nie et al., 2017; Jiang et al., 2014; Shi et al., 2019; Kanoh et al., 1991, Ryu et al., 2015a) 등의 기술들을 활용한 리튬회수기술 개발이 진행되고 있다.
용매추출법
용매추출법의 경우 추출제의 리튬이온에 대한 선택도가 낮기 때문에 염호에 함유된 +2/+3가 이온을 분리하기 위해 알칼리 용제를 사용해 불순물을 분리해야 하는 전처리 과정이 요구된다. 또한 리튬이온의 회수과정에서 산용액을 사용해 리튬이온을 탈착/분리하기 때문에 회수용액의 리튬화합물 전환과정에서 과량의 알칼리 용제 사용 및 다단계의 정제과정이 요구되는 제약을 지니고 있다. 추출제로는 DEHPA(Di-2-ethylhexyl phosphoric acid), TPB(tri-n-butylphosphate), HTTA (2-thenoyltrifluoroacetone), TOPO (trioctylphosphine oxide) 등이 일반적으로 사용되고 있으며, 추출제를 불순물이 분리된 리튬용액과 반응시켜 분리하는 방법으로 적용되고 있다(Hano et al., 1992; Pranolo et al., 2015; Zhou et al., 2020).
Fig. 5는 용매추출 공정도 및 미국 네바다에 위치한 Clayton valley 염호를 대상으로 Pure Energy Minerals Ltd 주도하에 진행된 실증화 기술(Tenova Bateman Lithium Projects, LiSX) 개발 계략도를 보여주고 있다(Roskill, 2016; Metalsnews, 2015). Clayton valley 염호의 경우 리튬이온의 농도가 약 >160 ppm 이상으로 용매추출법을 적용시 90% 이상의 리튬회수가 가능한 장점이 있지만 현재까지 상용화 단계에는 도달하지 못한 상황이다. 최근에는 이온성 액체에 분산시킨 Crown ether 리간드를 활용한 용매추출공정이 제시되었고 +1가 이온들이 혼재되어 있는 용액으로부터 리튬이온 분리시 높은 선택성을 지니고 있으나 +2/+3가 혼합용액의 경우 불순물 분리를 위한 전처리 공정이 요구되는 제약을 지니고 있다(Swain, 2016).
최근 폐리튬이차전지 재활용 공정의 중요성이 확대되면서 기존의 용매추출법을 활용한 분리공정(Ni, Co, Mn sulfates등)을 기반으로 양극재 핵심소재로의 업싸이클링 기술개발이 활발히 진행되고 있으며 상용화 기술 수준에 도달한 것으로 확인되고 있다(Song et al., 2017; Zeng et al., 2014; Shi et al., 2020; Meshram et al., 2014).
침전법
침전 반응은 하기 방정식에 서술된 원리에 따라 수용액의 이온과 침전제로부터 해리된 이온이 결합하여 용해도 차이에 따른 불용성화합물을 형성시켜 침전/분리하는 방법으로 이뤄진다(William et al., 2007).
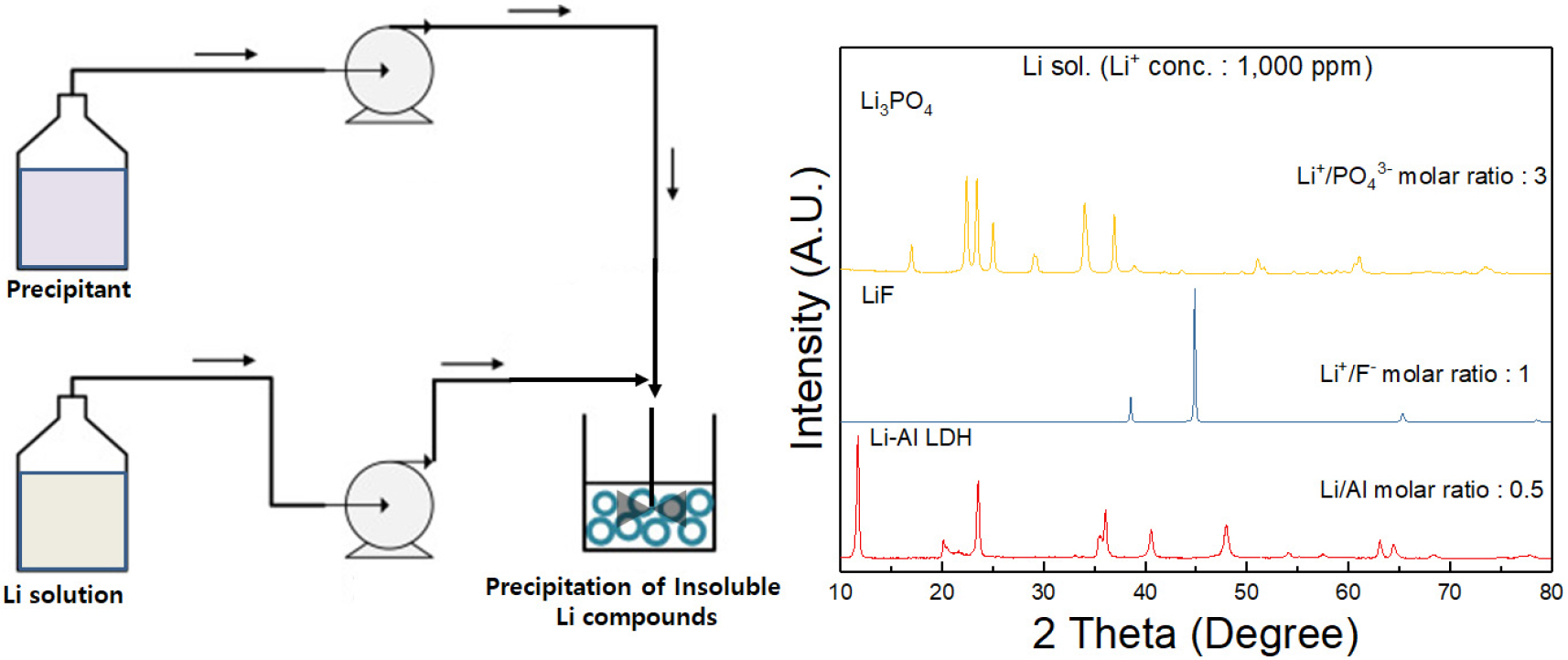
DLE 기술로써 활용되는 침전법은 인산화합물(H3PO4, Na3PO4, (NH4)2HPO4 등) 또는 알루미늄화합물(Al, NaAlO2, AlCl3 등)과 같은 침전제를 사용하여 용액에 존재하는 리튬 이온과 반응시켜 불용성 리튬화합물인 인산리튬(Li3PO4) 또는 Li-Al LDH(layered double hydroxide)로 리튬 이온을 침전/분리하는 방법이 적용된다(Song and Zhao, 2018; Yanagase et al., 1983; Xiao and Zeng, 2018; Mulwanda et al., 2021; Shin et al., 2022; Sun et al., 2019). 이외에도 리튬이온을 함유한 용액을 대상으로 불화물과 반응시켜 불화리튬으로 분리하는 방법 또한 제시되고 있으나 리튬회수율이 낮고 반응 후 잔류하는 여액 처리에 대한 부담을 지니고 있어 리튬을 함유한 폐액 및 폐기물을 대상으로 일부 제한적으로 적용되고 있다(Sarraf-Mamoory et al., 2007).
Fig. 6은 리튬용액으로부터 침전반응을 통한 불용성 리튬화합물 제조 공정도 및 형성되는 불용성 리튬화합물들의 조성을 보여주고 있다. 불용성 리튬화합물중 Li-Al LDH의 경우 용해도가 가장 낮아 리튬회수율이 높은 장점을 지니지만 인산리튬 및 불화리튬과 비교시 단위무게당 리튬함량이 약 3.2%로 가장 낮고, 낮은 비중으로 인해 탄산리튬 제조과정에서 요구되는 고농도 리튬용액 제조시 농도한계(<1%)를 지니고 있다. 최근 아르헨티나 옴브레 염호를 대상으로 인산법을 적용한 리튬추출 실증화 기술개발이 진행중이며 국내 ㈜포스코홀딩스에서 파일럿 규모의 실증검증을 거쳐 상용화 공정을 준비중이다. 주요 공정으로 3~6개월 동안 염호의 자연증발/농축과정을 거쳐 리튬이온의 농도가 약 4000 ppm 수준에 도달하면 염호 농축수에 포함된 불순물 이온들을 분리하고 인산화합물과 반응시켜 리튬성분을 인산리튬으로 분리한다. 후속 공정에서 Fig. 7에 보이는 바와 같이 인산리튬을 산침출시켜 제조된 고농도 리튬용액을 원료로 전기투석 과정을 거쳐 수산화리튬 용액 및 산용액을 분리하고 회수된 수산화리튬 용액의 결정화 및 탄산화 반응을 통해 수산화리튬 및 탄산리튬 분말을 제조하는 공정을 적용하고 있다.
침전법은 리튬추출 속도가 빠른 장점을 지니고 있지만 리튬 외 혼입된 금속이온(Ca, Mg, Fe 등)이 존재할 경우 리튬이온보다 높은 반응성을 지녀 추출과정에서 불순물 분리를 위한 전처리 과정이 요구되며 리튬이온의 농도가 낮을 경우 과량의 침전제가 사용되는 단점을 지니고 있다. 저농도 염호(지열수 등)로부터 리튬이온을 추출하기 위해 알루미늄 화합물(AlCl3, NaAlO2등)을 첨가하여 리튬성분을 분리하는 연구가 진행되었으나 용액 pH 범위를 알칼리 구간으로 조절해야 하는 단점을 지니고 있으며 이로 인한 환경부담이 높은 제약을 지니고 있어 리튬폐액 등과 같은 순환자원을 대상으로 리튬성분을 분리하는 공정에 일반적으로 적용되고 있다(Ryu et al., 2019b).
흡착법
흡착법은 리튬이온에 대한 선택성을 지니는 흡착소재를 사용하여 리튬이온을 선택적으로 흡착 후 탈착시켜 Li이온을 회수하는 방법으로 반복적인 흡착/탈착과정을 거쳐 고농도 리튬용액(>1000 ppm)을 제조한다. 특히, 불순물의 영향이 크지 않기 때문에 분리/정제 과정에서 발생하는 폐슬러지의 양이 매우 적으며, 상대적으로 다른 DLE 기술과 비교하여 저농도의 리튬 용액에서도 리튬 회수가 가능한 장점을 가지고 있다.
Fig. 8에 보이는 바와 같이 대표적인 흡착제로 스피넬 구조의 LMO(lithium manganese oxide) 및 LTO(lithium titanium oxide)가 사용되고 있으며(Xiao et al., 2018; Marthi et al., 2021; Abe and Chitrakar, 1987; Miyai et al., 1994; Ryu et al., 2013; Hong et al., 2018; Park et al., 2014; Xiao et al., 2015; Ryu ea al., 2019c) 최근 Li-Al LDH(Sun et al., 2019; Ding et al., 2022) 및 리튬광물 잔사(Han et al., 2018)를 흡착제로 활용한 연구가 보고되고 있으나 리튬선택도의 경우 LMO보다 낮은 한계를 지니고 있다.

Fig. 8.
Li adsorbent structure and adsorption mechanism: (a) spinel Li-Mn-O, (b) layered Li-Ti-O, (c) Li-Al LDH, (d) spodumene residue (Xiao et al., 2018; Marthi et al., 2021; Sun et al., 2019; Han et al., 2018).
흡착법을 적용한 리튬회수기술은 다양한 금속이온이 혼합되어 있는 염호, 특히 저품위 염호로부터 리튬이온을 선택적으로 추출할 수 있는 장점을 지니고 있다. 하지만 흡착 후 회수하는 과정에서 산용액과의 반복적인 탈착반응으로 인한 흡착제 성분의 손실이 발생하는 제약을 지니고 있으며 회수되는 리튬용액에 함유된 리튬이온의 농도가 낮아(<2000 ppm) 후속 농축공정이 요구된다. 또한 실증화 공정으로 적용시 위해 흡착제 분말의 성형화 기술이 요구되며 granule, bead, membrane 등의 형상제어 및 시스템화 과정에서 흡착 site blocking으로 인한 흡착용량 저하 및 흡착제 담지효율 저하 등의 단점을 지니고 있어 이를 해결하기 위한 연구 또한 활발히 진행 중이다(Ryu et al., 2019a; Hong et al., 2018; Ryu et al., 2015a; Chung et al., 2008; Ma et al., 2011; Umeno et al., 2002).
Fig. 9는 대표적인 DLE 기술(침전법, 용매추출법, 흡착법)을 적용한 리튬회수 공정도 및 적용가능 범위를 보여주고 있다. 염호로부터 리튬회수과정에서 침전법 및 용매추출법의 경우 불순물 분리를 위한 전처리 과정이 요구되며 중간물질로 불용성 리튬화합물(인산리튬, 리튬-알루미늄 수산화물), 황산리튬 및 염화리튬으로 전환 후 알칼리 용제(NaOH, CaO 등)를 사용한 정제 및 탄산화물과의 반응을 통해 탄산리튬으로 제조된다. 하지만 고농도 리튬용액 제조과정에서 산용액을 사용한 불용성 리튬화합물의 침출 및 용매추출과정에서 제조되는 리튬용액의 경우 후속 탄산리튬 전환과정에서 과량의 알칼리 용제 사용이 동반되는 제약을 지니고 있어 이를 해결하기 위한 방안이 요구되고 있다.
막분리 공정
막분리(Membrane separations) 기술은 이온분리를 위한 구동력 방식에 따라 가압조건(pressure)에서 운영되는 막여과(Membrane Filtration) 및 전위차 분리 방식의 전기흡착(Electro Adsorption) 공정으로 구분될 수 있다. 막여과 방식의 RO(Reverse osmosis) 공정 및 전기흡착 방식의 ED (Electrodialysis), MCDI(Membrane capacitive deionization) 공정은 용액에 함유된 이온의 탈염방식을 이용한 정수처리 공정에 널리 사용되고 있으며 탈염속도 및 탈염용량을 향상시키기 위한 멤브레인 및 시스템 개발 연구가 활발히 진행되어 왔다. 리튬이온의 분리공정에서 요구되는 막분리 기술은 특정이온에 대한 선택성, 우수한 멤브레인 내구성 및 낮은 공정비용으로 운영되는 시스템 개발이 필수적이다.
리튬이온의 선택적 분리공정에 적용되는 멤브레인 소재로 다공성 MOF(metal-organic frameworks) 소재가 제시되고 있으며 polymer/MOF 복합체 및 mixed-matrix 멤브레인 및 polymer PSS(polystyrene sulfonate) 멤브레인의 경우 +1/+2가 이온 분리효율이 높은 것으로 알려져 있다(Guo et al., 2016).
전기투석(Electrodialysis) 공정은 전극에 전위를 가한 상태에서 용액 내의 이온들이 멤브레인을 통과, 이동/분리되는 방식으로 이용되고 있으며 담수화 및 고농도 용액 생산 등의 공정에서 사용되고 있다. 이온 농축효율이 높은 장점을 지니고 있지만 용액 내 잔류하는 이온의 농도가 MCDI 공정보다 상대적으로 높고 이온 회수율이 낮은 제약을 지니고 있다. MCDI(Membrane capacitive deionization) 공정은 탄소소재 기반의 다공성 전극을 사용하여 고순도의 물을 생산하고, 수용액내에 존재하는 하전된 불순물을 제거하기 위한 에너지 효율이 높은 담수화 기술에서 시작되었다(Farmer et al., 1995; Lee et al., 2018b). MCDI의 기본 원리는 정전 흡착으로, 전극과 용액 사이에서 이온의 산화/환원 없이 전극 계면의 정전 흡착에 의해 구동 된다(Farmer et al., 1996). MCDI는 기존의 CDI 시스템 전극 재생과정에서 발생하는 재생효율 감소 문제를 극복하기 위해 멤브레인을 활용하였으며 CDI 시스템을 모방하여 제안되었다(Farmer et al., 1996; Biesheuvel and Van der Wal, 2010; Li and Zou, 2011; Li et al., 2008; Kim and Choi, 2010; Biesheuvel et al., 2011). CDI 시스템의 전극 재생과정은 전극에 역전위를 가하여 재생이 진행되며, 이 때 전극에서 탈착된 이온이 반대 전극에 흡착되는 문제가 발생하고 있으며, 이로 인해 전극의 불완전한 재생이 유도되어 흡착 용량 감소, 재생 시간 지연 및 전극에 잔류 이온이 축적하게 되어 전극의 효율이 저하된다. 이를 개선하기 위해 Fig. 10에 보이는 바와 같이 양이온 교환막(Cation exchange membrane, CEM)과 음이온 교환막(Anion exchange membrane, AEM)을 전극에 사용하여 재생과정에서 반대 전극으로 흡착되는 것을 차단하여, 전극의 완전한 재생, 재생 시간 단축, 그리고 안정적인 흡착 용량 유지가 가능하며 재생과정에서 농축수 제조가 가능한 특징을 지닌다(Lee et al., 2006; Zhao et al., 2013; Lee et al., 2011; Bryjak et al., 2015; Almarzooqi et al., 2014).
MCDI 공정을 응용하여 리튬이온의 선택적 흡착 및 탈착과정을 통해 리튬을 추출하는 방법(Lee et al., 2018a; Ryu et al., 2015a) 또한 제시되고 있으며 Fig. 11에 보이는 바와 같이 흡착제 소재가 담지된 멤브레인을 MCDI 전극으로 활용해 리튬이온을 선택적 흡착/분리하는 방식으로 적용이 가능하다. 리튬이온의 흡착과정에서 전위를 인가하여 금속이온들의 경우 (–)전극으로 이동하고 Li 이온의 선택적 흡착반응 완료 후 시스템 내부를 수세하여 잔류하는 이온들을 제거한 후 역전위를 인가하여 흡착된 리튬이온을 회수하는 방식으로 이뤄진다. 이외에도 전극반응(Kanoh, 1991; Pasta et al., 2012)을 적용한 리튬추출기술이 제시되고 있으며 Pt/λ-MnO2 또는 LiFePO4/Ag 전극을 사용하여 리튬이온을 선택적으로 MnO2 또는 FePO4 전극에 intercalation 후 탈착 공정에서 역전위를 인가해 분리하는 방식으로 이뤄진다. 현재까지 개발된 전기흡착, 전극반응 기반의 리튬추출기술은 연구수준에 머무르고 있는 상황이다.

Fig. 11.
Principle of adsorption and desorption of Li ion by MCDI process using selective adsorption electrode (Ryu et al., 2015b).
고품위 광물 또는 염호로부터 상업적으로 회수 가능한 리튬의 양은 한계에 도달하고 있으며, 이를 극복하기 위해 저품위 리튬자원으로부터 리튬화합물을 확보할 수 있는 기술개발에 대한 관심이 급증하고 있다. 종래에 사용되고 있는 자연증발농축 방식의 리튬 회수 기술은 저품위 리튬자원 회수공정에 적용하기 적합하지 않으며, 특히 채산성 뿐만 아니라 자원개발 과정에서 배출되는 폐슬러지 발생량의 현저한 증가로 인해 이를 대체할 수 있는 DLE 기술에 대한 필요성이 증대되고 있다. DLE 기술 중 침전법의 경우 빠른 회수 속도 및 높은 리튬 회수율의 장점을 지니고 있지만, 용매추출법, 흡착법과 비교시 상대적으로 높은 리튬이온 농도가 요구되며, 과도한 화학용제 사용으로 인한 부산물 처리 부담이 높은 단점을 지니고 있다. 흡착법의 경우 저품위 리튬염호로부터 선택적인 리튬 회수가 가능하며 폐기물 발생이 현저히 적지만, 실증화 기술로의 적용을 위해 흡착제 분말의 성형화 또는 시스템화가 선행되어야 하며, 이로 인한 흡착제의 성능을 저하시키는 제약을 지니고 있다. 전기적 흡착의 경우 기존의 흡착공정과 비교시 산용액 사용량을 현저히 줄일수 있는 이점을 지니고 있으나 리튬을 선택적으로 분리할 수 있는 전극 및 교환막 개발이 요구되고 있다. 용매추출법은 빠른 반응속도와 높은 회수효율의 장점을 지니고 있지만, 고가의 추출제 사용에 따른 공정비용 부담 및 과도한 산용액 사용으로 인해 후속 리튬화합물 전환과정에서 과량의 알칼리 용제 사용이 동반되는 제약을 지니고 있다. 이외 다양한 DLE 기술들(막분리, 전기흡착 등)이 제시되고 있으나 현재까지 연구단계에 머무르고 있는 상황이다.
DLE 기술중 저농도 리튬용액에서도 선택적으로 리튬을 추출할 수 있는 흡착법이 리튬 회수공정에서 요구되는 환경성 및 채산성을 만족시킬 수 있는 수준에 접근하고 있지만, 단독기술로 적용하기에 한계를 보이고 있다. 향후 환경성 및 채산성을 확보한 리튬회수기술로는 저품위 염호를 대상으로 리튬이온의 선택적 추출, 친환경/저비용 농축공정을 연계한 공정기술이 요구되며 또한 리튬회수공정에서 화학용제 사용량 절감 및 부산물의 재순환, 재원료화 기술개발이 요구된다.