서 론
슬래그반응조를 이용한 망가니즈 자연정화기술
적용 매질과 수두차
처리효율의 변화
체류시간
운영 초기의 pH 안정화
pH 재강하를 위한 소택지
망가니즈 공침 및 흡착 예측기술
망가니즈의 공침 및 흡착 효과 비교
철 및 알루미늄 농도에 따른 망가니즈 처리 pH
결 론
서 론
망가니즈는 국내 광산배수 중 약 73개소에서 청정지역 배출허용기준인 2 mg/L를 초과하여 철 다음으로 기준을 많이 초과하는 물질이다(Kim et al., 2019). 망가니즈는 지각에서 풍부한 원소 중 하나로서 국내 석탄광산 및 금속광산의 주변암에 탄산염 및 산화물 형태로 존재하는데, 황철석 산화시 발생하는 H+ 등에 의하여 비교적 쉽게 용해된다(Cox, 1995; Younger et al., 2002). 한편, 망가니즈의 섭취는 신경계에 영향을 주며 학생들의 지적 발달에 손상을 일으킬 수 있다고 보고되었다(USEPA, 2004; Bouchard et al., 2011; Rodríguez-Barranco et al., 2013).
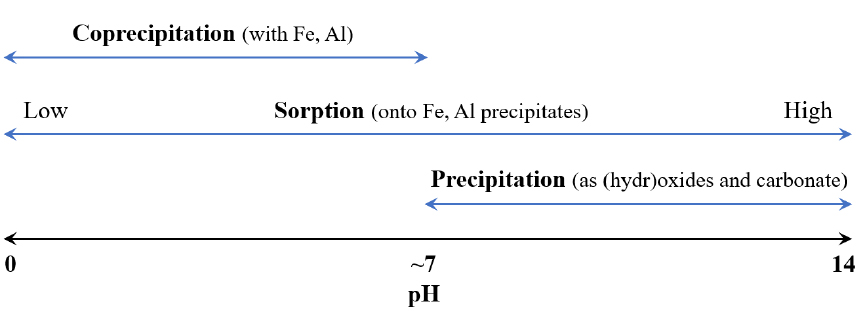
그러나 망가니즈는 황화물로 석출되거나 흡착되기 어려운 화학종이며(Kim et al., 2017a; Younger et al., 2002), (수)산화물로 석출되기 위해서는 9.5~10.0 이상의 높은 pH가 필요하다(Hem, 1963; Younger et al., 2002). 따라서 광산배수에서 망가니즈가 기준을 초과하는 경우 이를 전통적 자연정화공법으로 처리할 수 없었으며, active 처리시설에서 pH를 크게 높여 처리해 왔다. active 처리시설은 관리를 위한 인건비가 발생하며 전기 등 에너지를 사용하는 한편 알칼리제로서 주로 소석회를 지속적으로 투입한다. 2050년까지 탄소 중립이 필요한 시기에 소석회와 같이 생산 과정에서 다량의 이산화탄소를 발생시키며 에너지를 소비하는 active 처리시설보다 망가니즈의 자연정화기술을 최적화하여야 한다.
한편, active 처리시설에서 망가니즈는 철 및 알루미늄과 공침하거나 해당 수산화물에 흡착·이온교환되므로 처리를 위해 필요한 pH가 낮아진다(Hem, 1963; Lovett, 1992; Boughriet et al., 1995; Cravotta, 1998; Skousen et al., 2000; Kim et al., 2018a). 이중 Cravotta(1998)는 망가니즈 고형물에 대해 불포화된 상태에서도 망가니즈 농도가 감소한 결과를 보고하였다. Skousen et al.(2000)은 철 농도가 망가니즈의 4배 이상인 경우 철이 망가니즈를 pH 8에서 크게 저감시킬 수 있음을 보고하였다. 최근에는 Kim et al.(2018a)이 여러 active 처리시설의 자료를 바탕으로 Mn/(Fe+Al) 비율과 방류수 pH의 경험적 상관관계를 제시하였다. 이들 연구 결과는 공침 및 흡착에 의해 설계 pH가 감소하는 효과를 지시한다. 만약 광산배수 내 망가니즈, 철 및 알루미늄의 농도를 통해 망가니즈까지 처리하기 위한 pH를 쉽게 예측할 수 있다면 실험을 최소화하면서 active 처리시설을 적절하고 효율적으로 설계할 수 있다. 예를 들어, pH의 배출허용기준(8.6)을 만족시키기 위한 pH 재조정 시설의 설치 여부를 판단할 수 있다. 또한, 알루미늄과 망가니즈 농도가 높은 광산배수의 경우 pH를 과다 상승시키면 알루미늄이 재용해되므로 알루미늄 성분을 석출, 분리한 후 망가니즈 성분을 석출, 분리하는 다단중화공정을 적용하는 경우가 있는데, 이의 적용 여부도 예측할 수 있다.
따라서, 망가니즈의 자연정화공법으로는 국내 광산배수 처리사업에서 도입 단계에 있는 슬래그반응조, 그리고 active 처리공법에서는 공침 및 흡착을 고려하여 망가니즈의 처리 pH를 예측하는 기술을 적용하여 효과적으로 설계하는 방안이 필요하다. 본 연구에서는 슬래그반응조의 설계에 있어서 필요 수위차, 매질 구성, 처리효율 변화, 체류시간 등의 설계 인자를 검토하고 적용하는 방안을 제시하며, 또한 active 처리시설에서 망가니즈를 처리하는 pH를 예측하여 설계에 반영하는 방안을 관련 연구로부터 제시하고자 한다.
슬래그반응조를 이용한 망가니즈 자연정화기술
적용 매질과 수두차
전통적으로 자연정화 매질로 사용되어 온 석회석은 이론적으로 pH를 8.3까지만 높일 수 있으며 실제로는 6~7 정도로만 높이는 경우가 많아 망가니즈를 제거할 수 없다. 따라서 CaO 성분을 함유함으로써 물과 반응하여 소석회(Ca(OH)2)처럼 OH-가 생성되는 매질을 사용하여야 하며, 이에는 제강슬래그와 석탄회, 하소백운석 등이 있다. 이중 제철소의 철강 부산물인 제강슬래그는 자연정화매질로 사용하기 용이한 입상으로 산출된다. 제강슬래그는 전로(basic oxygen furnace, BOF) 슬래그 및 전기로(electric arc furnace, EAF) 슬래그로 구분되며, 이중 전로 슬래그는 전기로 슬래그와 달리 CaO 성분을 25~50% 함유한다(Qiu et al., 2012; Mauthoor et al., 2014; Piatak et al., 2015; Park et al., 2016; Branca et al., 2020; Teo et al., 2020).
미국에서는 25년 전부터 제강슬래그를 활용한 SLB(slag leach bed)를 광산배수 처리용으로 사용해 왔다(Ziemkiewicz, 1998; Hamilton et al., 2007; Skousen et al., 2017). SLB는 광산배수 인근의 깨끗한 계곡수와 반응하여 제강슬래그에서 CaO 성분을 용출시켜 pH가 높은 알칼리수를 생성하며, 이것이 하류에서 광산배수에 투입되어 pH를 높임으로써 망가니즈를 제거한다. 그러나, 광산배수 대비 계곡수의 유량이 상대적으로 증가하면 알칼리수의 양이 많아져 광산배수 반응 후 방류수의 pH가 환경기준(8.5~9.0)을 초과할 수 있으며, 계곡수의 유량이 상대적으로 감소하면 망가니즈가 환경기준을 초과할 수 있는 등의 문제점이 있다(Goetz and Riefler, 2014). 따라서 인구밀도가 높고 배출허용기준을 항시 만족시키고자 하는 국내 상황에서는 SLB의 대안으로 광산배수를 제강슬래그가 포함된 반응조에 직접 전량 유입시켜 처리하는 슬래그반응조를 적용할 수 있다.
그러나 슬래그반응조를 성공적으로 적용하기 위해서는 주요한 두 가지의 제약 사항을 극복해야 한다. 첫째, 슬래그반응조의 공극 내에 망가니즈 등의 화합물이 침전되므로 이로 인한 투수성 저하에 대응해야 한다. 이는 국내에서 운영 중인 SAPS(Successive Alkalinity Producing System)의 경우처럼 스톱 로그(stop log)를 설치하여 유출수위를 조절함으로써 투수계수(hydraulic conductivity)가 저하되더라도 슬래그반응조 내 수위와 슬래그반응조 유출지점의 수두(hydraulic head) 차이를 확보하고 조절함으로써 월류를 방지하며 운영할 수 있다. 필요 수두차는 Darcy의 법칙에 유량, 매질내 유동 거리, 투수계수, 유동 단면적을 대입하여 식 (1)과 같이 계산하며, 이를 반드시 고려하여 슬래그반응조의 설계에 반영하여야 한다.
Δh : 수두차(유입부 수두-유출부 수두, m),
Q : 유량(m3/d),
L : 매질내 유동 거리(m),
K : 투수계수(m/d),
A : 유동 단면적(m2)
예를 들어, 200 m3/d의 원수를 2개의 슬래그반응조에 나누어 병렬로 유입시키는 경우, 공극 내 체류시간 4시간 및 공극율 36%(MIRECO, 2015)를 가정하면 포화된 매질은 46.3 m3가 필요하다. 매질 내에서 수평으로 유동하는 횡류형 반응조에서 길이:폭 비율을 3:1로 적용하여 사영역을 저감하고 매질 내 수위 1.5 m를 적용하는 경우, 길이 9.6 m 및 폭 3.2 m, 그리고 유동 단면적은 4.8 m2로 산출된다. 그리고 슬래그(40%) 및 석회석(60%) 혼합매질의 투수계수는 최근 슬래그반응조 파일럿 시설에서 측정된 0.41 cm/s을 다른 인자들과 함께 식 (1)에 대입하면, 필요 수두차는 0.56 m로서 유출부 수위는 0.94 m로 예상되며, 향후 침전물 축적에 따라 투수계수가 저하될 수 있으므로 수위를 충분히 낮출 수 있도록 스톱 로그를 운영해야 한다.
둘째, 유입수에 Fe2+가 존재하는 경우 망가니즈보다 먼저 산화되며(Hedin and Nairn, 1993; Gouzinis et al., 1998), 산화 및 침전 과정에서 pH를 낮추어 망가니즈의 제거를 방해하고, 망가니즈 산화물을 환원하여 용해시킬 수도 있다(Burdige et al., 1992; INAP, 2012). 슬래그반응조의 효율을 유지하기 위하여 원칙적으로 SAPS 및 산화침전조 등에서 철을 전처리한 이후에 슬래그반응조를 설치하지만, 원수 조성 및 철 처리공정의 효율 변동에 따라 Fe2+가 유입될 수 있다. 단, 매질 내에 망가니즈 산화물(MnO2)이 장기간 축적된 경우 이의 촉매산화작용에 의해 슬래그반응조를 통과하며 철 및 망가니즈가 산화, 제거되기 용이하다(Kim et al., 2017b). 또한, 제강슬래그와 석회석을 4:6의 부피비로 혼합한 반응기에서 철 유입시에도 망가니즈 제거효율이 높게 유지됨이 보고되었다(Kim et al., 2017b, 2018b).
처리효율의 변화
이에 따라서 국내에서는 한국광해관리공단에서 파일럿 규모의 슬래그반응조를 5개 광산에 적용하여 효율을 평가하였으며 실내 벤치 규모로 2년간 운영하였다(Table 1, Kim et al., 2019). 사전에 비교적 망가니즈 처리 효율이 높은 것으로 보고된 서냉 전로 제강슬래그(slowly-cooled BOF slag)를 사용하였다(MIRECO, 2013). 이에 따르면 다양한 유입수 Mn 농도인 2~45 mg/L에 대해 95% 이상의 망가니즈 제거 효율을 보였다.
Table 1.
Mn treatment data from bench- and pilot-scale systems including slag reactor (MIRECO, 2015; Kim et al., 2019)
벤치 규모 실내실험에서는 비교적 고농도인 평균 44 mg/L의 망가니즈를 3가지 슬래그반응조(제강슬래그 100%, 제강슬래그 40%+석회석 60%, 제강슬래그 40%+망가니즈코팅자갈 60%)에서 평가하였다(Kim et al., 2017b, 2018b). 제강슬래그만으로 구성된 슬래그반응조에서는 체류시간 1일 이내에 망가니즈를 제거하였다. 한편, 제강슬래그에 석회석 또는 망가니즈코팅자갈을 혼합한 슬래그반응조에서는 가동 200일 이내에서는 3~4일의 체류시간이 필요한 것으로 보였으나, 200일 이후에는 망가니즈 처리효율이 증가하여 약 1일의 체류시간에서 처리 가능한 것으로 나타났다(Kim et al., 2017b). 특히 200일 이내, 200~300일, 300일 이후로 시간이 경과하면서 유사 pH 조건에서 Mn 농도가 점차 감소하는 경향을 보였는데, 이는 흑색의 망가니즈 산화물(MnO2)이 반응조 내에 축적되면서 이에 따라 자가촉매산화(autocatalytic oxidation)와 흡착 효과를 발생시킨 결과로 평가되었다. 식 (2)는 가능한 중간산물(intermediate product)인 MnOOH, Mn3O4 등을 생략한 알짜반응식(overall reaction)으로서 생성물인 MnO2가 산화촉매로 활용되는 기작을 나타내었다. 또한, 망가니즈 산화물인 버네사이트(birnessite, δ-MnO2)은 영전하점(point of zero charge, PZC)이 1.5~2.8로 아주 낮아 망가니즈 등 양이온 흡착에 유리하다(Smith, 1999).
한편, 앞서 언급한 바와 같이 4.5~24.4 mg/L의 철 유입시 제강슬래그로만 구성된 슬래그 반응조와 망가니즈코팅자갈이 포함된 슬래그 반응조는 각각 2.7~12.4 mg/L, 1.2~29.0 mg/L의 유출수 Mn 농도를 보였으나, 석회석이 포함된 슬래그 반응조는 3 mg/L 이내로 지속적으로 망가니즈를 제거하였다(Kim et al., 2017b, 2018b).
체류시간
다덕광산의 경우 석회석과 제강슬래그가 1:1로 혼합된 슬래그반응조는 유입수에 포함된 평균 2.2 mg/L의 망가니즈를 평균 0.1 mg/L로 저감하였다. 유입수의 농도가 낮아 약 3시간 체류시에도 유출수 Mn 농도를 1 mg/L 이하로 저감시켰다(MIRECO, 2019). 달성광산에서는 Table 1의 광산 중 유일하게 제강슬래그로만 구성된 슬래그반응조를 비교적 초기인 2012~2015년에 적용하였다(MIRECO, 2015). 유입수의 평균 Mn 농도는 45 mg/L로 비교적 높았으며, 이에 따라 체류시간을 20시간 이상으로 설정한 경우에 pH가 9 이상으로 상승하면서 망가니즈를 95% 이상 제거하여 배출허용기준(청정지역, 2 mg/L)을 만족하였다.
일월탄광에서는 석회석과 제강슬래그가 1:1로 혼합된 슬래그반응조를 적용하여 최대 17.1 mg/L의 유입수 내 망가니즈를 체류시간 5시간 이상에서 배출허용기준(2 mg/L) 이하로 지속적으로 처리하였다(MIRECO, 2016). 해당 파일럿 시설은 총 4년간 운영되었으며 이중 동절기 및 보수공사 등의 운영 중지기간을 제외하고 순 359일간 처리하였다. 한편, 신동탄광에서는 유입수 평균 8 mg/L의 망가니즈를 98%의 효율로 처리하였으며, 최대 13 mg/L를 체류시간 8시간에서 배출허용기준 이내로 처리하였다. 또한 태화탄광에서는 4 mg/L로 유입된 망가니즈를 99%의 효율로 처리하였다. 추가로, 태우탄광 갱내수에서 최대 6 mg/L로 유입된 망가니즈를 실내 슬래그반응기(제강슬래그:석회석=4:6) 컬럼 실험에서 2시간 체류시 배출허용기준 이내로 저감시킨 중간 연구 결과가 보고되었다(MIRECO, 2020).
해당 실험들 중 체류시간이 체계적으로 보고되고 원수 Mn 농도가 배출허용기준을 4 mg/L 이상으로 유의하게 초과하는 경우인 일월탄광, 달성광산, 태우탄광(실내실험), 신동탄광, 그리고 벤치규모 실내실험을 대상으로, 슬래그반응조 유입수의 Mn 농도와 필요 체류시간의 관계를 Fig. 1에 도시하였다. 결정계수(R2) 0.937을 갖는 식 (3)의 선형 비례관계가 추정되었다.
t : 필요체류시간(hr),
CMn : 망가니즈 농도(mg/L)
본 상관관계의 추이는 추후 유입수 Mn 농도에 따른 슬래그반응조의 필요 체류시간 추정 시 참고하되 더 많은 광산에서의 결과를 기반으로 강화될 필요가 있다.
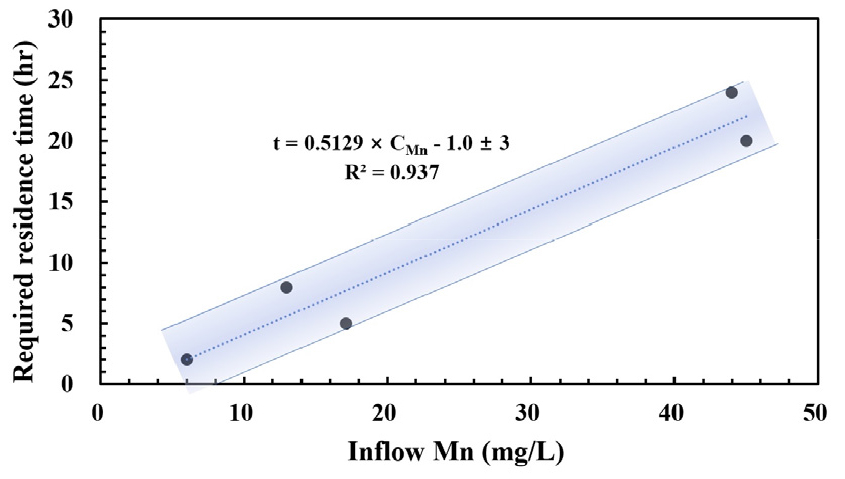
Fig. 1.
Relationship between the required residence time and the Mn concentration of inflow for pilot-scale slag reactors of the Dalseong, Ilwol, and Sindong mines and bench-scale slag reactors (MIRECO, 2015, 2016, 2020; Kim et al., 2017b, 2018b, 2019).
운영 초기의 pH 안정화
제강슬래그 등 고알칼리 매질을 자연정화시설에 적용시, 특히 운영 초기에 pH가 배출허용기준인 8.6을 초과한다. 이때 CaO의 활발한 용출이 발생하나 일정 기간 후 제강슬래그 표면의 CaO가 감소하며 침전물로 피복되어 pH가 감소하는데 이를 안정화 기간이라 할 수 있다. 안정화 기간은 유입수의 산도와 침전물 발생 속도, 슬래그반응조 내 제강슬래그와의 접촉시간(contact time) 등에 의해 달라진다. 예를 들어, 제강슬래그만으로 구성된 슬래그반응조의 경우 실내실험 및 달성광산 파일럿 실험에서 체류시간을 약 1일로 운영하는 경우 약 1년이 지나도록 pH가 9.5 이상으로 높은 값을 보였으나, 실내실험에서 석회석 또는 망가니즈코팅자갈을 혼합한 슬래그반응조에서 1~6개월이 지나며 안정화되는 양상을 보였다(Kim et al., 2017b). 태우탄광 실내 컬럼실험의 경우 유입 1개월 후에 Fe 4 mg/L를 1주간 유입시켰더니 침전물 형성에 의해 pH 8.6 미만으로 안정화된 결과가 나타나기도 하였는데(MIRECO, 2020), 안정화 기간이 짧은 이유는 체류시간이 약 2시간으로 짧아 제강슬래그에 의한 pH 상승폭이 작기 때문인 것으로 판단된다.
pH 재강하를 위한 소택지
한편, 슬래그반응조에서 배출허용기준을 초과하는 pH를 자연적으로 감소시키기 위해 파일럿 시설 후단에 호기성 소택지가 설치, 운영되었다. 호기성 소택지에서는 수층과 기질물질(폐상퇴비)에서 유기물 및 미생물 활동으로 이산화탄소 부분압이 상승하며, 탄산칼슘이 침전되고, 유기산이 용출되는 등의 기작으로 pH가 감소할 수 있다(Mayes et al., 2009a, 2009b). 달성광산의 경우 슬래그반응조 유출수에서 9.3~10.5이었던 pH가 소택지에서 7.3 이하로 저감되었는데, 소택지 체류시간은 15시간 이상이었다(MIRECO, 2015). 일월탄광의 경우 체류시간 약 12시간 이상에서 pH를 배출허용기준 이하로 저감시켰으며, 신동탄광의 경우에는 체류시간 8시간 이상에서 유입수 pH 10~12를 8.6 미만으로 낮추었다. 이에 따르면 슬래그반응조 후단에서 pH 저감을 위한 소택지의 체류시간은 8~12시간 가량이 필요한 것으로 추정된다.
망가니즈 공침 및 흡착 예측기술
Active 처리시설에서 철과 알루미늄에 의한 망가니즈의 공침 및 흡착은 서론에서 언급한 연구들에서 평가되었으나, 파일럿 규모 이상의 다양한 시설들을 종합한 평가 결과는 제한적이었다. Kim et al.(2018a)에서 다수의 파일럿 및 실규모 실험 결과를 종합한 공침 및 흡착 관계식을 일반화하고자 하였으며, 본 연구에서 대표적인 파일럿 실험 사례들을 평가하였다. 고농도 철에 의한 망가니즈 공침의 사례로 대덕탄광 갱내수를 처리한 결과가 있다(MIRECO, 2015; Kim et al., 2018a). 갱내수 내 철(997 mg/L) 및 알루미늄(210 mg/L)에 의해서 망가니즈는 11.1 mg/L로부터 pH 조정조 유출수의 pH 7.58 조건에서 1.2 mg/L로 저감되었다(Table 2). 이때의 (Fe+Al)/Mn 몰비는 126.9의 높은 값을 보였다. 국내에서 고농도 알루미늄이 발생하는 곳으로는 삼탄 폐석장 침출수가 있는데, 침출수 내 알루미늄(251 mg/L) 및 철(15.7 mg/L)에 의해 망가니즈는 37.0 mg/L로부터 pH 8.21에서 1.07 mg/L로 저감되었다(MIRECO, 2014; Kim et al., 2018a). 이때의 (Fe+Al)/Mn 몰비는 14.2였다(Table 2). 한편, 철 및 알루미늄이 상호 유사한 몰농도(2.2~2.3 mM)로 존재하는 경우는 (석봉)성봉 탄광 갱내수로서, 철 및 알루미늄이 각각 126 mg/L 및 59.6 mg/L로 존재한다. 파일럿 시설의 pH 조정조 직후인 응집조 유출수에서 pH 8.9인 경우 망가니즈 농도가 1.0 mg/L로 저감되었으며, 침전조를 거친 방류수에서는 pH가 8.7으로 다소 저감되었으나 배출허용기준(8.6)은 초과하였다(MIRECO, 2014; Kim et al., 2018a). (Fe+Al)/Mn 몰비는 12.5의 값을 보였다(Table 2).
Table 2.
Metal concentrations according to pH increase at pH adjustment tanks (Daedeok, Samtan) or a flocculation tank after a pH adjustment tank (Seokbong) in pilot-scale facilities of the three mines (MIRECO, 2014, 2015; Kim et al., 2018a)
망가니즈의 공침 및 흡착 효과 비교
삼탄의 경우 pH 5.26에서 Al 농도가 3.1 mg/L로 247.9 mg/L만큼 저감되고 Fe 농도가 15.7 mg/L만큼 저감되는 동안 Mn 농도는 25.4 mg/L로서 11.6 mg/L만큼 저감되었다. 그러나, 대덕탄광의 pH 5.73 조건에서 Fe 농도가 199 mg/L로 798 mg/L만큼 저감되고 Al 농도도 210 mg/L가 저감되었음에도 불구하고 Mn 농도는 9.6 mg/L로서 1.5 mg/L만 저감되었다. 이는 공침에 의한 망가니즈의 저감 효과가 기대보다 낮다는 것을 보여준다. 망가니즈의 제거 기작은 Fig. 2와 같이 pH에 따른 분포를 보인다. 약 6~8 이하의 pH에서는 알루미늄과 철이 침전되는 과정이므로 이때 공침이 발생할 수 있다. 한편, 망가니즈는 pH 6~8 이상에서 rhodochrosite(MnCO3)와 같은 탄산염 및 manganite(MnOOH), hausmannite(Mn3O4), pyrolusite(MnO2) 등의 (수)산화물으로 포화되어 석출된다. 철 수산화물 등에 의한 망가니즈 흡착의 경우 모든 pH 범위에서 발생 가능하나, PHREEQC 모델링 결과 Fe:Mn=4:1일 때 pH 5에서는 1% 미만이 흡착되며 pH 10에서 20%가 흡착된다는 결과가 보고되었으며(Rose et al., 2003), pH 6.5~7.5부터 흡착 효과가 발생한다는 연구 결과도 보고되었다(Kinniburgh and Jackson, 1981). 따라서, 공침 및 낮은 pH에서의 흡착의 경우 대덕탄광에서 나타난 바와 같이 그 효과가 낮은 것으로 보인다. 그렇다면 대덕 및 (석봉)성봉 탄광에서 망가니즈가 (수)산화물 석출 외에 추가로 제거된 기작은 부유물질(SS, suspended solids) 농도 기준으로 1350~3194 mg/L에 달하는 철 및 알루미늄 수산화물이 높은 pH에서 흡착한 영향이 클 것으로 추정된다(Table 2).
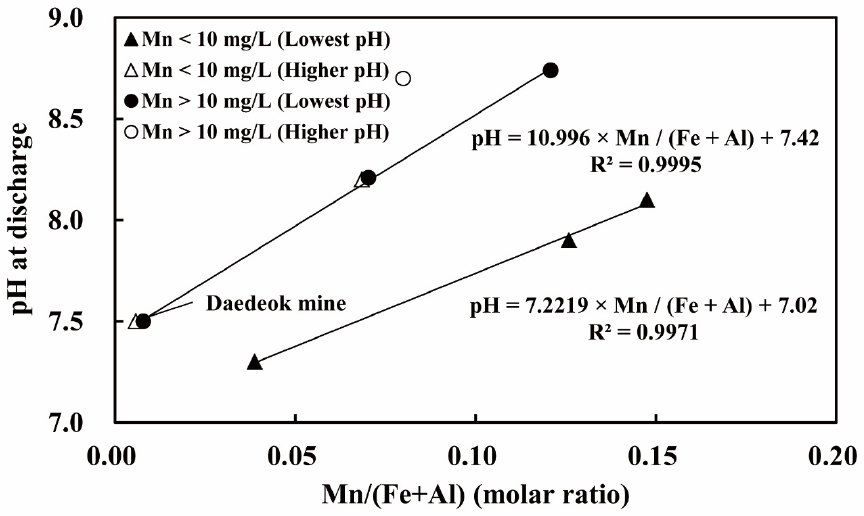
Fig. 3.
Relationship between the molar ratio of Mn/(Fe+Al) at inflow and the pH at discharge from the data of chemical treatment facilities (Kim et al., 2018a) using data from Ackman (2000), Zinck and Griffith (2013), Kim et al. (2014), and MIRECO (2014).
철 및 알루미늄 농도에 따른 망가니즈 처리 pH
철 및 알루미늄 수산화물에 의한 공침 및 흡착 효과에 따라 망가니즈가 제거되는 pH는 낮아지는데, Kim et al.(2018a)은 해당 pH를 다수 파일럿 및 실규모 시설의 Mn 및 (Fe+Al)의 농도비로부터 추정하였다(Fig. 3). 이에 따르면 Mn 농도가 10 mg/L 이상인 경우 Fe+Al 농도가 Mn 농도의 10배 이상, 그리고 Mn 농도가 10 mg/L 미만인 경우 해당 농도비가 5배 이상이면 최종 방류수의 pH가 8.6 이하일 때에 망가니즈를 배출허용기준 이내로 저감하는 것이 가능하다. 단, 해당 관계식은 여러 사례 중 pH가 가장 낮았던 최소 조건(Fig. 3에서 lowest pH를 뜻하는 흑색 심볼)이므로 실제로는 해당 조건보다 높은 pH가 필요한 경우(Fig. 3에서 higher pH를 뜻하는 백색 심볼; 예, (석봉)성봉탄광)가 있을 수 있다.
결 론
망가니즈를 자연정화하는 슬래그반응조의 설계에서는 다음의 사항들을 고려하여야 한다. 슬래그반응조 유입수에 철이 포함되지 않도록 전처리하여야 하며, 철이 유입될 경우에 대비하여 석회석을 혼합하여 매질을 구성하는 것을 권장한다. 한편, 슬래그반응조에 축적되는 망가니즈 산화물에 의한 자가촉매산화 및 흡착 반응은 망가니즈의 제거 효과를 기간 경과에 따라 오히려 증가시킬 수도 있다. 이는 슬래그반응조의 설계수명 예측시 고려할 사항이다. 슬래그반응조의 주요 설계 인자인 체류시간과 Mn 농도의 상관관계를 평가한 결과, Mn 농도(mg/L)의 약 50%에 해당하는 체류시간(hr)이 일반적으로 추정되었으며, pH 재조정을 위한 슬래그반응조 후단 소택지의 체류시간은 일반적으로 8~12시간이 필요할 것으로 추정된다. 또한, 투수계수를 고려하여 필요 수위차를 산출한 결과에 따라 스톱 로그의 운영 계획을 반영한 정화시설을 설계해야 한다.
망가니즈의 active 처리시설에서 철 및 알루미늄에 의한 망가니즈의 공침, 흡착 효과에 따라 다음과 같이 처리 pH가 낮아질 수 있다. Mn 농도가 10 mg/L 이상인 경우 몰비 기준으로 Fe+Al 농도가 Mn 농도의 10배 이상, 그리고 Mn 농도가 10 mg/L 미만인 경우 해당 농도비가 5배 이상이면 최종 방류수 pH가 8.6 이하일 때에 망가니즈를 배출허용기준 미만으로 처리하는 것이 가능하며, 해당 조건은 최소조건이므로 보다 높은 농도비가 필요할 수 있다. 이러한 경우 pH 재조정을 위한 시설 또는 알루미늄 재용출 억제를 위한 다단중화공정의 설계 반영이 일반적으로 불필요하다. 철 및 알루미늄 수산화물에 의해 망가니즈가 공침 및 흡착되는 효과 중에서는 높은 pH에서 흡착에 의한 제거 효과가 클 것으로 보이며, 이는 망가니즈 화합물의 석출과 병행된다.