서 론
연구 방법
현장 조사 및 시료 채취
실내 중화 실험
수질 측정 및 분석 방법
지구화학 모델링
연구 결과
Fe, Al, Mn 성분의 침전 pH
과산화수소 투입에 따른 산화환원전위(Eh) 변화
소석회 투입에 따른 2차 광물 석출
침전광물 구성 비율 추정
결 론
서 론
광산지역에서 발생하는 대표적인 환경문제가 산성광산배수 유출로 인한 수질 오염현상이다(Kim et al., 2013; Park et al., 2019). 일반적으로 광산배수의 유량이 크고 오염도가 높은 경우 보통 약품과 인력을 투입하여 수처리를 하고 소량인 경우 자연정화방식으로 수질 개선을 하고 있다(Hedin and Nairn, 1990; Hedin et al., 1994; Cheong et al., 2019). 그러나 전라북도 완주에 소재한 대덕탄광의 광산배수는 유량이 작지만 자연정화 방식 대신 중화 약품을 도입하여 수처리를 해오고 있다(Kim, 2021).
MIRECO(2015)에 따르면 대덕 탄광의 광산배수 유량은 10.8~58.7 m3/d 로서 평균값은 18.2 m3/d으로 적은 수량이다. 그러나 수질은 pH 2.95~3.68로 산성수이며 Al 172~468 mg/L, Fe 664~2014 mg/L, Mn 11~21 mg/L 농도 수준으로 특히 Fe 성분의 농도가 높다. 수처리 방식을 결정하기 위한 사전 연구에서 자연정화방식을 평가했으나 가용부지를 초과하였다. 대신 중화 약품을 비교 실험하고 소석회가 가성소다 대비 슬러지 농축율이 높아서 소석회를 선정하고 산화중화조-완속교반조-장방형 침전조 공정을 도출하였다. 공기 산화법은 산성수인 현장 수질에 산화효율이 낮아 5% 과산화수소(H2O2)를 선정했고 중화제는 20% 액상 소석회로 결정했다. 무인 처리 시스템으로 설계되고 2020년 1월부터 운전을 시작하였다. 운전 결과 슬러지가 다량 발생하고 장비에 스케일이 형성되어 이들이 시설 관리에 현안이 되고 있다(Cheong et al., 2022).
대덕탄광처럼 과산화수소-소석회 처리공정을 채택한 사례로 Wildwood(H2O2-침전조), Lancashire(H2O2-고밀도 슬러지 공정), Brandy Camp(H2O2-소석회-침전조), Cresson(CO2 탈기-H2O2-소석회) 처리시설 등이 확인되고 있다(Smoyer, 2013; USPADEP, 2019). 중화공정 이전에 과산화수소 주입 공정을 배치하여 2가철을 산화시키려는 의도가 보인다(식 1, 2). Fe 성분을 방류수 수질 기준인 2 mg/L 이하로 제거할 경우 3가철이면 pH 4~5에서 가능하나, 2가철이면 pH 8에서 가능하므로 중화제를 사용해야 한다(Sengupta, 1993). 산성수에서 2가철은 폭기보다 과산화수소 등 산화제가 효과적이다(Leavitt, 2010; Evans et al., 2020). 중화제로 소석회를 사용하면 슬러지가 많이 발생하여 관리 및 처분 비용을 초래할 수 있다(Miller et al., 2007; Cheong et al., 2019). 과산화수소를 사용하여 철을 산화시키면 pH 증가 없이 철을 제거함으로 소석회 사용량과 미사용 소석회을 감소할 수 있다는 관점에서 Smoyer(2013)는 슬러지 감소 방안으로 제안한 바 있다. Leavitt(2010)는 pH 5~6 범위의 탄광 광산배수에 35% 과산화수소수를 주입하여 투입량에 따른 용존산소 증가, pH 감소, Eh 값 증가를 관측하고 2가철의 산화 완료 시점을 판별하는 방법을 제시하였다. MIRECO(2015) 연구에서는 NaOH 용액으로 중화하면서 1.5% 과산화수소를 적용하여 2가철의 산화효과 및 주입속도 등을 평가한 바 있다. 앞서 언급했듯이 고농도 및 저농도 과산화수소 투입에 따른 광산배수 수질에 미치는 영향 평가는 보고된 바 있으나 대덕탄광 수질에 대한 5% 과산화수소 첨가에 따른 수처리 영향은 보고되지 않고 있다.
슬러지는 수질 특성과 처리 방법에 따라서 영향을 받으나 대개는 Fe, Al, Mn 등 금속(Me2+) 수산화물(Me(OH)2)과 황산염 광물, 탄산염 광물들로 구성된다(식 3). 특별히 황산염 성분이 높은 경우 소석회를 사용하면 석고가 생성된다(식 4). SO4의 평형 농도가 1500~2000 mg/L 정도이므로(Tolonen et al., 2014; Nurmensniemi, 2018; Park et al., 2019; USPADEP, 2019) 본 연구지역처럼 SO4 농도가 5000 mg/L 이상인 경우 저감 농도가 약 3000 mg/L 예상되므로 이에 상응해서 석고가 다량 발생할 것이다. 실제로 MIRECO(2015) 연구에서도 석고 발생으로 SS가 약 1.3배 증가한 것을 기록하고 있다. 이외에도 소석회를 중화제로 사용할 경우 미사용된 소석회가 슬러지 내로 유입될 수 있다(Miller et al., 2007, Chen et al., 2009; Zinck and Griffith, 2013; Aubé and Lee, 2015; USPDEP, 2019). 국내 소석회를 사용하는 일부 시설에서도 침전조내 슬러지에서 소석회가 관찰되기도 한다.
지구화학 모델링 프로그램은 화학체계에서 열역학적 평형에 도달했을 때 고체, 액체상과 관련된 화학과정을 계산할 수 있어서 다양한 분야에서 활용되고 있다(Bethke, 2008; Ryu et al., 2010; Choi et al., 2022). 광산배수 처리 분야에 있어서도 지구화학 반응을 모사하는 연구사례들이 보고되고 있다. Gasparon et al.(2007)은 광산배수와 소석회 반응을 모델링하여 소석회 소모, pH 등 수질 변화 및 광물 생성량을 도출한 바 있고 Nordstrom(2020) 및 Cravotta(2021)는 적정 모델(titration simulation)을 통해서 중화과정에 따른 화학성분의 변화를 모사한 바 있다. 지구화학 모델링을 통해 중화 과정에 따른 침전물에 대한 물질 수지를 계산하면 pH 단계별로 어떤 침전 광물이 많이 발생하는지의 평가가 가능하여 운전 개선이나 시스템 변경에 중요 자료로 활용할 수 있을 것이다.
대덕탄광 수처리시설은 운전이 시작되고 나서 규모에 비해서 다량의 슬러지가 발생하고 침전조 구조물, 유량계 및 pH 센서 등에 석고 스케일이 생겨 시설물 관리의 현안이 되었다. 본 연구에서는 대덕탄광 광산배수를 대상으로 1) pH 증가에 따른 금속 농도 변화 및 침전물 발생량 측정, 2) 5% 과산화수소에 의한 Eh 값 변화와 Fe 및 Mn 종의 안정 영역 3) 소석회 사용에 따른 석고 침전 환경평가 4) 총 침전물에서 금속 침전물 및 석고 비율 도출 등을 수행하였다.
연구 방법
현장 조사 및 시료 채취
연구지역은 전북 완주지역에 위치한 대덕탄광 광산배수 처리시설이다. 수처리 시설은 산화조-중화반응조-침전조로 구성된다. 산화제는 5% 과산화수소이고 중화제는 20% 액상 소석회이며 자동제어방식으로 주입된다. 침전조에 슬러지가 충만하면 펌프로 슬러지를 인발하여 별도의 용기에서 응집시킨 후 Geobag에서 탈수/건조시킨다.
현장 중화반응조에서 중화반응수를 50 mL씩 3개 채수하고 24시간 경과 후 침전한 슬러지의 건조 중량(105°C, g/L AMD)을 구했다. 침전조내 슬러지를 채취하여 XRD(X'Pert MPD, PHILIPS)로 광물 분석을 수행하였다.
실내 중화 실험
현장에서 원수를 채수하여 실내에서 중화실험(I, II) 실험수로 사용하였다(Table 1). 중화실험 I은 중화실험 II에 대한 control이었다. 광산배수(1 L)를 250 rpm 으로 교반하면서 20% 액상 소석회로 pH 4, 5.., pH 10까지 독립적으로 중화시켰다. 중화실험 II는 5% 과산화수소수를 (1.5 mL/L AMD) 먼저 원수에 넣고 교반 후 중화실험 I과 동일하게 수행했다. 과산화수소수 투입량은 2가철의 농도를 산화시키는데 필요한 양을 계산한 후 실험수에 투입하여 철 플럭이 형성되는 것을 확인하고 결정한 양이었다. 중화실험에서 목표 pH에 도달하면 Eh를 측정하고 철 플럭이 침전하면 수질분석용 상등수를 채수하였다. 24시간 경과 후 침전물을 회수하여 침전물의 건조 중량(g/L)을 측정하였다.
Table 1.
Results of the chemical analysis of raw mine water (Unit in mg/L, except pH)
| pH | Fe | Fe++ | Al | Mn | Ca | SO4 |
| 2.8 | 968 | 250 | 397 | 18.4 | 500 | 5850 |
수질 측정 및 분석 방법
pH 및 Eh 측정은 Orion 사(Star A215 pH meter) 기기로 수행하였다. 2가철은 Spectrophotometer(HACH DR2800TM)로 분석하였다. 수질분석용 시료는 0.45 µm 여과지로 여과하였다. 양이온 분석 시료에는 농질산을 투입하고 ICP-OES(Thermo Scientific ICS-6000, USA)로 Ca, Fe, Al 및 Mn 성분을 분석하였다. IC(Dionex ICS-6000, USA)로 SO4 성분을 분석하였다.
지구화학 모델링
본 연구에서는 Geochemist’s WorkbenchⓇ(GWB) 프로그램을 이용하여 아래의 내용을 수행하였다.
1) 대덕탄광 원수의 Fe 농도를 참고하여 최대 1000 mg/L 설정하고 Fe-pH-Eh 다이아그램에 작성했다. Mn의 농도는 40 mg/L로 설정하고 Mn-pH-Eh 다이아그램을 작성하였다. 중화실험 당시 측정한 pH 및 Eh 측정값을 Fe 및 Mn의 pH-Eh 다이아그램에 점시하였다. Al 성분은 산화작용과 무관하여 다이아그램은 작성하지 않았다.
2) Table 1의 Ca 및 SO4 농도를 초기 농도로 설정하고 pH-loga[Ca2+] 다이아그램을 작성하였다. 이때 원수 및 중화 pH 8에서 SO4 농도(활동도), 즉 loga[SO42-] = ‒1.848, ‒2.595 와 대기와 평형조건인 loga[CO2(aq)] = ‒3.5을 적용했고 수온은 25°C로 설정하였다.
3) Table 1의 원수 조성을 소석회(Ca(OH)2)로 적정(titration simulation)하고 침전광물의 물질수지를 도출하였다. 이때 Fe3+, Fe2+, Al3+, Mn2+, Ca2+는 Fe(OH)3, Fe(OH)2, Al(OH)3, Mn(OH)2, 석고, 방해석 등 침전광물과 화학 평형을 이루며 이때 대기와 평형(CO2‒3.5 atm)을 이루는 조건으로 설정했다.
연구 결과
Fe, Al, Mn 성분의 침전 pH
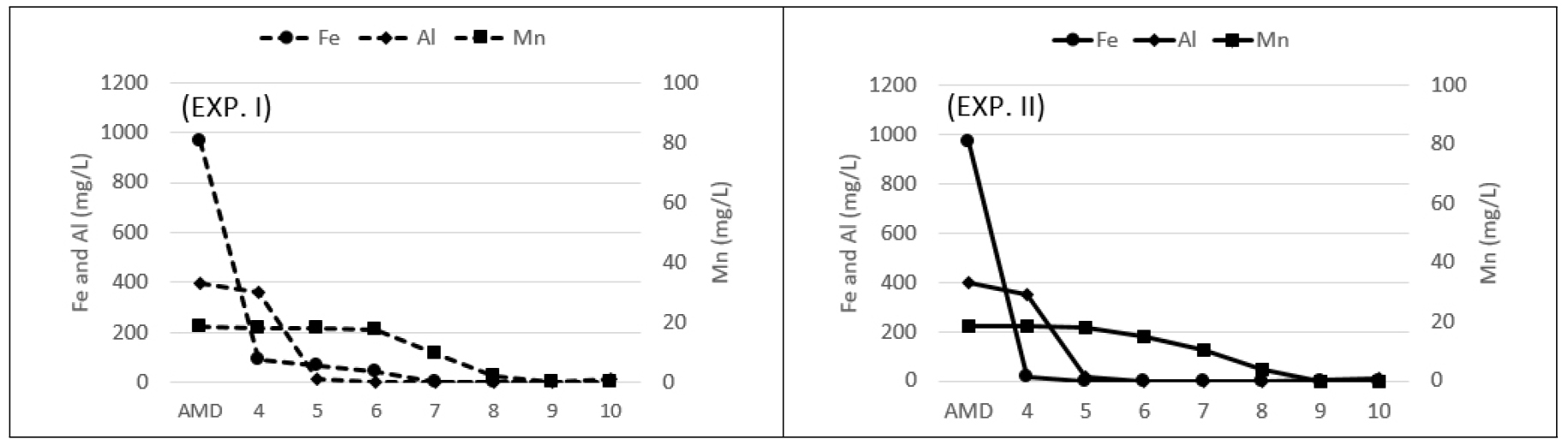
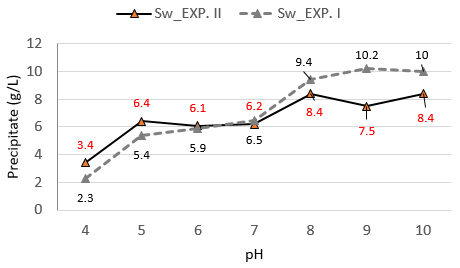
중화실험 결과를 Fig. 1에 수록하였다. 소석회만으로 원수를 중화시켰을 때(Fig. 1, EXP. I) Fe 성분의 농도는 pH 4까지 급격하게 감소하고 그 이후부터 pH 7까지 잔존하며 서서히 감소하였다. 과산화수소를 첨가하고 중화했을 때(Fig. 1, EXP. II) pH 5에서 Fe 성분은 <0.3 mg/L 수준으로 감소하였고 2가철이 3가철로 산화되어 나타난 결과였다(식 1). Al 성분은 산화작용과 무관하므로 실험 I, II에서 동일한 농도 변화를 보였다.
중화실험 I, II에서 Mn 성분은 pH 6부터 농도 변화가 시작하며 pH 8에 도달했을때 각각 2.0 및 3.8 mg/L로 감소하고 pH 9에서는 <0.1 mg/L로 나타났다. MIRECO(2015) 및 Kim et al.(2022)은 pH 9 이전에 제거되는 원인은 광산배수에서 (Fe+Al)/Mn 몰 비율이 높을 때 이들 Fe, Al 등의 공침 및 흡착 기작에 의한다고 밝혔다. Aguiar et al.(2010)는 추가로 자가 흡착에 의해서도 제거된다고 보고하였다. 본 중화 실험에서도 원수(Table 1)에서 Fe+Al 농도가 Mn의 10배가 넘고 Fe/Mn 몰 비가 큰 수질 특성이 확인된다. 본 연구에서 Mn이 pH 6부터 제거가 시작되고 9에서 목표 수준까지 제거되었던 원인으로 과산화수소수 Fe 및 Al의 수산화물의 흡착 및 공침 기작 등이 복합적으로 작용한 결과로 판단된다(Evans et al., 2020).
과산화수소 투입에 따른 산화환원전위(Eh) 변화
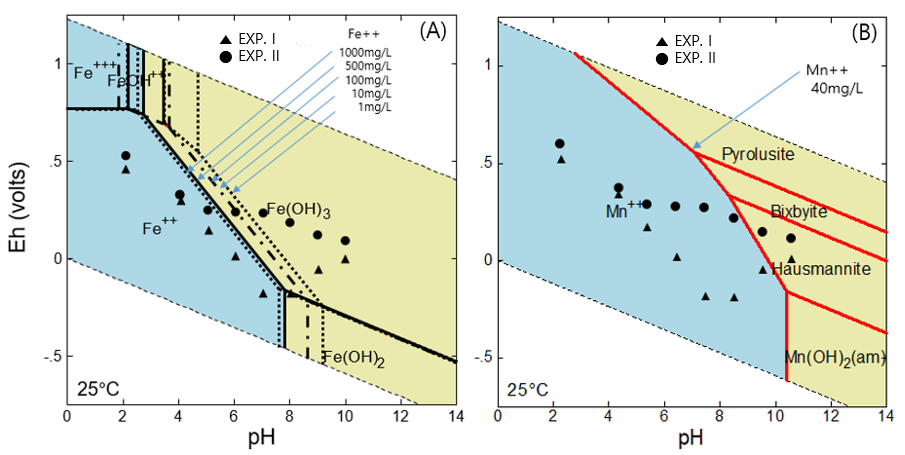
중화실험에서 측정한 pH 및 Eh 측정값을 pH-Eh 다이아그램에 점시하였다(Fig. 2). 다이아그램에서 Fe3+ 이온 종은 산성수이고 Eh 값이 높은 좁은 영역에 존재하는 반면 Fe2+ 이온 종은 중성 pH 범위까지 더 넓은 영역에서 용존한다. 중화실험 I에서 pH가 증가하면서 Eh 측정값은 감소하여 Fe 종은 용존 환경에 놓이다가 pH가 8 이상을 지나면서 고체인 Fe(OH)2 혹은 Fe(OH)3 영역에 위치하였다. 중화실험 I에서 Fe 성분이 pH 8 이후에 제거되는 결과를 설명해 준다(Fig. 1의 EXP. I).
그러나 중화실험 II에서는 Eh 측정 값이 pH 5 부터 pH 8까지 그대로 유지되면서 고상인 Fe(OH)3 영역에 점시되었고 결국 Fe가 제거되었다(Fig. 1, EXP. I). 다이아그램에서 5% 대신 30% 이상 고농도 과산화수소를 사용했다면 Eh 값이 본 측정값과 달리 Y 축 방향으로 증가해서 좀 더 낮은 pH에서 철의 제거를 기대할 수 있을 것 같다(Smoyer, 2013). 즉 과산화수소의 농도는 철의 침전 pH에 영향을 줄 것으로 기대된다. 한편 Fig. 2(A)에서 볼 수 있듯이 Fe 농도가 변하면 Fe-Fe(OH)3 경계 위치가 변함으로써 철의 농도도 침전 pH에 영향을 줄 수 있다.
pH-Eh 다이아그램상에서 용존 Mn2+ 종은 Fe2+ 종에 비하여 용존 영역이 넓으며 Mn 광물은 Fig. 2(B)에처럼 여러 종이 존재하는데 pH 9 이상에서 산화물로 침전했을 때 Mn3O4(Hausmannite) 혹은 manganite 등 광물을 예상할 수 있다(Aguiar et al., 2013).
이전의 연구처럼(Macingova and Luptakova, 2012) 과산화수소에 의한 산화 효과는 나타나지 않았다. 그러나 실제 중화실험에서 Mn 성분은 pH 6 부터 농도가 감소하기 시작하여 pH 9에 이르러 제거되어 앞서 언급했듯이 공침 및 흡착 기작에 기인한 것으로 이해되었다.
소석회 투입에 따른 2차 광물 석출
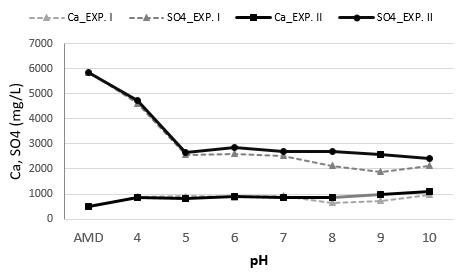
중화실험에 따른 Ca 및 SO4 농도 변화를 Fig. 3에 수록하였다. 중화실험 I 및 II에서 공통적으로 SO4 성분의 농도는 pH 5까지 급감했고 그 이후 서서히 감소했다(Fig. 3). Ca 및 SO4 성분의 농도 변화는 석고 생성과 관련이 있으므로 loga[Ca] - pH 다이아그램을 작성하였다(Fig. 4).
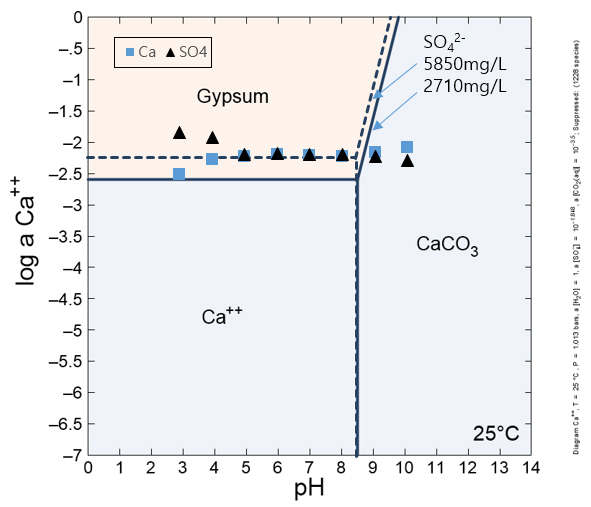
Fig. 4.
Log activity-pH diagram of calcium at 25°C using the GWB. Assumptions: log a[SO42‒] = ‒1.8 and ‒2.2, log a[CO2(aq)] = ‒3.5. The triangle and square symbols represent the projections of Ca and SO4 concentrations of EXP. II (shown in Fig. 3) onto this diagram.
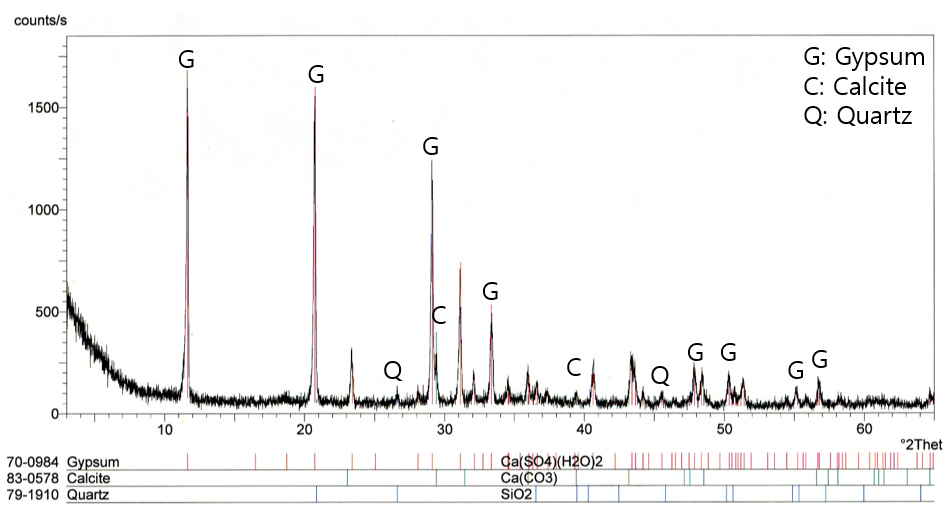
파선과 직선은 중화실험 II의 원수 및 pH 8에서 황산염의 활동도(activity)인 loga[SO42‒]= ‒1.8(5850 mg/L) 및 ‒2.2(2710 mg/L)을 나타낸다. Fig. 3의 Ca 및 SO4 농도를 본 다이아그램에 투영한 결과 수질은 석고에 포화된 것을 알 수 있다(Fig. 4). 석고는 pH와 무관하게 중화 초기부터 생성되는 것을 알 수 있고 Azizi et al.(2024)도 본 연구처럼 pH 2.9-9.5에서 석고가 석출하는 사례를 보고하였다. 한편 Ca 이온은 알칼리 환경에서 용존 이산화탄소와 반응하여 방해석을 생성하며 이 광물은 pH에 관계된다(Aubé and Lee, 2015; Hedin and Hedin, 2016). 본 loga[Ca]-pH 다이아그램에서 방해석이 pH 8.5부터 생성되는 것으로 나타났다. 현장 침전조 슬러지내에서 석고와 함께 방해석 광물이 함께 감정된다(식 5)(Fig. 5).
침전광물 구성 비율 추정
pH 별로 측정한 침전물 중량을 Fig. 6에 제시하였다. 중화실험 II의 경우 산화효과로 중화실험 I에 비해서 초기 pH에서 침전물 중량이 컸고 알칼리 영역에서는 반대로 나타났다. 중화실험 II의 침전물 중량은 pH <5(6.4 g/L), pH 7-8(1.9 g/L)으로 pH 구간별 중량 차이가 나타났다. pH 5까지 가장 많이 발생했고 pH 5부터 7 사이는 발생량이 거의 없었다. pH 5까지는 Fig. 1 및 Fig. 3에서처럼 Ca, Al, SO4 성분의 농도 감소 구간과 일치하여 Fe, Al 수산화물 그리고 석고 침전의 효과였다. pH 7 이후의 증가는 Mn 제거, 석고 및 방해석 침전에 의한 것이다.
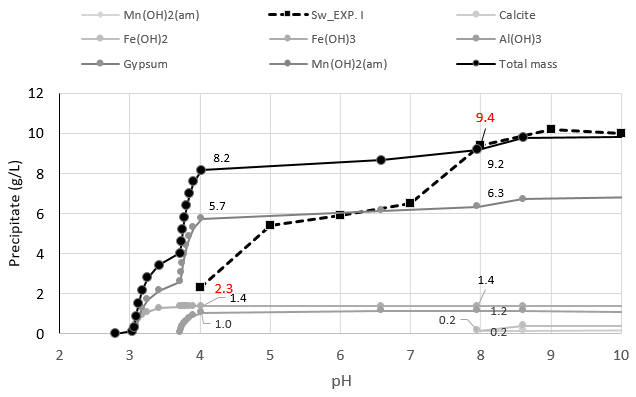
Fig. 7은 Table 1의 수질을 Ca(OH)2로 적정한 시뮬레이션 결과로서 개별 광물의 석출량을 pH 단계별로 표시한 것이다. 여기에 Fig. 6의 중화실험 I 침전물 중량을 추가하였다.
중화 실험 I, II의 경우 pH 8에서 침전물 중량이 각각 8.4 및 9.4 g/L로 나타났다. 연구방법에서 언급한 현장 중화반응조의 부유물질 중량은 평균 9 g/L_AMD(n=3)로 측정되었다. 적정 시뮬레이션은 9.2 g/L 였다. 시뮬레이션 결과가 중화실험 및 침전물과 현장의 슬러지 발생 환경을 구현한다고 판단된다.
중화실험 I을 기준했을 때 침전물 중량은 pH 4 및 pH 8에서 각각 2.3 g/L과 9.4 g/L 였다. 시뮬레이션은 8.2 g/L과 9.2 g/L 였다. pH 4에서 실험값과 시뮬레이션 값 차이가 5.9 g/L로 차이가 나타났다. 중화실험 pH 4에서 시뮬레이션 보다 침전물 중량이 작았던 이유는 침전해야 할 석고 중 일부만 침전하여 침전물이 적게 측정된 결과로 판단된다. Fe 및 Al 수산화물은 빠르게 침전하는 반면 석고 용해도는 금속 수산화물의 용해도 보다 약 10배 정도 커서 천천히 석출한다(Payette et al., 1991; Aube and Lee, 2015). 중화실험 당시 Fe, Al 수산화물은 1시간 이내에 대부분 바닥에 침전되나 석고는 상대적으로 서서히 석출되고 부유 혹은 침전했다. 그러나 pH 8에서는 상대적으로 중화 실험 시간이 오래 걸림으로 석고가 침전할 수 있는 시간이 확보되어 석고 침전이 더 많이 반영된 것으로 보인다. 현장의 침전조 앞단에는 철수산화물이 바닥부터 퇴적되고 석고는 침전조 상 하부 전역에서 관찰된다. 수산화물과 석고의 석출 및 침전 특성 차이에 기인하는 것으로 이해할 수 있다.
현장 중화반응조는 pH 8 전후로 운전된다. pH 8일 때 시뮬레이션 결과에 따르면 구성 침전광물은 석고 (6.3 g/L) > Fe(OH)3(1.4 g/L) > Al(OH)3(1.2 g/L) > 방해석(0.2 g/L) 등으로 예측되고 실제는 흡착된 Mn 등도 존재하고 있다. pH 8에서는 총 침전물에서 석고가 차지하는 비중은 물질 수지 계산상 약 70%에 해당된다. 석고 침전물이 슬러지에서 차지하는 비중이 크게 나타났고 이를 증명할 현장 연구 결과가 없어서 추후 연구 필요성도 있어 보인다. 그러나 석고가 슬러지 발생에 기여가 큰 것은 분명한 것으로 판단된다.
결 론
대덕탄광 광산배수는 산화-중화-침전 공정으로 semi-active 방식으로 수처리되고 있으나 슬러지 발생량이 커서 유지 관리의 대상이 되고 있다. 5% 과산화수소에 따른 산화 효과로 철 성분이 산성 pH에서 침전되고 Al 성분도 약산성 pH에서 제거된다. Mn의 경우는 과산화수소에 의한 산화효과는 없었고 Fe 및 Al 성분에 의한 흡착 및 공침으로 pH 9 이전에 제거되고 있다. 중화실험에 의한 각각의 pH에서 침전물의 중량에 따르면 ~pH 5(6.4 g/L)에서 침전물이 가장 많았다. pH 5-7 구간에서는 침전물이 거의 발생이 없다가 pH 7-8(1.9 g/L) 구간에서 추가로 생성되었다. pH 5에서 침전한 광물은 Fe(OH)3, Al(OH)3과 석고였고 후자는 pH 8 까지 생성되었다. 적정 시뮬레이션에 따르면 중화 pH 8에서 침전물 중량순은 석고, Fe(OH)3, Al(OH)3, 방해석 으로 나타났다. 대덕탄광 산화-중화-침전 공정에서 다량의 슬러지 발생 원인은 석고가 가장 큰 기여를 하는 것으로 판단되었다. 철 및 알루미늄 수산화물은 침전 속도가 빨라서 침전조 앞단서부터 퇴적되면서 그 부피가 증가한다. 그러나 석고는 상대적으로 석출 및 침전 속도가 늦어서 침전조 전역에서 지속적으로 생성되어 스케일을 유발하고 있다.