서 론
시료 특성 및 실험방법
시료 특성
염배소
수침출
결과 및 고찰
염배소 온도에 따른 시료 특성 변화
염배소 영향인자에 따른 바나듐 침출 거동 분석
수침출 영향인자에 따른 바나듐 침출 거동 분석
결 론
서 론
바나듐은 주기율표상 23번에 위치하는 금속으로서 다양한 산업 부문에서 사용되고 있다. 1900년대 초반 포드사의 ‘Model T’의 차축, 크랭크축, 기어 등의 부품에 바나듐이 사용되면서 바나듐을 함유한 철강의 대량 생산이 시작되었고, 2018년 현재 바나듐 수요의 93% 가량이 철강 생산에 사용되고 있다(Moskalyk and Alfantazi, 2003; Roskill, 2019). 또한 바나듐은 티타늄 합금에도 첨가되는데, 바나듐을 4% 함유한 TiAl6V4가 일반적으로 가장 많이 사용되는 티타늄 합금이며 고강도, 저밀도, 고내식성의 특성을 가지기 때문에 주로 항공기의 제트엔진, 치과재료 등으로 사용된다(Schiff et al., 2002; Leuders et al., 2013). 그 외에도 바나듐화합물은 유기화합물의 산화, 황산 제조 등의 공정에 촉매로서 중요한 역할을 한다(Langeslay et al., 2019). 근래에 들어서는 신재생 에너지 기술의 발달과 함께 대용량 에너지 저장장치에 사용되는 바나듐레독스흐름전지(vanadium redox flow battery, VRFB)에의 응용이 각광받고 있는데, 바나듐의 2가부터 5가까지의 다양한 산화수가 이와 같은 전지의 개발을 가능하게 한다(Lourenssen et al., 2019).
자연계에서 바나듐은 광물의 주성분으로는 잘 발견되지 않고 주성분원소의 일부를 치환하는 미량(trace) 성분으로 주로 나타난다. 특히, 철광석 중 자철석(magnetite, Fe3O4), 티탄철석(ilmenite, FeTiO3), 크롬철석(chromite, FeCr2O4) 등의 Fe3+ 자리에 V3+가 치환된 형태로 주로 나타나는데(Gilligan and Nikoloski, 2020), 이 중 자철석과 티탄철석으로 주로 이루어진 함바나듐 광석을 함바나듐 티탄철광(vanadium-bearing titaniferous magnetite) 이라고 하며 간단히 줄여서 VTM으로 부른다. 이와 같은 철광석에 함유된 바나듐은 V2O5로써 0.1-1.0% 가량 함유되어 있는 것으로 알려져 있으며, 일부 광상에서는 2.0%까지도 보고되고 있다(Hukkanen and Walden, 1985; Jena et al., 1995; Chen et al., 2013; Zhao et al., 2014; Parirenyatwa et al., 2016; Zhang et al., 2017; Li et al., 2018; Zhang et al., 2018). 또한, stone coal에도 바나듐이 0.13-1.2% 가량 함유되어 있는 것으로 보고되고 있으며, 이와 같은 바나듐 자원은 주로 중국에 매장되어 있어 중국에서는 현재 stone coal 유래 바나듐 회수 및 연구가 활발히 진행되고 있다(Chen et al., 2010; Zhang et al., 2011; Cai et al., 2013; Zhang et al., 2013; Zhao et al., 2018; Zheng et al., 2019).
VTM을 포함한 함바나듐 철광석의 경우, 주로 고온 염배소-침출법을 통해 광석에 함유된 바나듐을 회수한다. 주로 NaCl, Na2CO3, Na2SO4 등의 Na계 염이 상용적으로 사용되고 있으며, 염배소 공정을 통해 광석 중 함철광물에 함유되어 있는 3가의 바나듐은 염의 종류에 따라 각각 식 (1), (2), (3)과 같은 반응을 통해 광물의 격자 구조에서 빠져 나오면서 5가의 바나듐 화합물로 전환된다(Hukkanen and Walden, 1985; Gilligan and Nikoloski, 2020). 이 때, 자철석의 경우 적철석(hematite, Fe2O3) 으로의 산화도 함께 발생하며, 염에 함유된 Cl, CO3, SO4 등의 음이온기는 염소, 이산화탄소, 이산화황 등의 가스 형태로 배출된다.
Na계 염배소로 생성된 NaVO3 화합물은 물에서 용해도가 높기 때문에, 간단한 수침출을 통해 바나듐을 회수할 수 있다. 이 때, 염배소 공정의 투입물질로는 VTM 광석 또는 정광이 직접 사용될 수도 있고, 용융 공정을 통해 철을 우선적으로 회수하고 부산물로서 얻어진 바나듐이 농축된 슬래그가 사용될 수도 있다. 슬래그 중 바나듐 함량은 대체로 15% 수준으로 나타나며, 적게는 5% 이하로도 나타나는 것으로 보고되고 있다(Jena et al., 1995; Wang et al., 2018; Wen et al., 2019; Zhang et al., 2019; Wang et al., 2020).
본 연구에서는 국내산 VTM 정광으로부터 바나듐을 회수하기 위한 염배소-수침출 연구를 수행하였다. 연구에 사용된 VTM 광석의 경우 원광에 바나듐이 V2O5로써 약 0.6% 함유되어 있는 것으로 나타나 현재 상용적으로 생산이 진행되고 있는 바나듐 광산과 견줄만한 수치인 것으로 파악되었다. 따라서 자력선별 공정을 통해 제조된 정광을 출발 물질로 사용하여 바나듐 회수 가능성을 알아보고자 소다회(Na2CO3)를 사용한 염배소 및 수침출 연구를 수행하였으며, 최대 바나듐 침출율을 달성하기 위한 최적 염배소-수침출 조건을 도출하고자 하였다.
시료 특성 및 실험방법
시료 특성
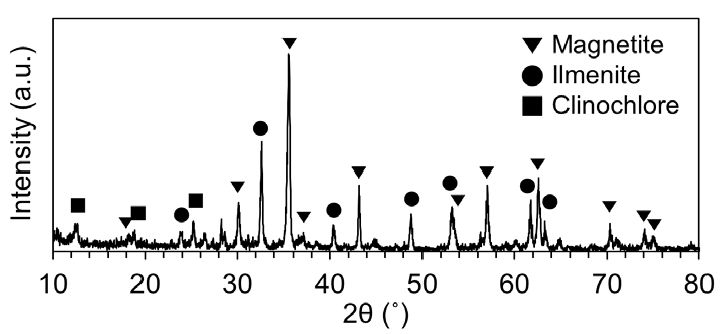
본 연구에 사용된 광석은 함바나듐 티탄철광으로서 Fig. 1과 같이 주요 광물로 자철석 과 티탄철석을 함유하고 있는 것으로 분석되었다. 독립된 바나듐 광물은 발견되지 않았고, 일부 맥석 광물이 검출되었다. 염배소-수침출 연구에는 해당 광석의 자력선별 정광이 사용되었으며, 정광 내 원소별 함량은 Table 1과 같다. 정광에는 Fe와 Ti가 각각 FeO, TiO2로써 57.0%, 14.5% 함유되어 있고, V 함량은 V2O5로써 0.8%(V 0.44%) 로 분석되었다. 그 외 맥석 광물 성분으로 Si, Al, Mg, Ca 등이 각각의 산화물로써 6% 미만으로 함유되어 있는 것으로 나타났다.
Table 1.
Chemical composition of the VTM concentrate
| Element | TiO2 | FeO | SiO2 | Al2O3 | CaO | MgO | MnO | V2O5 |
| Concentration (%) | 14.5 | 57.0 | 5.8 | 4.1 | 1.0 | 3.7 | 0.3 | 0.8 |
또한, 체 분석(sieve analysis)을 통해 정광의 입도를 파악하였다. 정광의 입도 분포는 Fig. 2와 같이 나타났으며, P80 입도가 약 200 µm로 입도가 비교적 큰 것으로 분석되었다.
염배소
정광에 함유된 바나듐을 침출이 용이한 형태로 전환하기 위하여 정광에 대하여 염배소를 실시하였다. 시료와 Na2CO3를 알루미나 도가니에 장입한 후 박스형 전기로를 이용하여 850-1,100°C에서 공기를 2 L/min으로 주입하며 0.5-3시간동안 배소하였다. Na2CO3는 시료량에 대하여 10-30 wt%로 첨가하여 그 영향을 분석하였다. 염배소 후 회수된 시료는 막자사발로 해쇄(disintegration) 또는 vibrating cup mill 로 재분쇄 후 수침출하였다.
수침출
염배소 시료로부터 바나듐을 회수하기 위하여 수침출을 수행하였다. 수침출에는 이중자켓 반응기를 사용하였으며, 항온수조를 사용하여 침출 반응의 온도를 조절하였다. 또한, 응축기를 장착하여 증발을 통한 침출액의 손실을 방지하고자 하였다. 수침출은 광액 농도 50 g/L(e.g. 시료 5 g + 증류수 100 mL), 침출 시간 1-3시간, 온도 25-80°C, 교반속도 400 rpm 등의 조건 하에서 수행되었다. 일정한 시간 간격으로 침출액을 샘플링하여 침출액 내 바나듐 농도를 ICP-OES(Perkin Elmer, Optima 8300 ICP-OES)를 사용하여 측정하였으며, 바나듐 침출율은 식 (4)를 이용하여 계산하였다(: 시간 t에서의 침출액 내 V 농도(mg/L), : 침출액 총 부피(L), : 침출 잔사 내 V 농도(mg/g), : 침출 잔사의 양(g), : 최종 침출액 내 V 농도(mg/L)).
결과 및 고찰
염배소 온도에 따른 시료 특성 변화
VTM 정광에 대한 염배소 및 수침출 최적 조건을 탐색하기에 앞서 염배소 시료에 대한 특성 변화 분석을 실시하였다. Fig. 3은 XRD 분석을 통한 염배소 온도에 따른 시료의 광물상 변화를 나타낸다. 850°C 이상에서 염배소를 실시함에 따라 정광에 함유되어있던 티탄철석은 완전히 분해되어 배소 산물에서는 검출되지 않았다. 자철석 또한 검출되지 않았으나 배소 산물에서 Magnesioferrite로 표시되는 광물이 자철석일 가능성을 배제할 수 없다.
배소 산물에서 새롭게 나타나는 광물상을 살펴보면, 적철석, Magnesioferrite(또는 자철석), Na0.75Fe0.75Ti0.25O2, NaFeTiO4, Na1.86Al0.38PO4 등이 있다. 적철석의 경우 배소 온도가 증가함에 따라 피크(peak) 가 꾸준히 증가함을 알 수 있으며, 이는 자철석의 적철석으로의 산화가 잘 일어나고 있음을 의미한다. 바나듐 광물 또는 화합물의 존재 여부를 XRD 분석을 통해서 파악할 수 없으나, 적철석으로의 산화가 일어난 점으로 미루어 볼 때, 자철석 내 치환되어 존재하는 바나듐의 산화 및 격자 외부로의 배출이 일어났음을 추정할 수 있다. Magnesioferrite의 피크는 850-1,000°C 구간에서는 증가하다가 1,000-1,100°C 구간에서는 감소하는 것으로 나타난다. 높은 온도에서 적철석으로의 활발한 산화 반응으로 피크가 감소한 것으로 볼 수 있다.
Na0.75Fe0.75Ti0.25O2는 900°C 이하의 배소 온도에서 생성되었다가 그 이상의 온도에서는 생성되지 않았음을 확인할 수 있다. Na0.75Fe0.75Ti0.25O2는 티탄철석과 Na염, 적철석 또는 자철석 간의 반응으로 생성되는데(Zhang et al., 2019), 고온에서는 적철석 또는 자철석이 Na0.75Fe0.75Ti0.25O2의 생성 반응에 참여하기 보다는 적철석으로의 산화 반응이 우세하게 일어난 것으로 보인다. 따라서 900°C 이상 고온으로 갈수록 티탄철석과 Na염의 반응으로 생성되는 NaFeTiO4만이 생성된 것으로 추정된다.
1,000-1,100°C 구간에서는 티탄철석, 자철석 등의 주요 광물에 대한 반응뿐만 아니라 맥석 광물에 대한 반응도 활발히 일어나 1,000°C부터 Na-Al-PO4 화합물이 생성되기 시작한다. 이와 같은 맥석 광물과 Na염 간의 반응으로 인해 1,000°C 이상의 온도에서 배소 산물의 소결 및 연화가 일어나는 것으로 보인다.
염배소 영향인자에 따른 바나듐 침출 거동 분석
염배소 및 수침출 최적 조건을 결정하기 위하여 염배소 및 수침출에 영향을 미치는 요인들에 대하여 실험을 수행하였다. 우선적으로 염배소 영향인자로써 Na2CO3 첨가량(wt%), 염배소 온도 및 시간 등을 고려하여 바나듐의 침출 거동을 분석하였다. 염배소 영향인자 연구에서는 염배소 산물을 막자사발을 이용하여 해쇄한 후 수침출에 사용하였다.
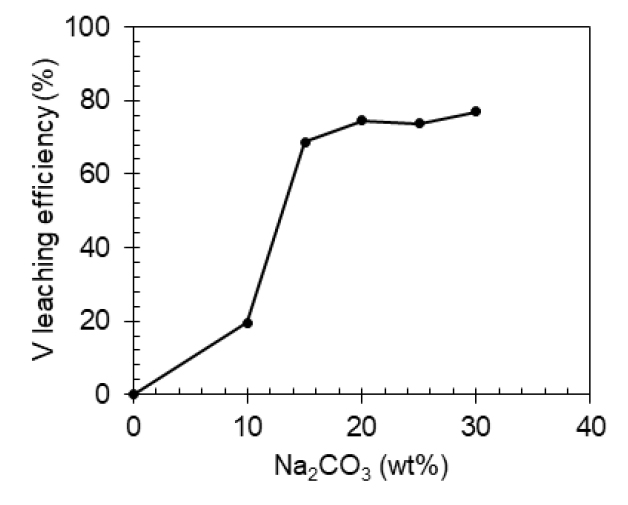
Fig. 4는 Na2CO3 첨가량에 따른 바나듐 침출율 변화를 나타낸다. Na2CO3 함량이 10-15 wt%로 증가할 때 바나듐 침출율이 16.9%에서 68.8%로 급격히 증가하였으며, 20wt% Na2CO3를 첨가하였을 때 74.6%에 이른 후 그 이상의 Na2CO3 첨가시에는 큰 변화가 없는 것으로 나타났다. 따라서 본 결과에 따라 최적 Na2CO3 첨가량은 20 wt%로 도출되었으며, 이후 실험에서는 20 wt% Na2CO3를 첨가하여 실험을 수행하였다.
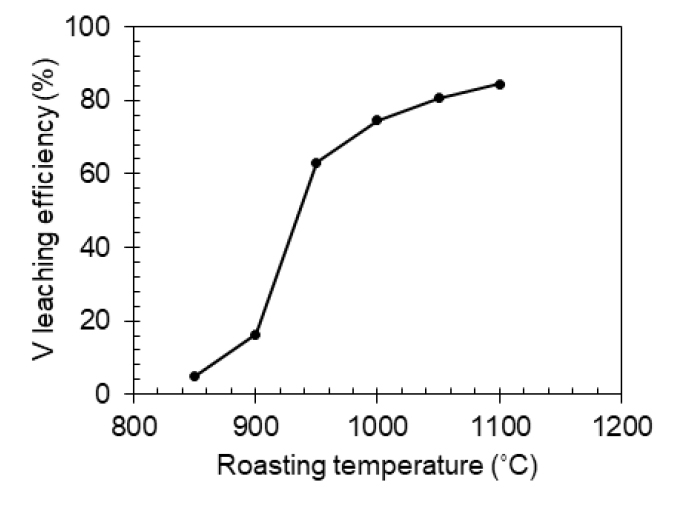
Fig. 5는 염배소 온도에 따른 바나듐 침출율 변화 추이를 나타낸다. 850-900°C구간에서는 침출율이 20% 이하로 매우 낮게 나타났으며, 950°C에서 63.0%로 급격히 증가한 후 그 이상의 온도에서는 완만한 증가폭을 나타냈다(1,000°C 74.6%, 1,050°C 80.5%, 1,100°C 84.4%). 해당 결과는 Fig. 3의 XRD 분석 결과와도 일치하는 경향을 보인다고 할 수 있는데, 고온으로 갈수록 산화 반응이 활발히 일어나 침출 가능한 바나듐 화합물의 생성이 늘어난 것으로 추정할 수 있다.
1,000°C 이상에서 지속적인 바나듐 침출율 향상이 나타남에도 불구하고 최적 온도는 1,000°C로 설정하였다. 고온현미경을 이용한 염배소 과정 관찰 시 Na2CO3 20 wt% 혼합 시료의 경우 1,012°C 및 1,014°C에서 각각 소결과 연화 현상이 발생하기 때문에 해당 현상이 발생하지 않는 근방의 온도인 1,000°C가 적절할 것으로 판단되었다. 실제로 1,000°C 이상의 온도에서는 배소 산물이 도가니에 부착되기 시작하여 회수가 어려운 현상이 발생하였다.
염함량 및 염배소 온도 설정과 더불어 염배소 시간 설정을 위한 실험을 수행하였다. Fig. 6은 염배소 시간에 따른 바나듐 침출율을 나타낸다. 염배소 시간을 30분에서 1시간까지 증가시킴에 따라 바나듐 침출율은 70.0%에서 73.9%까지 다소 증가하였으나, 1-2시간 사이에는 침출율이 73.9-74.9%로 큰 변화가 나타나지 않았다. 염배소 시간을 3시간까지 늘림에 따라 침출율은 80.5%에 도달하는 것으로 나타났다. 따라서 자철석의 격자 구조로부터 바나듐을 효과적으로 추출하기 위해서는 3시간 가량의 염배소 시간이 필요하다고 할 수 있다.
수침출 영향인자에 따른 바나듐 침출 거동 분석
염배소 영향인자 검토에 이어 수침출 최적 조건을 도출하기 위해 수침출 영향인자 검토 연구를 수행하였다. 수침출 영향인자로는 염배소 산물의 입도, 침출 온도 및 시간 등이 고려되었다.
염배소 후 산물은 매우 단단하여 재분쇄 과정이 필수적이다. 이에 vibrating cup mill을 사용하여 배소 산물을 10, 15, 20, 25초 동안 재분쇄 하였으며, 재분쇄 시간에 따른 입도(D50) 는 Table 2와 같이 13.8 µm에서 2.1 µm까지 감소하였다.
Table 2.
Change in particle size (D50) of the roasted ore depending on the re-grinding time (roasting: 1,000°C, Na2CO3 20 wt%, 3 hr)
| Re-grinding time (sec) | 10 | 15 | 20 | 25 |
| D50 (µm) | 13.8 | 7.0 | 3.9 | 2.1 |
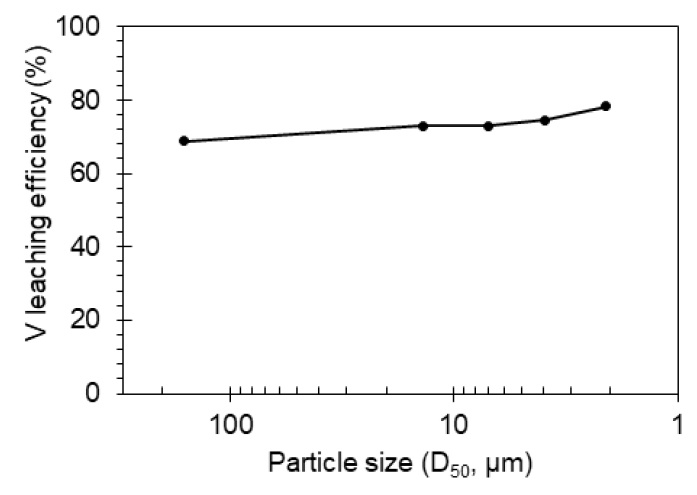
재분쇄 산물에 대해 25°C, 3시간 조건으로 수침출을 수행하였으며, Fig. 7은 염배소 이후 재분쇄 산물의 입도에 따른 바나듐 침출율 변화를 나타낸다. 재분쇄 시간이 10초에서 25초로 증가함에 따라, 즉 D50 입도가 13.8 µm 에서 2.1 µm로 감소함에 따라 바나듐 침출율이 다소 향상되는 것으로 나타났다(68.8% → 78.4%). 이로부터 재분쇄를 통해 염배소 산물의 더 넓은 표면적을 제공하는 것이 바나듐 침출율을 증가시키는데 유의미한 영향이 있음을 파악할 수 있다.
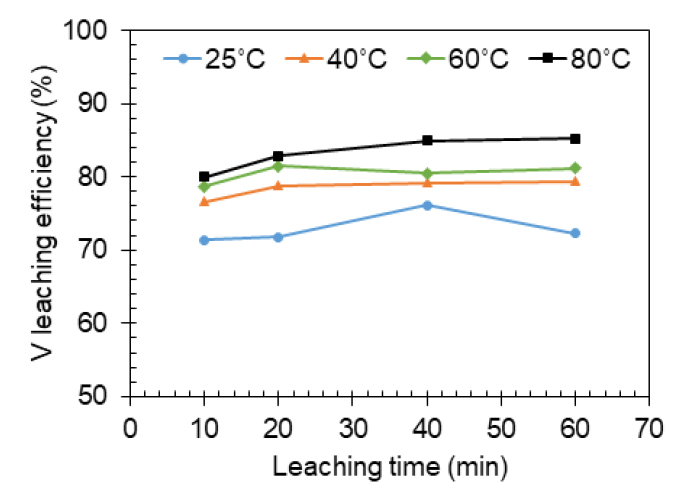
바나듐 침출율을 최적화하기 위한 마지막 영향 인자로 침출 온도 및 시간을 변화시키며 바나듐 침출율 변화 추이를 파악하였다. Fig. 8과 같이 침출 온도가 25, 40, 60, 80°C까지 증가함에 따라 최종 침출율이 72.3%, 79.4%, 81.2%, 85.2% 등으로 상당히 증가함을 알 수 있다. 이는 염배소 과정을 통해 생성되었을 것으로 추측되는 NaVO3(sodium metavanadate)의 용해도가 온도가 상승함에 따라 증가하기 때문이다(McAdam and Pierle, 1912). 또한, 침출 초기부터 매우 빠르게 침출 반응이 진행되어 모든 온도에서 초기 10분에 1시간 침출량의 94-99%가 침출되는 것으로 나타났다. 본 결과로부터 최적 바나듐 침출율을 획득하기 위해 염배소 산물의 침출 온도는 80°C, 침출 시간은 1시간으로 설정하는 것이 적절한 것으로 분석되었다.
결 론
국내산 VTM 광석으로부터 바나듐을 회수하기 위한 소다회 염배소-수침출 연구를 수행하였다. 자력선별을 통해 바나듐 농도를 V2O5로써 0.8%로 농축시킨 정광을 투입물질로 사용하였으며, 해당 광석은 주요 광물로 자철석과 티탄철석을 함유하고 있음이 확인되었다. 염배소 및 수침출 반응의 영향인자로써 각각 Na2CO3 첨가량, 염배소 온도 및 시간(이상 염배소 인자)과 염배소 산물 입도, 수침출 온도 및 시간(이상 수침출 인자) 등을 고려하여 염배소 및 수침출 최적 조건을 도출하였다. 염배소 최적 조건은 Na2CO3 20 wt%, 1,000°C, 3시간으로 확인되었으며, 850-1,100°C 구간의 염배소 온도에 따른 광물상 분석 결과, 온도가 상승할수록 산화 반응이 활발히 진행되어 3가 바나듐의 5가 바나듐 화합물로의 산화가 더욱 활발히 일어났을 것으로 추정되었다. 수침출 최적 조건은 D50 입도 2.1 µm, 80°C, 1시간으로 도출되었으며, 최적 염배소-수침출 조건을 종합한 결과, 85.2%의 바나듐 침출율을 달성하였다.