서 론
실험방법
백운석(dolomite)의 분석
백운석(dolomite)의 소성
경소백운석(CaO·MgO)의 수화
결과 및 고찰
백운석(dolomite)의 특성 분석
백운석(dolomite)의 소성 특성 분석
경소백운석(CaO·MgO)의 수화 특성 분석
결 론
서 론
국내에서 채광되는 비금속 광물 자원으로 탄산염광물(Carbonate mineral)은 석회석(CaCO3, limestone), 방해석(CaCO3, calcite), 능철석(FeCO3, siderite), 마그네사이트(MgCO3, magnesite), 백운석(Ca·Mg(CO3)2, dolomite) 등이 있으며, 탄산염을 함유하는 광물이 많이 포함되어 있다. 산업적으로 활용되는 국내부존 탄산염광물로 석회석(limestone), 백운석(dolomite), 방해석(calcite) 등이 있다. 백운석(dolomite)은 Ca·Mg(CO3)2의 화학조성을 가지는 복탄산염광물로 내화재, 유리, 제강, 비료, 골재, 화학 및 종이와 같은 다양한 산업적 용도로 사용되고 있다. 백운석(dolomite)의 이론적 화학 조성은 CaO 30.4 mass%, MgO 21.9 mass%이고, CO2 47.7 mass%이다. 백운석에 함유되어 있는 주요 불순물은, SiO2, Al2O3 및 Fe2O3이며, 불순물 성분 및 함량과 소성 온도 및 방식은 경소백운석(CaO· MgO) 제조 시, CaO와 MgO의 결정 크기(Bugdayci et al., 2017; Ghosh and Tripathi, 2012; Hartman et al., 1996; Hwang and Yu, 2019; Hwang et al., 2011; Hwang et al., 2014; Shahraki et al., 2009; Shahraki et al., 2011; Yeprem, 2007)에 영향을 미칠 수 있다.
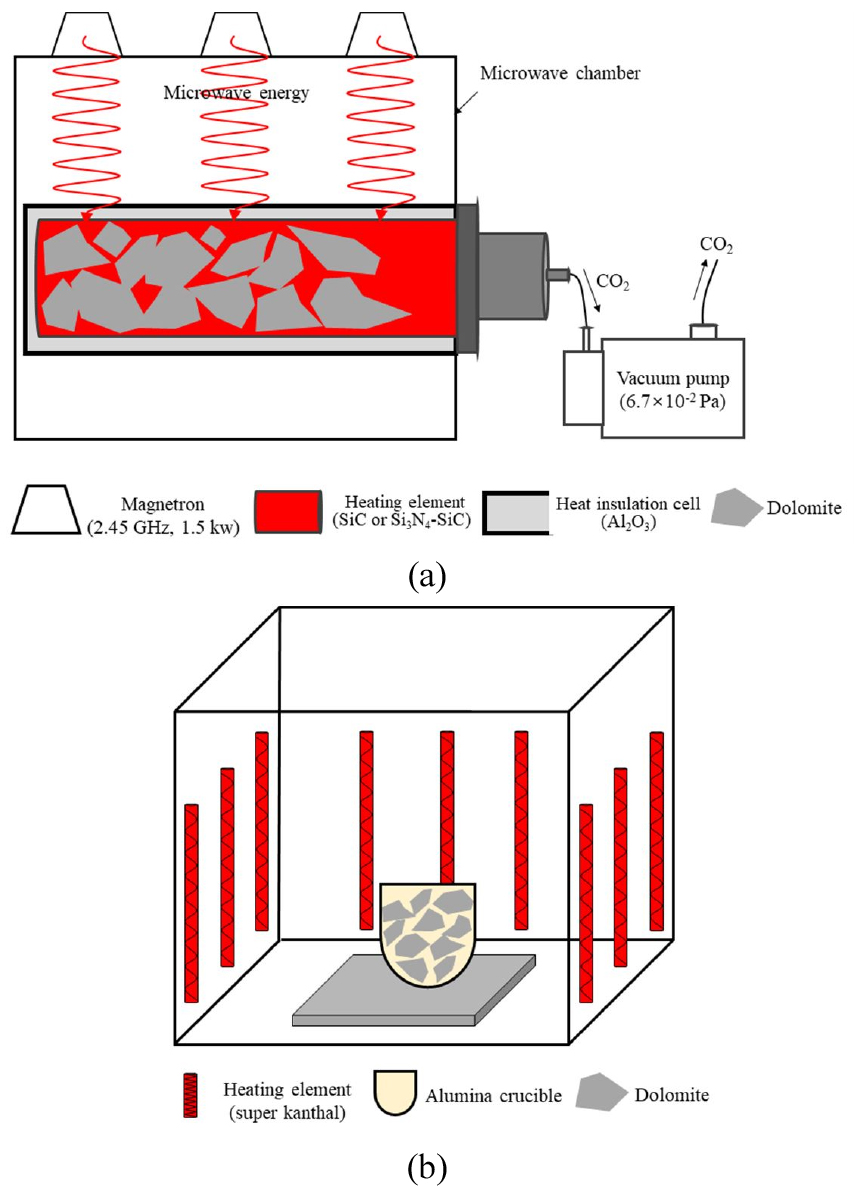
백운석(dolomite)을 소성하여 경소백운석(CaO·MgO)을 제조하기 위한 소성용 장비는 normal shaft kiln, double inclined kiln, multi-chamber kiln, annular shaft kiln, rotary kiln, mixed-feed shaft kiln이 있으며, 대부분 열원으로 고체 및 액체 연료를 필요로 한다. 하지만 최근에는 연료를 이용한 소성방식의 문제점인 높은 운용비용을 저감하고 환경오염을 방지하기 위해 마이크로파를 이용한 소성 연구(Brosnan et al., 2003; Changhong et al., 1997; Das et al., 2009; Carmona et al., 2003; Metaxas, 1991; Panda et al., 2006; Zhao et al., 2000)가 활발하게 이루어지고 있다. 마이크로파를 이용하는 소성방식은 마이크로파를 발열체(SiC, Si3N4 등)에 조사(Brosnan et al., 2003; Changhong et al., 1997; Chatterjee et al., 1998; Clemens and Saltiel, 1995; Das et al., 2009; Kenkre et al., 1991; Metaxas, 1991; Panda et al., 2006; Zhao et al., 2000)할 때 발생하는 열로 피소성체를 소성하는 방식으로 기존 방식에 비해 경제성이 높고 친환경적이여서 활용을 주목받고 있다. 그러나 활용확대를 위해서 마이크로웨이브 소성로의 문제점인 국부 가열과 열폭주(thermal-runaway)현상(Kenkre et al., 1991) 해결이 필요하다. 이에 대한 연구는 마이크로파가 투과 가능한 단열재 소재로 Al2O3, MgO, SiO2 등으로 마이크로파의 편중되는 현상을 완화시길 수 있으며, 또한 마이크로파 조사에 의한 발열소재인 SiC, Si3N4, Si3N4-SiC의 도가니 형태로 이용할 시에 발열소재가 마이크로파를 흡수하여 runaway 현상을 막을 수 있다(Hwang et al., 2012; Hwang et al., 2013).
석회계 재료는 폭넓은 용도로 환경정화재료로 옛날로부터 이용되어 왔다. 쓰레기 소각장 등 배기가스 중에 함유되는 유해 산성가스의 정화(배가스처리), 화력발전소나 제철소 등에서 배연 중의 유황제거(배연탈황), 공장에서 배출되는 산성폐수의 중화(폐산중화), 폐수 중의 유해물제거제(유해물질처리제) 등 석회계 재료는 우리들의 환경을 지키는 제품으로서 이용되어 왔다. 백운석(dolomite)은 제강용이나 농업용 등에서 사용되고 있으나 용도는 한정적이고, 특히 환경정화 혹은 공해방지용으로 이용하는 예는 적다.
본 연구에서는 폐수정화, 가스정화에 적용을 위한 고 반응성 경소백운석(CaO·MgO) 제조를 진행하였다. 백운석(dolomite)을 사용하여 마이크로웨이브 진공 소성(내부 가열 방식)과 전기로 상압 소성(외부 가열 방식) 조건으로 경소백운석(CaO·MgO)을 제조하고, XRD, XRF, TG-DSC의 분석을 진행하고, 비표면적의 변화를 확인하였다. SEM을 사용하여 표면 형상 변화를 관찰하고, ASTM C 110의 규격에 준하여 경소백운석(CaO·MgO)의 수화 반응을 실시하고 수화(활성도)를 측정하였다.
실험방법
백운석(dolomite)의 분석
본 연구에 사용된 백운석(dolomite)은 충북 북부권에 위치한 ㈜대성 MDI사의 지름 20 mm 이하의 원석 500 g을 사용하였다. 백운석(dolomite) 및 경소백운석(CaO·MgO)의 결정상 분석은 X-선 회절분석기(X-Ray Diffraction, model : D/MAX2500V/PC, Rigaku Co. Ltd., Japan)를 이용하여 수행하였다. 결정상 분석은 XRD method ICDD (International Centre for Diffraction Data) card를 이용하는 리트벨트법(rietveld method)을 적용하였는데, 대상 시료의 구조모델을 가정하여 회절 profile 강도를 계산하여 실제 pattern 전체와 비교하여 결정의 양을 구하는 방법이다. 열분해(탈탄산화) 특성은 시차주사열분석기(Thermogravimetric analysis, model : STA 449C Jupiter, NETZSCH Co, Ltd., Germany)를 이용하여 무게 감량으로 CO2의 발생 양을 확인하였으며, 백운석(dolomite) 및 경소백운석(CaO·MgO)의 화학성분(CaO, SiO2, MgO, Fe2O3, Al2O3) 분석은 X-선 형광분석기(X-Ray Fluorescence, model : ZSX Primus II, Rigaku Co. Ltd., Japan)를 이용하여 확인하였다. 경소백운석(CaO·MgO)의 비표면적, 기공크기(pore size) 및 기공부피(pore volume)는 비표면적 분석장치(Accelerated Surface Area and Porosimetry System, model : ASAP 2020, Micromeritics Co. Ltd., USA)를 이용하여 확인하였다. 경소백운석(CaO·MgO)의 표면 형상 변화는 전계 주사 전자 현미경(Field Emission Scanning Electron Microscope; model : S-4300, HITACHI Co. Ltd., Japan)을 이용하여 분석하였고, 백운석(dolomite)의 밀도는 가스밀도측정기(Pycnometer; model : Accupyc 1330, Micromertics Co. Ltd, USA)를 이용하여 3회 반복 측정을 실시하였다.
백운석(dolomite)의 소성
백운석 시료를 마이크로웨이브 진공 소성로(M2 Co., Ltd., Korea, Heating element : Si3N4-SiC, heating rate : 19°C/min) 및 전기로(AJeon furnace Co., Ltd., Korea, heating element : super kanthal, heating rate : 10°C/min)를 이용하여, 각각의 소성로에서 온도 850°C, 950°C 및 유지시간은 30 min, 60 min으로 소성하였다. 마이크로웨이브 진공 소성로는 마그네트론(magnetron)을 사용하여 마이크로웨이브를 조사하여 발열체에 열을 가해주는 내부 가열 방식(Hwang et al., 2015)으로 진공펌프(Pumping speed (60 Hz) : 120(L/min), Ultimate pressure : 6.7×10-2 Pa)를 사용하여 진공 조건으로 소성하였다. 외부 가열 방식인 전기로는 알루미나 도가니를 사용하여 상압으로 소성했다. 각각의 소성 방식을 Fig. 1에 제시하였다.
경소백운석(CaO·MgO)의 수화
경소백운석(CaO·MgO)의 수화 반응성을 확인하기 위하여 ASTM C 110 규격의 수화 조건(hydration condition (slaking reaction))에 준하여 활성도 실험을 진행하였다.ASTM C 110 시험 조건은 다음과 같다. 초기 온도 40°C의 증류수를 400 g을 채운 드와플라스크(Dewar flask)에 지름 3 mm 이하 경소백운석(CaO·MgO) 120 g을 넣고 교반을 실시한다. 교반속도는 400 rpm ± 50 rpm로 설정하고 시간에 따른 온도 변화를 측정하여 수화(활성도) 실험을 진행한다. 이 때, 온도계는 0°C ~ 100°C 범위의 정밀도 0.1°C를 가지는 것을 사용한다.
결과 및 고찰
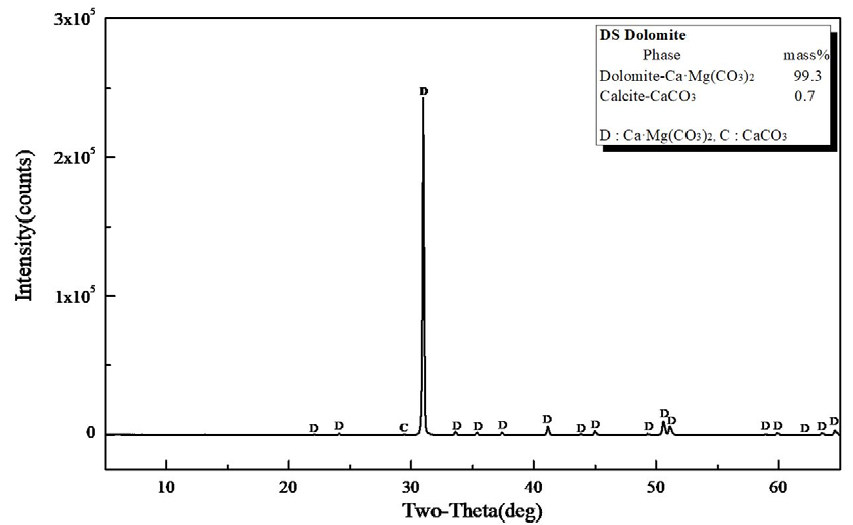
Fig. 2는 연구에 사용한 백운석의 결정 상태를 알아보기 위하여 XRD 분석 결과로, 리트벨트법(rietveld method)으로 결정상을 정량분석한 결과 Ca·Mg(CO3)2는 99.3 mass%이었으며 CaCO3가 0.7 mass% 함유되어 있다.
Table 1은 백운석의 XRF 분석결과로 CaO 33.1 mass%, MgO 19.3 mass%, SiO2 0.2 mass%, Al2O3 0.1 mass%, Fe2O3 0.2 및 CO2 46.8 mass%로 나타난다. CaO가 이론치보다 높게 분석된 것은 Fig. 2의 XRD 결과에서 미량의 CaCO3 및 무기물질(SiO2, Al2O3, Fe2O3)등의 혼재에 기인한 것으로 보인다.
Table 1.
XRF analyses of dolomite
| Component (Unit : mass%) |
Density (g/cm3) | |||||||
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | other | LOI (CO2) | ||
| Dolomite | 33.1 | 19.3 | 0.2 | 0.1 | 0.2 | 0.2 | 46.8 | 2.9 |
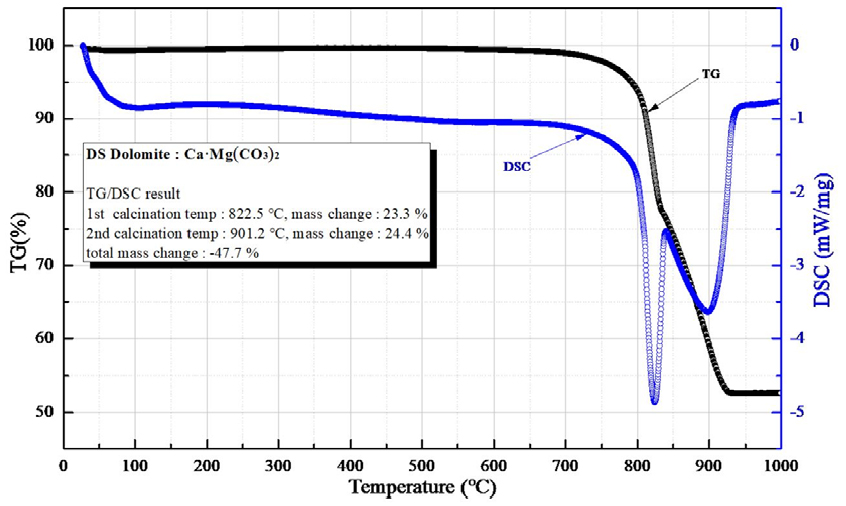
Fig. 3은 TG-DSC 측정 결과로 백운석(dolomite)의 열분해(탈탄산화) 특성을 나타내었다. 822.5°C에서 CO2 23.3 mass%로 1차 열분해(탈탄산화)가 일어나고, 2차 열분해(탈탄산화)는 901.2°C에서 CO2 24.4 mass%로 나타났다. 1차 열분해(탈탄산화)는 CO2의 배출로 인하여 탄산마그네슘(MgCO3)이 분해되어 산화마그네슘(MgO)의 생성을 보여주고, 2차 열분해(탈탄산화)는 CO2의 배출로 탄산칼슘(CaCO3)의 분해를 나타내고 산화칼슘(CaO)의 생성(Fatima et al., 2010; Karaca et al., 2006; Lingling and Min, 2005; McIntosh et al., 1990; Oguzhan, I., 2011; Olszak-Humienik and Możejko, 1999; Rat’ko et al., 2011; Samtani et al., 2002; Wiedemann and Bayer, 1987)을 보여준다.
백운석(dolomite)의 소성 특성 분석
백운석(dolomite)의 열분해(Heat decomposition) 또는 하소(Calcination)는 두 단계로 발생하며 식(1), (2)와 같다. CO2의 낮은 분압으로 인해 두 가지 분해 과정이 합쳐질 수 있으며(Kristóf-Makó and Juhász, 1999; Fatima et al., 2010; Karaca et al., 2006; Lingling and Min, 2005; McIntosh et al., 1990; Oguzhan, 2011; Olszak-Humienik and Możejko, 1999; Rat’ko et al., 2011; Samtani et al., 2002; Wiedemann and Bayer, 1987), 다음 식 (3)과 같다.
식 (1)의 첫 번째 단계에 해당하는 700°C 부근에서 백운석(dolomite) 열분해(탈탄산화)는 표면의 화학적 조성과 광물의 다공성에 변화(Brady et al., 1999; Endot and Lwin, 2011; Fatima et al., 2010; Karaca et al., 2006; Staszczuk et al., 1997; Walker et al., 2003)를 주고, 일반적으로 백운석(dolomite)이 열분해(탈탄산화)가 진행되어 탄산마그네슘(MgCO3)의 CO2가 분해되어 탄산칼슘(CaCO3)과 산화마그네슘(MgO)을 생성하고 비표면적과 기공 부피가 크게 증가하는 것을 보여준다.
식 (2)의 두 번째 단계는 900°C 부근에서 열분해(탈탄산화)가 진행되며 탄산칼슘(CaCO3)의 CO2가 분해되어 최종 생성 결과물로 산화칼슘(CaO)과 산화마그네슘(MgO)을 생성(Fatima et al., 2010; Karaca et al., 2006; Lingling and Min, 2005; McIntosh et al., 1990; Oguzhan, 2011; Olszak-Humienik and Możejko, 1999; Rat’ko et al., 2011; Samtani et al., 2002; Wiedemann and Bayer, 1987)한다.
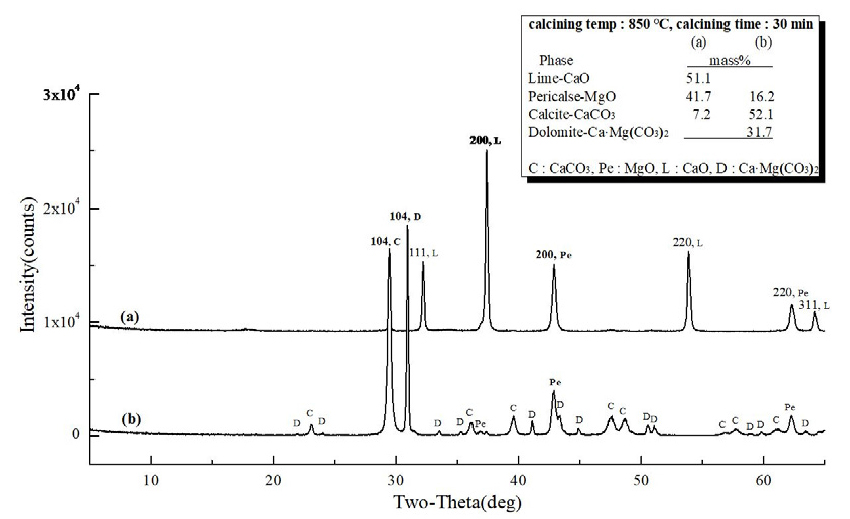
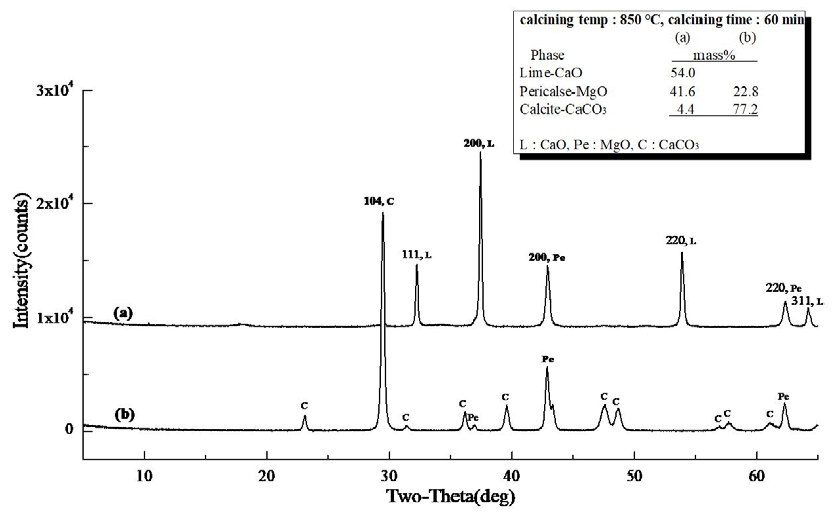
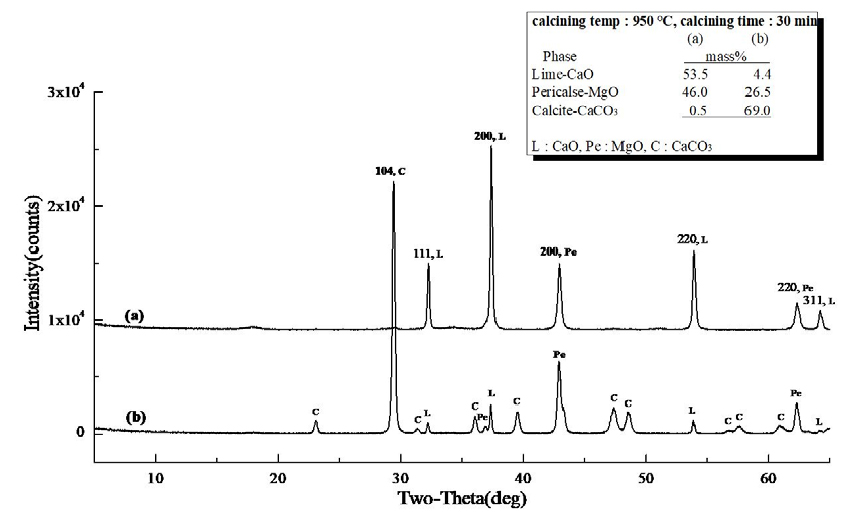
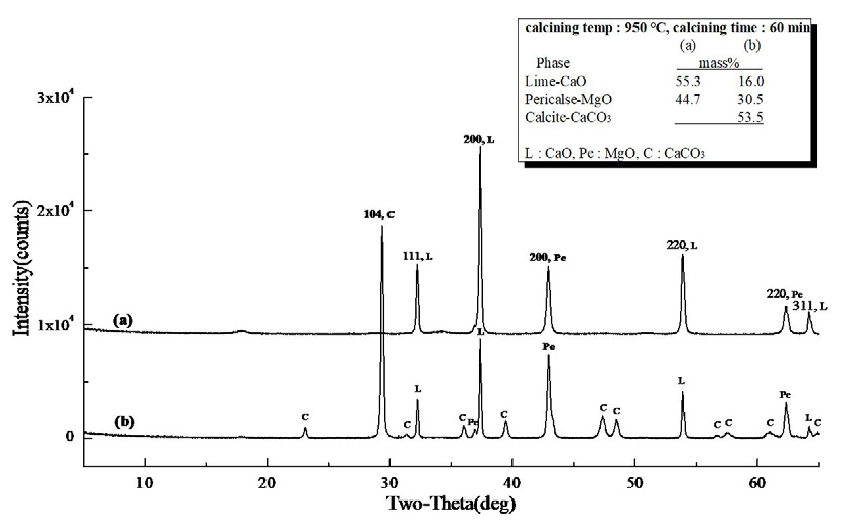
Fig. 4 (a)는 마이크로웨이브 진공 소성로에서 백운석을 850°C, 30 min 동안 소성하여 제조된 경소백운석(CaO· MgO)의 XRD 분석 결과로 CaO 51.1 mass%, MgO 41.7 mass%, CaCO3 7.2 mass%, (b)는 전기로에서 백운석을 850°C, 30 min 동안 소성하여 제조된 경소백운석(CaO· MgO)의 XRD 분석 결과로 MgO 16.2 mass%, CaCO3 52.1 mass%, Ca·Mg(CO3)2 31.7 mass%로 분석 되었다. Fig. 4 (a), (b)의 차이는 소성 방식에 기인하는 것으로 (a)마이크로웨이브 진공 소성로의 특성으로 내부 가열 방식으로 가열 메카니즘이 열원이 열전도로 열에너지원인 피소성물에 직접 열전도를 전달하는 것에 기인되고, 또한 진공에 의해 열분해(탈탄산화) 시 발생되는 CO2 배출이 원활하게 진행되어 (b)전기로에 비해 소성율이 높은 것으로 분석 되었다. Fig. 5의 (a)마이크로웨이브 진공 소성로를 이용하여 소성 조건 850°C, 60 min 유지하여 소성한 XRD 결과로 (a)는 CaO 54.0 mass%, MgO 41.6 mass%, 미소성 CaCO3 4.4 mass%로 분석 되었고, (b)전기로를 이용하여 소성 조건 850°C, 60 min 유지하여 소성한 XRD 결과로 MgO 22.8 mass%, 미소성 CaCO3 77.2 mass%로 (a)에 비해 소성율이 낮았으며, 외부 가열 방식인 전기로의 특성(열원 → 열대류 → 열전도)과 CO2 방출이 진공 조건에 비해 낮은 것으로 사료된다. 또한, Fig. 3의 백운석의 열분해(탈탄산화) 온도 특성으로 확인 될 수 있는 것으로 초기 열분해(탈탄산화) 온도 822.5°C와 Fig. 5의 850°C, 60 min 소성 조건에 기인하는 것으로 판단된다. 마이크로웨이브 소성은 마이크로파에 의해 열이 생성되어 전자기파 에너지가 입자 내부로 전달되어 전자, 원자, 분자 및 격자의 운동 에너지로 변환되어 온도가 상승하게 되어 빠른 열분해(탈탄산화)를 일으키고 열전도에 의존하지 않는 가열 기술(Hwang et al., 2012)이며, 전기로는 열전도에 의한 가열로 입자의 표면이나 가스에 의해 가열된 후, 표면에 흡수된 열에 의해 온도가 상승하고 내부로 운반되는 방식으로 열분해에 많은 시간이 필요하다. Fig. 6은 소성 조건 950°C, 30 min 유지하여 소성한 XRD 결과로 (a)는 마이크로웨이브 진공 소성로의 분석 결과, CaO 53.5 mass%, MgO 46.0 mass%, 미소성 CaCO3 0.5 mass%로 분석 되었고, (b)는 전기로의 분석 결과로 CaO 4.4 mass%, MgO 26.5 mass%, 미소성 CaCO3 69.0 mass%로 확인되었다. Fig. 3에서 백운석 2차 열분해(탈탄산화) 온도 901.2°C로 확인되었고, 백운석의 2차 열분해 온도보다 높은 온도 조건에서 소성하였다. Fig. 7은 (a) CaO 55.3 mass%, MgO 44.7 mass%로 소성이 되었으며, (b)는 CaO 16.0 mass%, MgO 30.5 mass%, 미소성 CaCO3 53.5 mass% 존재하였다.
제조 경소백운석의 XRF 결과는 Table 2와 Table 3에 나타내었다. 소성 조건(850°C, 950°C, 30 min, 60 min)의 결과로, Table 2는 마이크로웨이브 진공 소성으로 (a)는 CaO 30.4 mass%, MgO 22.5 mass%, LOI 46.6 mass%로 확인되고, (b)는 CaO 30.5 mass%, MgO 21.8 mass%, LOI 47.1 mass%로, (c)는 CaO 30.2 mass%, MgO 21.9 mass%, LOI 47.4 mass%로 확인되고, (d)의 경우 CaO 30.0 mass%, MgO 22.1 mass%, LOI 47.5 mass%로 확인되어, 백운석의 이론적 LOI 47.7 mass% 대비 99.7 % 이상의 소성율을 보인다. Table 3은 전기로 소성의 XRF 결과로 (a)는 CaO 52.2 mass%와 MgO 27.2 mass%, LOI 19.2 mass%로, (b)는 CaO 48.4 mass%, MgO 27.5 mass%, LOI 23.2 mass%로 확인되고, (c)에서 CaO 46.6 mass%, MgO 26.4 mass%, LOI 26.1 mass%를 확인하고, (d)는 CaO 41.6 mass%, MgO 26.2 mass%, LOI 31.5 mass%로 전기로 소성에서 소성율은 최고 66.0 %로 확인된다.
Table 2.
XRF analyses of the calcined dolomite by microwave vacuum furnace calcining conditions ((a) 850°C/30 min, (b) 850°C/60 min, (c) 950°C/30 min, (d) 950°C/60 min)
| Component (Unit : mass%) | ||||||
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | LOI (CO2) | |
| (a) | 30.4 | 22.5 | 0.2 | 0.1 | 0.1 | 46.6 |
| (b) | 30.5 | 21.8 | 0.2 | 0.1 | 0.1 | 47.1 |
| (c) | 30.2 | 21.9 | 0.2 | 0.1 | 0.1 | 47.4 |
| (d) | 30.0 | 22.1 | 0.2 | 0.2 | 0.1 | 47.5 |
Table 3.
XRF analyses of the calcined dolomite by electric furnace calcining conditions ((a) 850°C/30 min, (b) 850°C/60 min, (c) 950°C/30 min, (d) 950°C/60 min)
| Component (Unit : mass%) | ||||||
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | LOI (CO2) | |
| (a) | 52.2 | 27.2 | 0.5 | 0.3 | 0.2 | 19.2 |
| (b) | 48.4 | 27.5 | 0.3 | 0.2 | 0.2 | 23.2 |
| (c) | 46.6 | 26.4 | 0.3 | 0.2 | 0.1 | 26.1 |
| (d) | 41.6 | 26.2 | 0.2 | 0.1 | 0.1 | 31.5 |
소성 조건(850°C, 950°C, 30 min, 60 min)으로 제조한 경소백운석(CaO·MgO)의 XRD 및 XRF 결과에서 내부 가열 방식인 마이크로웨이브 진공 소성은 모든 소성 조건에서 CaO 30.0 mass% ~ 30.5 mass%와 MgO 21.8 mass% ~ 22.5 mass%, 46.6 mass% ~ 47.5 mass%의 LOI 값을 보이고, 전기로의 경우는 CaO 30.0 mass% ~ 30.5 mass%와 MgO 21.8 mass% ~ 22.5 mass%, LOI 값이 19.2 mass% ~ 31.5 mass%로 확인되어 미소성 Ca·Mg(CO3)2, CaCO3가 확인되었다. 진공 소성은 마이크로파에 의해 백운석 내부로부터 열분해가 일어나고, 진공펌프를 사용해 CO2의 체류 시간을 단축하고 빠른 배출로 재탄산화가 일어나지 않음으로 열분해가 빨리 일어나고, 높은 소성율의 경소백운석(CaO·MgO) 제조가 가능하다.
Table 4와 Table 5는 소성 조건(850°C, 950°C, 30 min, 60 min)의 비표면적을 확인하였다. Table 4는 마이크로웨이브 진공 소성의 비표면적 결과로, (a)는 비표면적 17.97 m2/g, pore volume 0.08 cm3/g, pore size는 18.89 nm이고, (b)의 비표면적은 22.04 m2/g, pore volume 0.12 cm3/g, pore size는 20.89 nm로 확인되고, (c)에서는 비표면적 20.95 m2/g, pore volume 0.10 cm3/g, pore size는 19.37 nm이고, (d)는 비표면적 20.00 m2/g, pore volume 0.09 cm3/g, pore size는 17.72 nm로 확인되었다.
Table 4.
BET analysis of calcined dolomite by microwave vacuum furnace calcining condition s((a) 850°C/30 min, (b) 850°C/60 min, (c) 950°C/30 min, (d) 950°C/60 min)
Table 5.
BET analysis of calcined dolomite by electric furnace calcining conditions ((a) 850°C/30 min, (b) 850°C/ 60 min, (c) 950°C/30 min, (d) 950°C/60 min)
Table 5는 전기로의 비표면적 결과를 보여주었다. (a)에서 비표면적 3.38 m2/g, pore volume 0.01 cm3/g, pore size는 8.88 nm로 확인되고, (b)는 비표면적 4.08 m2/g, pore volume 0.01 cm3/g, pore size는 10.73 nm이고, (c)는 비표면적 4.86 m2/g, pore volume 0.02 cm3/g, pore size는 12.76 nm로 확인되고, (d)에서 비표면적 4.85 m2/g, pore volume 0.02 cm3/g, pore size는 13.02 nm로 확인되었다.
측정 결과, 내부 가열 방식인 마이크로웨이브 진공 소성은 비표면적 17.97 m2/g ~ 22.04 m2/g이 확인되고, 전기로는 3.38 m2/g ~ 4.86 m2/g의 비표면적이 확인되어 5배 이상의 값을 보인다. 마이크로웨이브 진공 소성은 백운석이 열분해(탈탄산화)시 CO2의 빠른 배출로 인하여 재탄산화가 일어나지 않고 표면의 상변화로 비표면적이 증가(Brady et al., 1999; Fatima et al., 2010; Karaca et al., 2006; Staszczuk et al., 1997; Walker et al., 2003)한 것으로 판단된다. 소성온도 950°C, 30 min 이후 BET 값이 감소하는 것을 볼 수 있는데, 이는 MgO의 소결(Hartman et al., 1996)에 의한 것으로 사료된다.
Fig. 8에서 (a)마이크로웨이브 진공 소성(850°C, 유지시간 60 min)과 (b)전기로의 상압 소성(850°C, 유지시간 60 min)으로 제조한 경소백운석(CaO·MgO)의 SEM images를 나타내었다. (a)는 작은 입도와 균일한 형상 MgO와 CaO가 확인되었고, (b)는 입자가 불균일한 형상을 보여주고 있어 CO2 분해가 이루어지지 않았음을 보이며, CO2의 분해와 배출이 생성물의 입도와 크기에 영향(Brady et al., 1999; Fatima et al., 2010; Karaca et al., 2006; Staszczuk et al., 1997; Walker et al., 2003)을 미치는 것으로 판단된다.
경소백운석(CaO·MgO)의 수화 특성 분석
수화 조건(slaking 반응)은 ASTM C 110의 규격에 준하여 실시하였다. 경소백운석(CaO·MgO)의 수화 반응성 시험으로 고, 중, 저 반응성으로 나타내주며, 수화 반응의 종결점이 최고 수화 발열의 수화 반응 시간이 10 min 이내이면 고 반응성, 10 min ~ 20 min이면 중 반응성, 20 min 이상으로 확인되면 저 반응성으로 평가된다. 경소백운석(CaO·MgO)은 CaO가 먼저 수화 반응을 일으키고, MgO는 CaO의 수화 반응에 의한 반응열로 인하여 이후에 반응(Hwang et al., 2015, Hwang and Yu, 2019)을 보이고, 초기 수화 온도를 40°C로 설정하고 활성도 측정을 실시하였고, 수화 반응식은 식(4)와 같다.
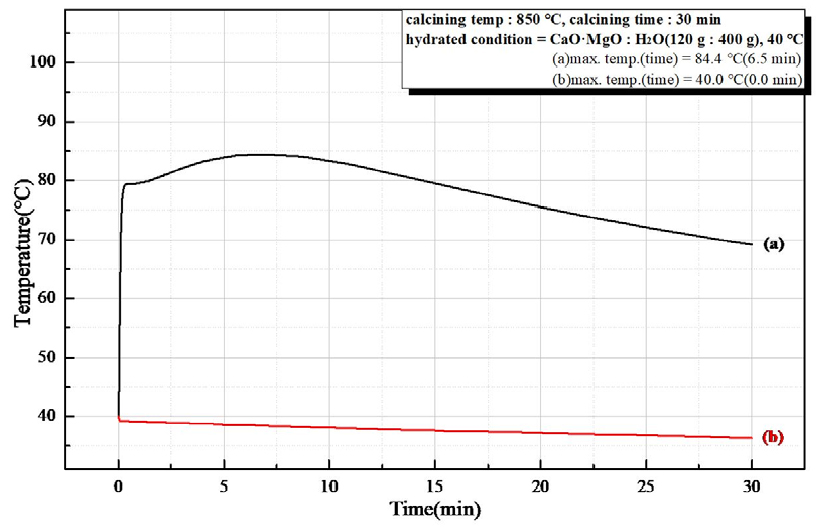
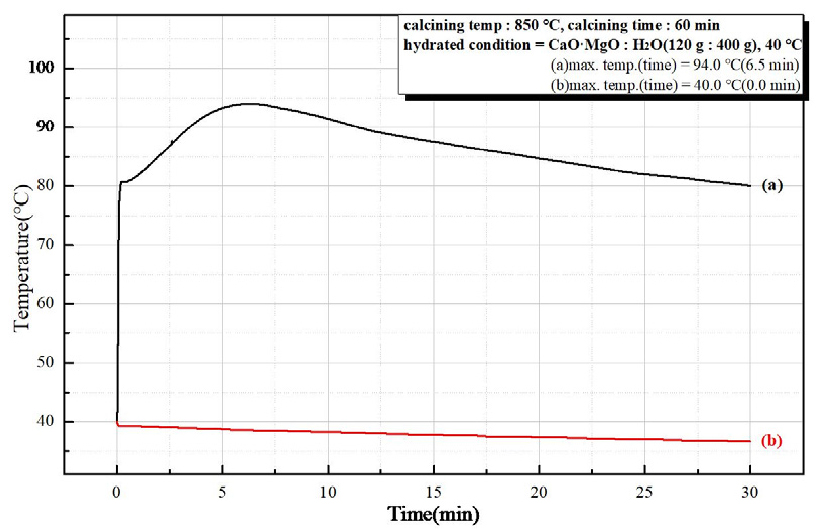
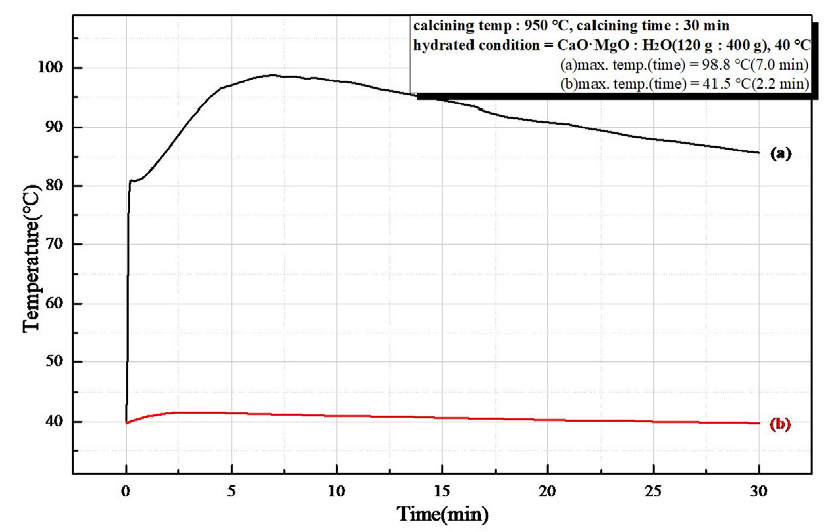
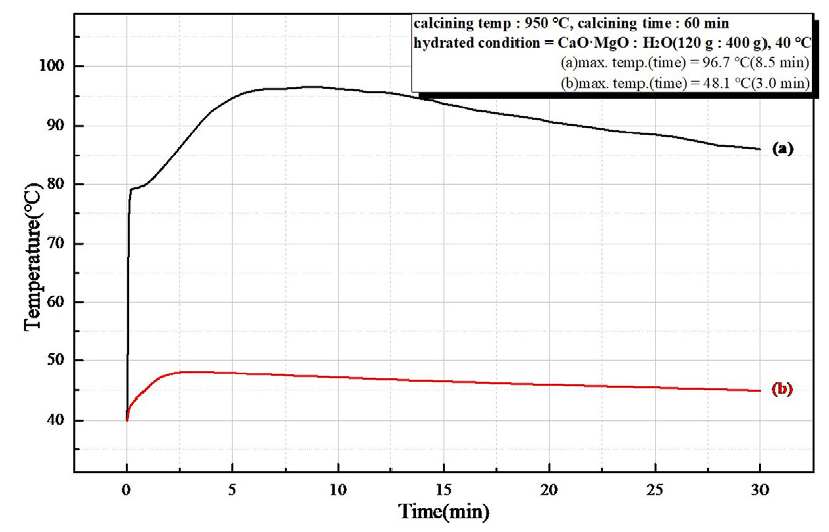
Fig. 9는 소성온도 850°C, 유지시간 30 min 소성한 경소백운석(CaO·MgO)으로 수화 반응열을 시간에 따른 온도 변화로 나타낸 것으로 (a)는 반응시간 6.5 min에서 최고 온도 84.4°C로 초기 수화 반응속도가 빠르고, 높은 반응열을 보이고, (b)에서는 수화 반응이 일어나지 않았다. Fig. 10은 소성온도 850°C, 유지시간 60 min 를 나타낸 것으로 (a)는 반응시간 6.5 min에서 최고 온도 94.0°C의 초기 수화 반응속도가 빠르며 높은 반응열을 보였고, (b)는 수화 반응을 확인할 수 없었다. Fig. 11은 소성온도 950°C, 유지시간 30 min의 수화 반응열을 시간에 따른 온도 변화를 나타낸 것으로 (a)는 반응시간 7.0 min에 최고 온도 98.8°C의 높은 반응열과 빠른 초기 수화 반응속도를 확인하였고, (b)는 최고 온도 41.5°C 반응시간 2.2 min으로 약간의 반응열만 확인되었다. Fig. 12는 소성온도 950°C, 유지시간 60 min 소성하여 수화 반응열을 시간에 따른 온도 변화를 나타낸 것으로 (a)는 반응시간 8.5 min에서 최고 온도 96.7°C로 높은 반응열이 나타났고, (b)는 반응시간 3.0 min에서 최고 온도 48.1°C로 낮은 반응열이 확인되었다. 소성 조건(850°C, 950°C, 30 min, 60 min)으로 제조한 경소백운석(CaO· MgO)의 수화 반응성 시험 결과를 Table 6과 Table 7에 나타내었다. Table 6은 마이크로웨이브 진공 소성으로 최고 온도 84.4°C ~ 98.8°C를 보이고, 반응시간 6.5 min ~ 8.5 min으로 확인되어, 고 반응성임을 확인하였다. Table 7은 전기로 소성으로 최고 온도 40°C ~ 48.1°C로 확인되어 낮은 반응열을 보이거나 반응하지 않았다.
Table 6.
Temperature profiles of the slaking reaction at hydration conditions (ASTM C 110) - microwave vacuum furnace ((a) 850°C/30 min, (b) 850°C/60 min, (c) 950°C/30 min, (d) 950°C/60 min)
Table 7.
Temperature profiles of the slaking reaction at hydration conditions (ASTM C 110) - electric furnace ((a) 850°C/30 min, (b) 850°C/60 min, (c) 950°C/30 min, (d) 950°C/60 min)
ASTM C 110을 적용하여 수화 반응성을 측정한 결과, Fig. 4, 5, 6 and 7과 Table 2, Table 3의 XRD, XRF의 값에서 확인할 수 있는데, 마이크로웨이브 진공 소성에서는 46.6 mass% 이상의 높은 LOI 값을 보이고 CaO와 MgO 생성이 92.8 mass% 이상 확인되며, 전기로는 LOI 31.5 mass% 이하로 CaO와 MgO의 36.5 mass% 이하 생성이 확인되고, 53.0 mass% 이상의 미소성 Ca·Mg(CO3)2와 CaCO3를 확인하였고, 이는 미소성이 많으면 수화 반응에 영향을 미치는 것으로 보인다.
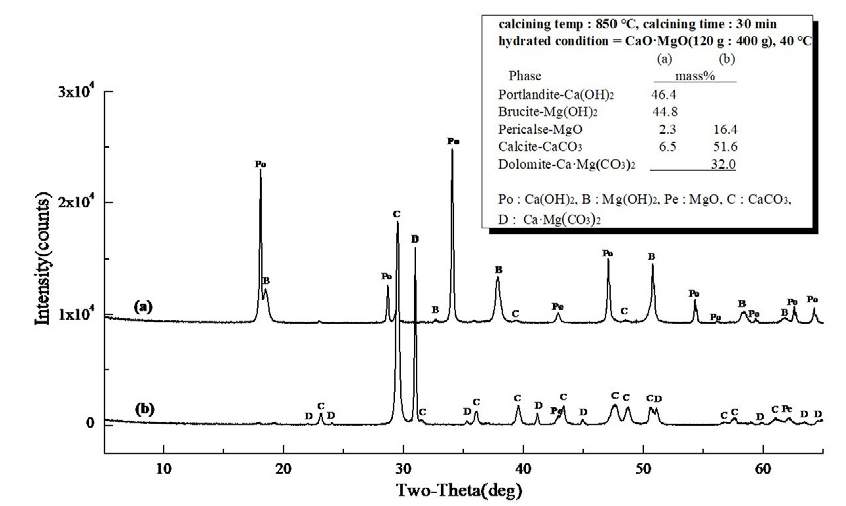
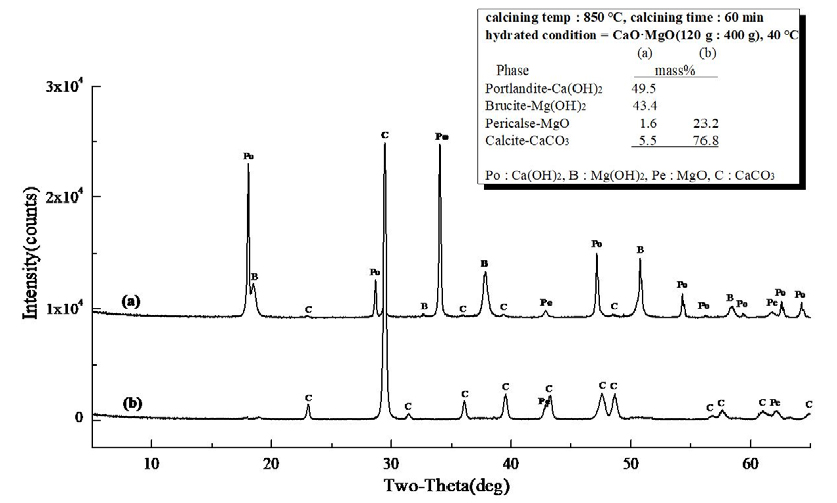
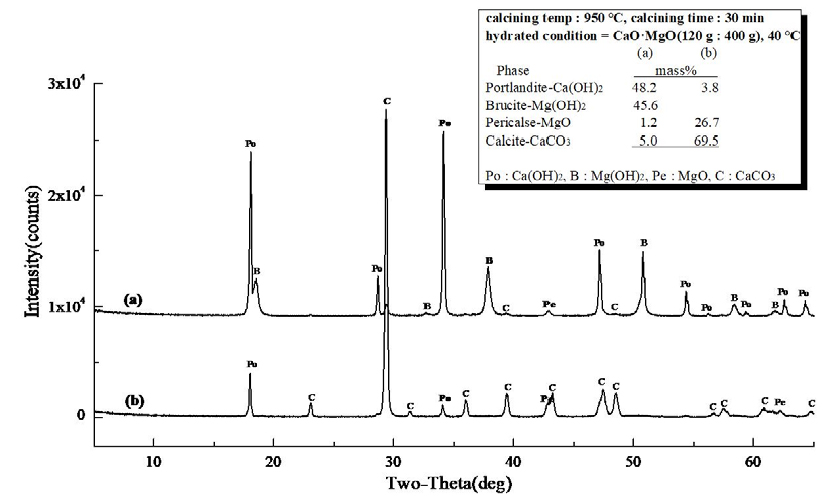
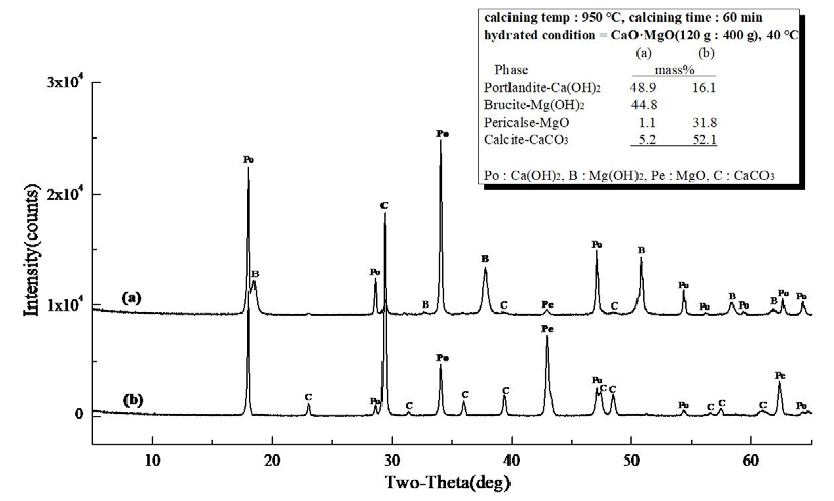
Fig. 13은 경소백운석(CaO·MgO)의 수화 반응물에 대한 XRD 결과로 소성온도 850°C, 유지시간 30 min으로 소성한 경소백운석(CaO·MgO)으로 (a)는 Ca(OH)2 46.4 mass%와 Mg(OH)2 44.8 mass%, MgO 2.3 mass%, CaCO3 6.5 mass%로 확인되고, (b)는 MgO 16.4 mass%와 CaCO3 51.6 mass%, 미소성 Ca·Mg(CO3)2 32.0 mass%로 확인되었다. Fig. 14는 소성온도 850°C, 유지시간 60 min으로 소성한 경소백운석(CaO·MgO)의 수화 반응물로 (a)는 Ca(OH)2 49.5 mass%와 Mg(OH)2 43.4 mass%, MgO 1.6 mass%, CaCO3 5.5 mass%로 확인되고, (b)는 MgO 23.2 mass%, CaCO3 76.8 mass%로 확인되었다. Fig. 15는 소성온도 950°C, 유지시간 30 min으로 소성한 경소백운석(CaO·MgO)으로, (a)는 Ca(OH)2 48.2 mass%와 Mg(OH)2 45.6 mass%, MgO 1.2 mass%, CaCO3 5.0 mass%이고, (b)는 Ca(OH)2 3.8 mass%와 MgO 26.7 mass%, CaCO3 69.5 mass%로 확인된다. Fig. 16은 소성온도 950°C, 유지시간 60 min의 경소백운석(CaO·MgO)으로, (a)는 Ca(OH)2 48.9 mass%와 Mg(OH)2 44.8 mass%, MgO 1.1 mass%, CaCO3 5.2 mass%로 확인되고, (b)는 Ca(OH)2 16.1 mass%,와 MgO 31.8 mass%, CaCO3 52.1 mass%로 확인된다.
ASTM C 110의 규격에 준하여 slaking 반응을 실시하여 수화 반응물에 대해서 Fig. 9, 10, 11, 12와 Table 6, Table 7의 수화 반응물에 의한 분석 결과, 반응 온도가 80°C 이상에서는 CaO와 MgO의 수화 반응으로 91.2 mass% 이상 Ca(OH)2와 Mg(OH)2로 생성되었고, calcite(CaCO3)의 양의 증가는 물속에 함유되어 있는 미량의 HCO3- 이온과 반응하여 생성된 것으로 판단된다.
결 론
백운석(dolomite)은 파분쇄 된 제품으로 제강, 유리, 비료, 골재용 등에 사용되고, 소성 제품으로 제강용, 내화물, 토질안정제, 폐수정화, 비료, 가스정화 등에 사용된다. 본 연구에서는 폐수정화, 가스정화에 적용을 위한 고 반응성 경소백운석(CaO·MgO) 제조를 목표로 하였다. 백운석(dolomite)을 내부 가열 방식인 마이크로웨이브를 이용한 진공 소성과 외부 가열 방식인 전기로의 상압 소성으로 경소백운석(CaO·MgO)을 제조하였다. 지름 20 mm 이하의 백운석(dolomite) 500 g을 소성하였고, 함량은 Ca·Mg(CO3)2가 99.3 mass% 이상, CaCO3 0.7 mass% 이하로 확인되었다. 소성 온도는 850°C, 950°C로 유지시간은 30 min, 60 min으로 하여, 진공펌프(6.7×10-2 Pa)를 사용해서 마이크로웨이브 진공 소성에 내부 변화를 주어 빠른 열분해(탈탄산화)가 일어나고, 전기로의 상압 소성에 비해 높은 소성율의 경소백운석(CaO·MgO)이 제조되었다.
각각의 조건으로 실험을 진행한 마이크로웨이브 진공 소성은 LOI 46.6 mass% ~ 47.5 mass%로 확인되었고, LOI 19.21 mass% ~ 31.48 mass%의 전기로 보다 높은 소성율을 보인다. 비표면적의 경우도 마이크로웨이브 진공 소성에서 최고 비표면적이 22.04 m2/g, pore volume 0.12 cm3/g와 pore size 20.89 nm로 확인되었고, 전기로에 비해 5배 이상의 비표면적 값을 나타내었다. SEM image 표면 형상 관찰 결과 마이크로웨이브 진공 소성에서 경소백운석(CaO·MgO)은 균일한 형상의 작은 입자 생성이 확인되며, 진공펌프의 빠른 CO2의 배출에 의한 영향으로 판단된다. 활성도 측정 결과 전기로 상압 소성은 미소성분으로 인해 낮은 수화 반응열을 보이거나 반응하지 않았다. 마이크로웨이브 진공 소성은 수화 반응 최고온도가 84.4°C ~ 98.8°C로 확인되어, 높은 반응성을 나타내고, 소요시간이 6.5 min ~ 8.5 min으로 고 반응성을 나타내었다. 마이크로웨이브 진공 소성로를 이용하면, 전기로에 비해서 낮은 에너지로 높은 비표면적을 갖는 고 반응성의 경소백운석(CaO·MgO)의 제조가 가능하다.