서 론
바나듐 레독스 흐름 전지(Vanadium Redox Flow Battery, VRFB)는 현재까지 가장 상용화에 근접한 흐름 전지 기술이며 친환경적인 고효율 에너지 저장 소자이다. 또한 충·방전에 따른 우수한 응답 특성, 높은 에너지 효율 및 긴 수명과 같은 많은 장점으로 대규모 전기화학적 에너지 저장 시스템(Energy Storage System, ESS)으로 주목 받고 있다(Skyllas-Kazacos et al., 2016; Choi et al., 2017). 하지만 이러한 장점에도 불구하고 VRFB의 높은 가격은 상용화의 걸림돌이 되고 있다. 현재 비용이 리튬이온전지(Lithium Ion Battery, LIB)는 kWh당 $271이지만 VRFB는 kWh당 $555로 LIB 대비 두 배 이상이다(Mongird et al., 2019). VRFB는 크게 스택과 전해액(vanadium electrolyte, VE), 그리고 전해액을 순환시키기 위한 펌프로 구성되는데 이중 전해액은 에너지 저장과 출력을 담당하는 활성 물질이기 때문에 중요하다. 상용 바나듐 전해액의 특성은 1.6 M V(3.5+)/4.2 M H2SO4으로 구성되며 순도는 99.98%이상으로 알려져 있다. VRFB 10 kW/120 kWh 시스템 기준으로 바나듐 및 전해액 제조 공정 비용이 40% 및 41%를 차지하는 상황이며 시스템의 에너지 용량이 커질수록 전체 VRFB 비용에서 전해액의 비중이 커진다(Heo et al., 2019; Noack et al., 2016).
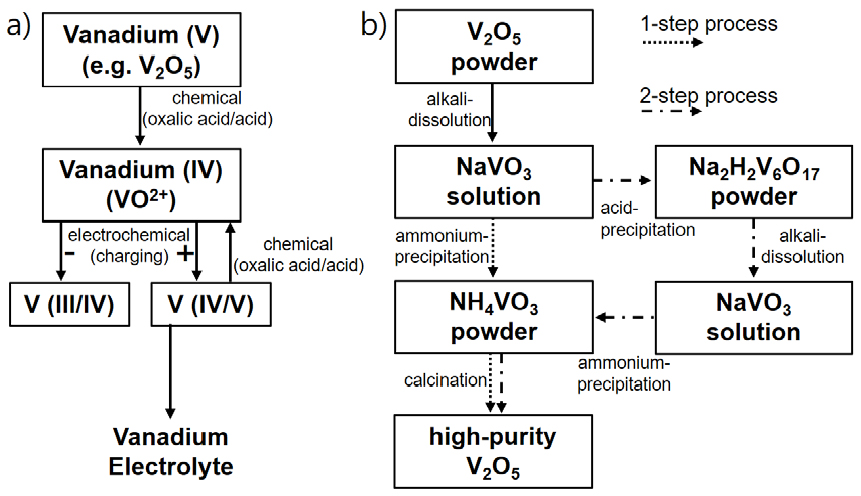
일반적인 바나듐 전해액 제조 공정은 고순도(99.8% 이상) V2O5 분말을 황산에 첨가한 후 화학적 환원제(oxalic acid)와 반응을 통하여 V(4+)의 용액을 제조한 후 추가적인 전해 공정을 통하여 V(3.5+)의 바나듐 전해액을 제조한다(Dassisti et al., 2016). 바나듐 전해액에 포함된 불순물 이온은 VRFB의 전기화학적 성능에 큰 영향을 미치기 때문에 전해액 제조용으로 고순도의 V2O5가 원료 물질로 사용된다(Skyllas-Kazacos et al., 2016). 하지만 현재 고순도 V2O5 제조비용이 높아 VRFB 제조 단가가 높은 상황이므로 불순물을 효과적으로 제어할 수 있는 고순도화 공정 개발이 시급한 상황이다. V2O5 고순도화 습식 공정(hydrometallurgical method)은 화학적 침전(Vitolo et al., 2000; He et al., 2007), 이온 교환(Nguyen et al., 2014; Nguyen et al., 2013), 용매추출 방법(Barik et al., 2014; Noori et al., 2014; Nguyen et al., 2015; Hu et al., 2014; Tavakoli et al., 2014)등 이며 또한 V2O5를 chlorination agent와 150°C 이상에서 반응시켜 얻은 VOCl3 용액을 이용하여 고순도(> 99.9%) V2O5 분말을 제조하는 염화(chlorination process)공정이 개발되었다(Jiang et al., 2017; Fan et al., 2020).
최근 저순도 V2O5(98.32%) 분말에 포함된 불순물을 제거하기 위해 chemical impurity removal agent(CIRA) 방법과 바나듐의 가수분해 침전(hydrolytic precipitation, HP) 방법을 적용하여 고순도 V2O5를 제조한 다음 이를 바나듐 전해액 제조용으로 활용한 연구가 보고되었다(Cui et al., 2019). CaCl2, MgCl2, Al2(SO4)3를 CIRA로 이용한 경우 순도가 오히려 낮아지거나 순도가 약간 상승하는 효과를 나타내었는데 이는 첨가된 CIRA 성분이 최종 V2O5에 유입되었기 때문이었다. 한편, HP 방법을 적용할 경우에는 추가적인 불순물이 유입되지 않아 V2O5 분말의 순도가 99.87%로 상승하였다. 따라서 본 연구에서는 각각 99.7%와 98.3%의 순도를 갖는 V2O5 시료를 이용하여 제조된 전해액 및 HP 방법을 적용하여 제조된 고순도 V2O5 시료를 특성 평가하였으며 VRFB용으로 활용하기 위한 추가적인 불순물 제거 필요성을 검토하였다.
본 론
상용 바나듐 전해액 분석 및 바나듐 전해액 제조
1.6 M V(3.5+)/4.2 M H2SO4으로 구성된 상용 바나듐 전해액(A, B brand)의 성적서 및 순도 분석을 진행하였으며 바나듐 전해액 및 V2O5 분말 순도는 식 (1), (2)을 이용하여 계산하였다.
바나듐 전해액 제조 실험에서 사용된 바나듐 원료는 99.7%(V2O5-E)와 98.3%(V2O5-F)의 순도를 갖는 V2O5 시료를 이용하였으며 V2O5 분말 순도 분석 결과를 Table 1에 나타내었다. 1.5 M V(3.5+)/3 M H2SO4으로 구성되는 바나듐 전해액 제조 공정은 Fig. 1 a)와 같이 화학적 환원 공정(V5+ → V4+)과 전기화학적 환원 공정(V4+ → V3.5+)을 통하여 제조하였다. 먼저, 화학적 환원공정은 V2O5-E(137.6 g) 및 V2O5-F(139.2 g) 시료를 4.5 M H2SO4 용액 1L에 첨가한 후 oxalic acid(COOH)2 (98%) 95 g을 첨가하고 상온에서 96 시간 동안 교반한 후 여과하여 V(4+)의 바나듐 용액을 제조하였다. 이후 전기화학적 환원 공정은 V(4+)의 바나듐 용액 1L를 carbon felt 전극과 Nafion 117로 구성되는 전기분해셀(5×5 cm2)의 양극과 음극에 10 mL/min의 유속으로 공급하면서 운전 전압 1.5 V에서 5.6 시간 동안 수행하여 음극에서 V(3.5+)의 바나듐 전해액을 제조하였다.
Table 1.
Purity of V2O5-E and V2O5-F sample
고순도 V2O5분말 제조
V2O5 분말의 가수분해 침전(hydrolytic precipitation) 고순도화 공정도를 Fig. 1 b)에 나타내었으며 V2O5 분말의 알칼리 용해 공정을 통해 1차로 제조된 저순도 NaVO3 용액을 NH4VO3 분말 제조에 직접 활용하는 1-step 공정과 1차로 제조된 저순도 NaVO3 용액에 산(acid)를 첨가하여 Na2H2V6O17(red cake)을 제조한 후 이를 다시 알칼리 용해 공정을 통해 제조된 2차의 고순도 NaVO3 용액을 NH4VO3 분말 제조에 활용하는 2-step 공정을 적용하였다. 먼저, 99.7% 순도를 갖는 V2O5-E 시료를 1-step 공정에 활용하였다. 1.5 M NaOH 용액 0.8 L에 V2O5-E 시료 73.6 g(V2O5, 1 M)을 첨가하고 상온에서 48시간 동안 교반한 후 여과하여 1차의 NaVO3 용액을 제조하였다. 1차의 NaVO3 용액 0.1 L에 (NH4)2SO4 13.28 g을 첨가하고 24시간 교반한 다음 증류수를 이용하여 세척하고 60°C에서 건조하여 NH4VO3 분말을 제조하였다. 제조된 NH4VO3 분말을 550°C에서 3시간 동안 열처리하여 고순도 V2O5(V2O5-E-1) 분말을 제조하였다. 추가적으로 NH4VO3 분말 침전 회수 후 여과 공정에서 세척수로 증류수 및 (NH4)2SO4 용액을 활용한 실험을 진행하였다. NH4VO3(99%) 분말 0.2 g을 0 ~ 1 M의 (NH4)2SO4 용액 20 mL에 첨가하고 24시간 교반 후 상등액의 바나듐 농도를 조사하였다.
98.3%의 순도를 갖는 V2O5-F 분말에 1-step 및 2-step 공정을 적용한 고순도화 실험을 진행하였다. 1.5 M NaOH 용액 0.8 L에 V2O5-F 분말 74.2 g(V2O5, 1 M)을 첨가하고 상온에서 48시간 동안 교반한 후 여과하여 NaVO3 용액을 제조하였다. 1-step 공정에서는 NaVO3 용액 0.1 L에 (NH4)2 SO4 13.25 g을 첨가하고 24시간 동안 교반한 다음 여과 공정에서 0.1 M (NH4)2SO4 용액을 이용하여 세척한 다음 60°C에서 건조하여 NH4VO3 분말을 제조하였다. 제조된 NH4VO3 분말을 550°C에서 3시간 동안 열처리하여 고순도 V2O5(V2O5-F-1) 분말을 제조하였다. 2-step 공정에서는 1차의 NaVO3 용액 0.1 L와 증류수 0.1 L를 혼합하고 50°C로 가열한 후 5 M H2SO4 용액 25 mL를 첨가하고 1시간 동안 유지한 다음 상온으로 냉각하고 23시간 이후 여과 및 건조하여 red cake 분말을 제조하였다. 2차의 고순도 NaVO3 용액은 1.5 M NaOH 0.1L에 red cake 분말 5.6 g을 첨가하고 24시간 교반하여 제조하였다. 2차의 NaVO3 용액 80 mL에 (NH4)2SO4 15.9 g(NH3/V = 3)을 첨가하고 60°C에서 1시간 반응이후 상온에서 23시간 교반 후 0.1 M (NH4)2SO4 용액을 이용하여 여과 및 세척한 다음 60°C에서 건조하여 NH4VO3 분말을 제조하였다. 제조된 NH4VO3 분말을 550°C에서 3시간 동안 열처리하여 고순도 V2O5(V2O5-F-2) 시료를 제조하였다. V2O5-F 시료에 1-step 및 2-step 공정을 적용한 고순도화 실험에서 침출 효율, 침전 효율 및 회수 효율은 식 (3), (4), (5)를 이용하여 계산되었다.
(Qo:amount in powder, Q: amount in solution)
(Co: concentration before precipitation, Q: concentration after precipitation)
모든 시료의 화학적 성분 분석은 유도결합플라즈마 (ICP-OES, Optima-5300DV, Perkin Elmer) 분석을 통하여 수행하였으며, 본 논문에서 제시한 산화물 형태의 불순물 함량은 금속 성분 분석 결과를 산화물 형태로 환산한 값이다. 그리고 바나듐의 산화수는 자외선 가시광선 분광기 (UV-VIS, UV-1800, Shimatu)를 통하여 분석하였다.
결과 및 고찰
바나듐 전해액 특성 및 순도
본 연구에서 1.6 M V(3.5+)/4.2 M H2SO4으로 구성된 상용 바나듐 전해액(A, B brand)의 성적서 및 순도 분석을 진행하였으며 바나듐 전해액내의 불순물 양을 참고하여 V2O5 분말 내에 예상되는 불순물의 양을 산화물 형태로 분석한 결과를 Table 2에 나타내었다. 상용 전해액은 바나듐 농도 1.6 M, V(3+)/V(4+) = 1.0(±0.05), SO42-(M) = 4.2 (±0.04) 및 밀도(kg/L) = 1.36(±0.006)의 기본적인 특성을 나타내었다. A brand 성적서의 규격과 불순물 함량을 이용하여 계산된 전해액의 순도는 각각 99.97%와 99.99%이였으며 불순물 분석 결과 B brand의 순도는 99.98%를 나타내어 상용 바나듐 전해액의 순도 기준은 최소 99.98%로 분석되었다. 바나듐 전해액내의 불순물 함유량을 기초로 V2O5내의 불순물을 산화물 형태로 검토한 결과 V2O5의 순도는 규격 상 99.66%와 실제 전해액 분석 결과를 기초로 한 결과는 99.79%로 분석되어 순도 99.98% 이상의 바나듐 전해액을 제조하기 위해서는 V2O5내의 불순물이 100% 바나듐 전해액에 유입되는 가정으로 VRFB용 V2O5의 순도는 99.8% 이상으로 확인되었다.
Table 2.
Characteristics of commercial vanadium electrolytes
저순도 V2O5 분말에 1-step 공정을 적용하여 바나듐 전해액을 제조하였으며 특성 및 순도 분석 결과를 Table 3에 나타내었다. 99.7%의 순도를 갖는 V2O5-E 분말을 이용하여 바나듐 전해액을 제조한 결과 바나듐 농도 1.35 M, V(3+) /V(4+) = 0.93, SO42-(M) = 3.0 및 밀도(kg/L) = 1.378의 특성을 나타내었다. 바나듐 농도가 1.5 M 보다 낮은 결과는 V2O5 분말을 활용하여 V(4+) 용액 제조 공정에서 바나듐 회수율 저하 및 V(4+) 용액으로부터 V(3.5+)의 바나듐 전해액을 제조하는 전해 공정에서 음극(cathode)에서 양극(anode)으로 바나듐이 이동하는 현상 때문으로 사료된다. V(3+)/V(4+)값 또한 1.0 보다 0.07 낮은 결과는 V(3+)양이 부족한 결과이므로 전해 공정에서 바나듐 용액의 바나듐 산화수를 실시간으로 모니터링하는 기술 적용이 필요하다. 그리고 전해액 밀도는 1.378 kg/L으로 이는 상용 전해액의 밀도 보다 0.018 kg/L 만큼 높은데 이는 전해액 내의 높은 불순물 농도 때문으로 사료된다. 불순물 분석 결과 상용 전해액(B brand) 대비 K, Al, Ca 함량이 높게 분석되었다. 이러한 결과는 V2O5-E 분말을 VRFB 바나듐 전해액 제조용 활용하기 위해서는 위에서 언급한 불순물을 제거하는 추가적인 공정이 필요함을 의미한다. 98.2%의 순도를 갖는 V2O5-F 분말을 이용하여 바나듐 전해액을 제조한 결과 바나듐 농도 1.36 M, V(3+)/V(4+) = 1.15, SO42- (M) = 3.0 및 밀도(kg/L) = 1.393의 특성을 나타내었다. 바나듐 농도가 1.5 M 보다 낮은 결과는 위와 같이 V2O5 분말을 활용하여 V(4+) 용액 제조 공정에서 바나듐의 회수율 저하 및 V(4+) 용액으로부터 V(3.5+)의 바나듐 전해액을 제조하는 전해 공정에서 음극(cathode)에서 양극(anode)로 바나듐이 이동하는 현상 때문으로 사료된다. V(3+)/V(4+)값 또한 1.0 보다 0.15 높은 결과는 전해 공정에서 V(3+)이 과량으로 발생함을 의미한다. 그리고 전해액 밀도는 1.393 kg/L의 값을 나타내어 이는 상용 전해액의 밀도 보다 0.033 kg/L 만큼 높은데 이는 전해액 내의 높은 불순물 농도 때문인 것으로 사료된다. 불순물 분석 결과 상용 전해액(B brand) 대비 Mg, K, Cr, Mn, Fe, Al, Na, Ca, Ti, Ni 함량이 높게 분석되었다. 이러한 결과는 V2O5-E 분말을 VRFB용 활용하기 위해서는 위에서 언급한 불순물을 제거하는 추가적인 공정이 필요함을 의미한다. 결론적으로 V2O5-E 시료와 V2O5-F 시료를 활용하여 제조된 바나듐 전해액의 순도는 각각 99.97% 및 99.91%를 나타내어 V2O5-E 및 V2O5-F 시료를 VRFB 바나듐 전해액 제조용으로 활용하기 위해서는 순도 향상이 필요하였다.
Table 3.
Characteristics of the vanadium electrolyte prepared using the V2O5-E and V2O5-F samples
고순도 V2O5 분말 특성
99.7%의 순도를 갖는 V2O5-E 시료에 1-step 공정을 적용하여 고순도화 실험을 수행하였다. Fig. 2과 같이 알칼리 용해 공정을 통한 1차의 NaVO3 용액 제조 이후 여과를 진행할 경우 사진 a) 및 b)와 같이 소량의 불용성 불순물이 여과됨을 보여준다. 여과 공정이후 투명하고 옅은 황색의 NaVO3 용액이 제조되었다. 고순도화 공정이후 얻어진 분말은 전형적인 V2O5 황색이 뚜렷해지는 결과를 나타내었다. Table 4에 나타낸 바와 같이 1-step 공정이후 제조된 V2O5 분말은 순도 99.82%를 나타내었고 고순도화 공정이후 불순물 Mg, K, Ca은 100% 분리되는 결과를 나타내었으며 Ag, Na, Si는 함량이 감소되는 효과를 나타내었고 Fe, Cd, Ga, Al은 고순도화 효과가 미비하였다. 특히, Fe과 Al 함량은 Table 2에 나타낸 불순물 함량 대비 높아 추가적인 제거 공정이 필요함을 나타내었다.
Table 4.
Results of the purified V2O5-E and V2O5-F samples
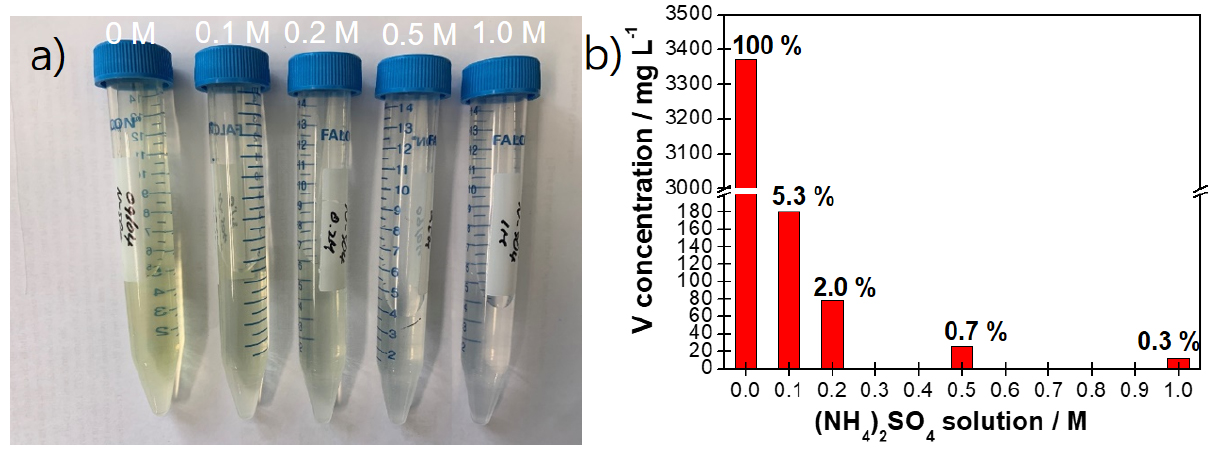
1차의 NaVO3 용액으로부터 NH4VO3를 회수 및 여과 공정에서 바나듐화합물의 큰 용해도값에 의한 바나듐 손실이 발생된다. 여과된 NaVO3 용액으로부터 (NH4)2SO4를 첨가하여 NH4VO3를 회수하는 단계에서 침전회수율은 V(86.6 %), Fe(65.6%), Na(4.8%), K(-0.6%)와 같이 확인되었다. NH4VO3 분말 침전 회수 후 여과 공정에서 세척수로 증류수와 (NH4)2SO4 용액을 활용한 결과를 Fig. 3에 나타내었다. 세척수의 (NH4)2SO4의 농도가 높아질수록 상등액 투명도가 높아졌으며 상등액내의 바나듐 농도 분석 결과 (NH4)2SO4의 농도가 높아질수록 바나듐의 농도는 감소하였다. 증류수(0 M)를 활용한 경우 바나듐 농도 3370.08 mg/L를 나타내었는데 이는 증류수를 NH4VO3 분말 세척수로 활용할 경우 여과 공정 중 상당량의 바나듐이 용해되어 손실된다는 의미이다. 이에 반하여 1 M (NH4)2SO4의 용액의 경우 증류수 대비 0.3%에 해당하는 바나듐 농도를 나타내었다. 이러한 결과는 NH4VO3 분말 침전 회수 후 여과 공정에서 세척수로 (NH4)2SO4 용액을 활용할 경우 여과공정에 바나듐 손실을 크게 줄일 수 있음을 의미한다.
98.3% 순도 V2O5-F 시료를 1-step 및 2-step 공정에 적용하여 고순도화 연구를 수행하였으며 결과를 Table 4에 나타내었다. 1차의 NaVO3 용액 제조 이후 여과를 진행할 경우 Fig. 4의 (a) 및 (b)와 같이 상당량의 불용성 불순물이 분리됨을 보여준다. 여과 공정이후 사진 (c)와 같이 투명하고 짙은 황색의 NaVO3 용액이 제조되었다. 또한 Fig. 4(d)는 적색의 red cake 용액을 보여주며 저순도 V2O5-F 시료는 검은색을 나타내어 높은 불순물 함량을 나타내며 2-step의 고순도화 공정이후 얻어진 분말은 전형적인 V2O5 황색이 뚜렷해지는 결과를 나타내었다. 1-step 공정이후 V2O5-F 시료 순도는 99.70%로 향상되었고 Ca, Cr, Ni, Cd, Ba, Ag은 100% 분리되는 결과를 나타내었으며 다른 불순물들은 함량이 감소되는 효과를 나타내었다. 특히, K, Mn, Na, Fe, Si, Al 함량은 Table 2에 나타낸 불순물 함량 대비 높아 추가적인 제거 공정이 필요하다. 2-step 공정이후 V2O5-F 시료의 순도는 99.86%를 나타내었고 Mg, Ti, Cr, Mn, Ni, Ba은 100% 분리되는 결과를 나타내었으며 다른 불순물들은 함량이 상당량 감소되는 효과를 나타내었다. 주요 불순물로는 K, Fe, Ga, Si, Al 등이며 K, Si, Al는 Table 2에 나타낸 함량 대비 높아 추가적인 제거 공정이 필요함을 나타내었다. 특히, Si는 1-step 보다 2-step에서 함량이 증가하는 결과를 나타내었는데 이는 2차 유입의 요소가 존재함을 의미한다.
바나듐 전해액 제조 공정 중 V2O5-F 시료와 환원제의 화학적 반응에 의한 V(4+) 용액 제조 공정에서 성분 침출률을 조사하여 Fig. 5(a)에 나타내었다. 성분 침출률은 V(90.3%), K(74.2%), Cr(89.14%), Mn(> 100%), Fe(> 100%), Al(> 100%), Ca(> 100%), Ti(97.6%), Si(3.13%), Ga(> 100%)로 분석되었다. 즉, V2O5-F 시료 내 대부분의 주요 불순물이 V(4+) 용액에 유입되어 최종 바나듐 전해액의 순도를 감소시킨다. V(4+) 용액 제조 공정에서 바나듐은 90.3% 침출되었으며 특이한 사항은 Si는 3.13%의 침출률을 나타내었다. 즉, V2O5 분말에 포함된 SiO2 불순물은 V(4+) 용액 제조 공정에서 불용성으로 분리 제거되어 바나듐 전해액에 유입이 차단됨을 의미한다. 따라서, V2O5 분말 고순도화 공정에서 SiO2 불순물 제거 필요성이 감소한다. V2O5-F 시료를 활용한 1차의 NaVO3 용액 제조 공정에서 성분 침출률을 조사하여 Fig. 5(b)에 나타내었다. 분석 결과 V(90.6%), K(> 100%), Cr(29.6%), Mn(33.2%), Fe(22.5%), Al(68.3%), Ca(46.0%), Ti(23.4%), Si(57.2%), Ga(>100%)로 분석되었다. 즉, V2O5-F 시료 내 주요 불순물 상당량이 1차의 NaVO3 용액 제조 공정에서 불용성으로 분리되는 결과를 나타내었다. V2O5-F 시료를 활용한 1-step 및 2-step 공정에서 여과 공정 중의 손실을 제외한 침전 회수 효율(recovery efficiency)을 분석하여 Fig. 5(c)에 나타냈다. 1-step에서는 알칼리 침출 효율과 NH4VO3 침전 효율만을 고려하였고 2-step에서는 알칼리 침출 효율, red cake 침전 효율과 NH4VO3 침전 효율을 고려하였다. 분석 결과 1-step에서는 V(75.29%), K(0%), Cr(19.27%), Mn(14.01%), Fe(10.76%), Al(40.84%), Ca(0%), Ti(5.52%), Si(48.67%), Ga(85.0%)로 분석되었으며 2-step에서는 V(58.26%), K(0%), Cr(7.02 %), Mn(1.96%), Fe(5.33%), Al(0%), Ca(0%), Ti(9.52%), Si(32.38%), Ga(60.2%)로 분석되었다. 이러한 결과는 V2O5-F 시료를 2-step 가수분해 침전(hydrolytic precipitation, HP) 공정에 적용하여 상당량의 불순물이 제거되어 99.8% 이상의 고순도 V2O5 분말을 제조할 수 있지만 바나듐 회수율은 58.3%이하로 낮아질 수 있기 때문에 경제성이 감소한다는 의미이다. 따라서 향후 순도 및 회수율 특성이 우수한 1-step 가수분해 침전 고순도 공정 개발이 필요하다.
결 론
상용 바나듐 전해액 특성 분석을 통해 바나듐 레독스 흐름 전지(VRFB)용 바나듐 전해액 및 V2O5의 순도를 검토하였으며 저순도 V2O5 분말에 가수분해 침전 공정을 적용한 습식 고순도화 연구를 수행한 결과를 제시하였다. 상용 바나듐 전해액 순도 분석 결과 VRFB용 바나듐 전해액 및 V2O5의 최저 순도는 각각 99.98% 및 99.8%로 확인되었다. 99.7% 및 98.3%의 순도를 갖는 V2O5을 활용하여 제조된 바나듐 전해액은 99.97% 및 99.91%의 순도를 나타내어 VRFB용으로 활용하기 위해서는 함유된 불순물을 분리/제거하여 순도 향상이 필요하였다. 99.7%의 순도를 갖는 V2O5-E 시료에 1-step 공정을 적용하여 고순도화 실험을 수행한 결과 순도가 99.82%로 향상되었으며 98.3% 순도 V2O5-F 시료를 1-step 및 2-step 공정에 적용한 고순도화 연구에서는 각각 99.7%와 99.86%로 순도가 향상되었다. 결과적으로 저순도 V2O5 분말에 가수분해 침전 공정을 적용할 경우 99.8% 이상의 고순도 V2O5이 제조되었지만 Fe, Ga에 대한 추가적인 불순물 제거 공정이 필요하였다. 또한 red cake 침전 단계를 포함하는 2-step 공정에서는 바나듐 회수율이 58.3% 이하로 감소될 가능성이 있어 추가적인 보완이 필요하다.