서 론
의학 영상 기술과 지하단면 영상법 들여다보기
CT
영상 재구성
핵의학 영상
머리말
핵의학 영상 속의 물리
SPECT
PET
자기공명 영상
머리말
자기공명 영상의 기본 원리
자기 공명
자기 공명과 이완
자기공명 신호의 획득 과정
자기공명 영상 생성 기법
초음파 영상
머리말
초음파 물리
초음파 영상 시스템
결 론
서 론
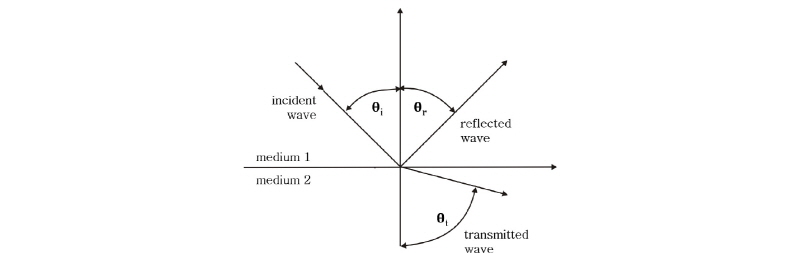
물리탐사에서 지하구조에 대한 정보를 얻기 위해 사용되는 지하 영상화 기술은 지표면에서 측정한 자료를 2차원 또는 3차원으로 그려내는 방법과 시추공을 이용하여 지하 단면의 영상을 구하는 지하단면 영상법(geotomography, geo-physical tomography) 등이 있다. 특히 지하단면 영상법은 지하 단면의 물성 분포와 그 연속성(또는 불연속성)을 한 눈에 나타낼 수 있어 물리탐사나 지질조사 분야 외에도 토목이나 건설 또는 환경 분야에서 직접적으로 설계나 시공에 반영할 수 있어 정밀조사 수단으로 적극 활용되고 있다. 한편, 의학 분야에서 인체 내부를 관측하기 위해서는 인체 내부를 직접 수술하거나 내시경을 사용하여 디스플레이 장치로 들여다 볼 수 있다. 그러나 인체의 내부를 물리적인 장치를 삽입하거나 인체를 절개하지 않고서도 인체 내부를 들여다 볼 수 있게 하는 것이 의학 영상(medical imaging) 기술이다.
여기서는 물리탐사의 지하 영상화 기술과 의학 영상 기술의 상호보완 및 융합 차원에서 지하단면 영상법과 각종 의학 영상 기술에 대하여 알아보고자 한다. 지하단면 영상법은 파선 방정식(ray equation)에 기초를 둔 파선 토모그래피(ray tomography)와 파동 방정식(wave equation)에 기초를 둔 회절 토모그래피(diffraction tomography)로 분류할 수 있다(Lo et al., 1988). 또한 측정하는 물리량과 방법에 따라 탄성파 단면 영상법(seismic tomography), 전기비저항 단면 영상법(resistivity tomography) 등등으로 나눌 수 있다. 여기서 사용되고 있는 단면 영상법의 어원인 ‘tomography’는 그리스어로 ‘자른다’ 또는 ‘단면’을 나타내는 ‘tomos’와, ‘기록’을 뜻하는 ‘graphy’의 합성어로서 단면을 영상화하는 기술을 일컫는다. 이러한 의미에서 물리탐사 분야의 ‘지하단면 영상법’인 ‘geotomography’는 의학 분야에서 ‘컴퓨터 단층촬영’이라고 알려져 있는 ‘CT (computed tomography)’와 같은 뜻으로 사용되고 있음을 알 수 있다. 따라서 물리탐사에서 적용되고 있는 지하단면 영상법과 의학 영상에서 사용되고 있는 영상 기술은 하나의 뿌리를 가지고 있어 여러 면에서 공통점과 유사점이 많다고 할 수 있다. 실제로 CT 등의 의학 영상 기술은 지하단면 영상법과 그 원리가 개념적으로 서로 같다. 다만 실제 적용면에서 몇 가지 차이가 나는데, 가장 큰 차이는 측정 대상물을 둘러쌀 수 있는가 없는가이다(KSEG, 2011). 지하단면 영상법에서는 대상물을 둘러싸는 것이 현실적으로 불가능하기 때문에 자료를 얻는 데 한계가 있다. 그리고 인체 조직의 내부 구조나 물성 값은 그다지 큰 차이를 나타내지 않으나 지하단면 영상법은 지반구조가 다양할 뿐만 아니라 물성 값도 구조에 따라 다르며 경우에 따라서는 수십 배 이상의 차이가 나는 등 구조적이나 물성적인 측면에서 다른 점을 찾을 수 있다. 또한 인체 조직을 대상으로 하는 의학 영상 기술과 지하구조를 대상으로 하는 지하단면 영상법은 공간 해상도나 송신샘(source)의 특성(예를 들면 진동수) 등 여러 면에서 크고 작은 차이를 가지고 있다.
그럼에도 불구하고 이 글에서는 현재 의학 영상 분야에서 가장 많이 사용되고 있는 CT, 자기공명 영상(MRI, magnetic resonance imaging), 핵의학 영상(SPECT, PET) 그리고 초음파 영상(ultrasound imaging) 기술의 원리와 기법 등을 소개함으로써 물리탐사 분야와 의학 영상 분야의 융합 가능성을 들여다보고자 한다.
의학 영상 기술과 지하단면 영상법 들여다보기
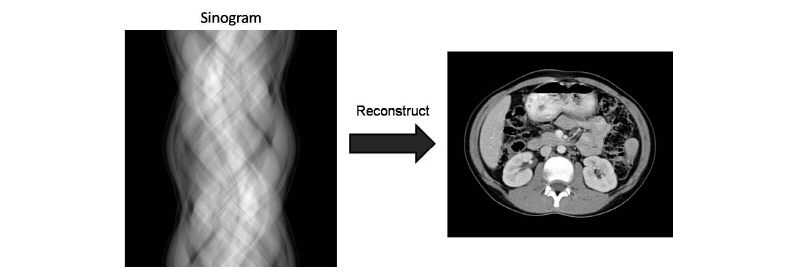
먼저 토모그래피(tomography)에 대해 알아보도록 하자. 토모그래피 영상은 대상체를 여러 각도로 투사하여 각 방향의 투과 에너지를 기록한다. 이때 각각의 투과 에너지는 특정 전파 경로에 대한 목적 대상체 변수(object parameter)의 적분 값으로 나타낸다. 예를 들면 X-선 CT의 경우, 신체에 직선으로 전파하는 X-선을 투사한 후 투과한 빛알(光子, photon)의 양은 X-선관(X-ray tube)과 검출기(detector)를 연결하는 직선을 따라 X-선 감쇠계수(attenuation coefficient)의 선 적분(line integral)으로 계산할 수 있다. 이 적분 값을 CT에서는 투영(projection)이라 하며, 이 투영으로부터 원래의 목적함수 또는 물성 분포를 찾아내는 과정을 영상 재구성(image reconstruction)이라 한다. 영상 재구성 방법에는 크게 ART (algebraic reconstruction technique), SIRT (simultaneous iterative reconstruction technique) 등의 반복법, 직접 푸리에 변환법(direct Fourier transform) 그리고 필터 역투영법(FBP, filtered backprojection) 등이 있다.
토모그래피 영상에 대한 수학적인 기초는 라돈 변환(Radon transform)이다. 이 수학적 원리를 이용하여 하운스필드(Godfrey Hounsfield)가 X-선 CT 진단법을 개발함으로써 생의학 영상(biomedical imaging) 분야의 획기적인 전기를 가져왔으며, 그 공로로 코맥(Allan Cormack)과 함께 1979년 노벨 의학 ․ 생리학상을 수상하였다.
마찬가지로 지하단면 영상법도 측정 자료와 대상체의 물리적 변수 사이의 선 적분 관계가 존재하는 지구물리학적 역해 문제(inverse problem)이다. 예를 들면 지하의 탄성파 전파 속도와 감쇠율은 측정된 전파 시간(travel time)과 진폭과 관련되어 있고, 고주파 전자기파의 투과 손실(trans-mission loss)은 지하의 전기적 성질과 연관되어 있으며, 이들은 모두 CT처럼 파선 경로에 따른 선 적분으로 표시된다. 따라서 파선 토모그래피에서 적용되는 영상 재구성법 역시 CT와 큰 차이가 없다. 물론 회절 토모그래피인 경우 파선 방정식 대신 파동 방정식을 적용하므로 역투영이 아닌 역전파(backpropagation) 과정을 도입하며 영상 기법 역시 CT에서 주로 사용하는 필터 역투영법이 아니라 필터 역전파법(FBPG, filtered backpropagation)을 사용하는 등 다소 차이는 있으나 전체적인 영상 재구성에 있어서는 그 맥락을 같이 한다(Devaney, 1984; Slaney et al., 1984; Song and Hyun, 1990).
지하단면 영상법을 뜻하는 ‘geotomography’는 ‘tomogra-phy’에 ‘땅’이나 ‘지구’를 의미하는 ‘geo’의 합성어로 말 그대로 시추공을 이용하여 물리탐사 방법으로 지하 단면의 물성 값을 영상화하는 기술이다. 이러한 지하단면 영상법은 비교적 새로운 기술로 1980년대에 실용화되었다. 역사적으로 살펴보면, 1920년대에 Gulf 해안에서 암염돔 위치를 찾기 위한 부채꼴 발파법(fan-shooting)이 토모그래피적인 탐사 방법이었고, Bois et al.(1972)은 시추공 사이(hole-to-hole) 탄성파 탐사를 수행하여 시추공 사이의 속도 분포를 영상화하였으며, 지진학 분야에서는 Aki et al.(1976)이 지진파 속도를 영상화했으나 토모그래피라 언급하지 않았다. 실질적인 지하단면 영상법은 Dines and Lytle(1979)이 시추공 전자탐사에 이를 적용한 것을 처음으로 여긴다. 그 후로 국내외적으로 여러 방면의 탐사 분야에 적용되고 있으며, 특히 탄성파 단면영상법(탄성파 토모그래피), 전기비저항 단면영상법(전기비저항 토모그래피), 지하투과 레이더 단면영상법(GPR tomography), 전자기파 단면영상법(전자기파 토모그래피, EM tomography) 등에서 성공적으로 적용되고 있다.
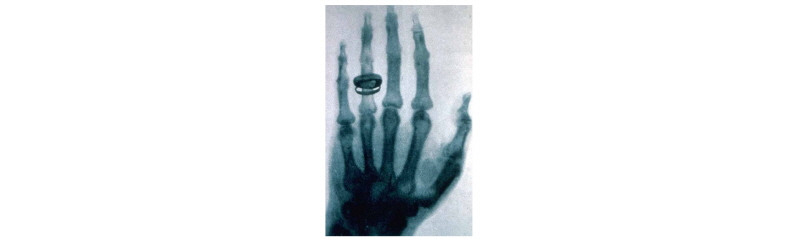
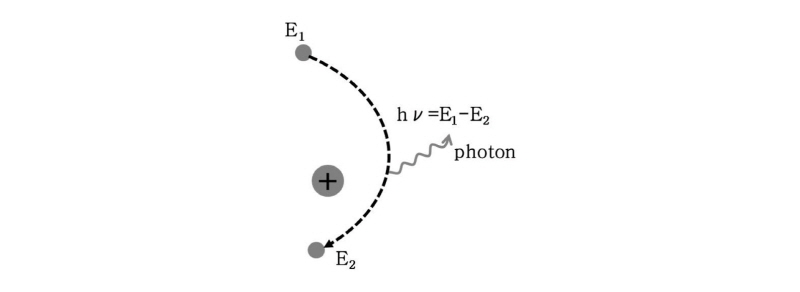
의학 영상 분야에서는 뢴트겐(Wilhelm Conrad Roentgen)이 X-선을 발견하고서 1895년 12월에 그의 부인의 손을 찍은 것이 최초의 의학 영상이다(Fig. 1).
의학 영상 기법에는 크게 투영(의학계에서는 투영보다 투사라는 말을 많이 사용함) 영상, 방출(emission) 영상, 자기공명(MRI) 영상, 반사(reflection) 영상 기법이 있다. 투영 영상 기법은 X-선이 인체를 투과할 때 인체의 조직에 따라 X-선의 감쇠가 다른 점을 이용하여 영상화하는 것으로 인체를 투과한 에너지를 사용하므로 투영 영상 기법이라 하며, 일반 방사선 촬영(conventional radiography)과 X-선 컴퓨터 단층촬영(X-ray CT)이 이에 속한다. 일반적으로 CT라 하면 X-선 CT를 의미한다. 방출 영상 기법은 핵의학(nuclear medicine) 분야의 영상 기법으로서, 핵의학이란 방사성 핵종의 특이한 성질을 이용하여 신체의 해부학적, 생리학적, 생화학적 상태를 진단하고 평가하는 의학 분야이다. 핵의학 영상 분야는 인체에 방사성 핵종으로 표지(label)된 화합물(방사성 추적자, radio tracer)을 통해 방사성을 인체 밖에서 측정하여 그 신호를 영상으로 변환한다. 방사성 추적자는 인체 내에서 자연적으로 흡수되는 정도에 따라 선택적으로 이동하여 화합물의 밀도에 따른 감마선을 방출한다. 이와 같이 방사선원이 인체 내에서 방출하는 방사선을 이용하는 핵의학 영상을 방출 영상 기법이라 한다. 이에는 단일광자 방출 컴퓨터 단층촬영(SPECT, single photon emission computed tomography)과 광전자 방출 단층촬영(PET, positron emission tomography) 등이 대표적이다. 그리고 자기공명 영상은 핵자기 공명(NMR, nuclear magnetic resonance) 현상을 이용하여 물질이나 인체 등의 내부 상태를 영상화하는 기법이다. 물질이나 인체 내의 수소 원자핵 즉 양성자는 자기모멘트(magnetic moment)를 가지고 있는데 이것이 외부 자기장과 상호작용하여 공명이 될 때 특정 진동수의 전자기파를 흡수하거나 방출하는 것이 핵자기 공명으로, 이러한 양상을 측정하여 영상화시킨 것이 자기공명 영상이다. 끝으로 초음파 영상(ultrasound imaging)은 초음파를 발사하고 인체의 조직에서 반사되어 돌아오는 에코(echo)들의 시간과 세기로부터 반사체의 위치(깊이)와 세기 정보를 수집하여 영상화 하는 반사 영상 기법이다.
지하단면 영상법과 의학 영상 기술은 각기 사용하는 물리적인 신호 샘(source)은 다르지만(Table 1), 영상을 구성하는 기법에서는 같거나 서로 비슷한 점이 많이 있으므로 이를 하나씩 살펴보도록 하자.
CT
X-선
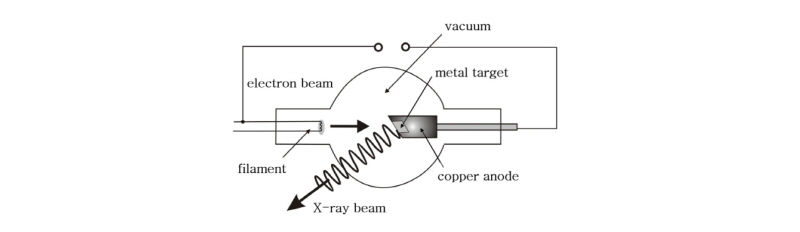
CT는 X-선관(X-ray tube)에서 발생한 X-선을 이용하여 영상을 얻는 방법이므로 X-선의 발생에 대하여 먼저 알아보도록 하자(Fig. 2). X-선은 1895년 뢴트겐이 발견하였으며, 그 당시에는 정체를 파악할 수 없어 X-선이라고 이름을 지었음은 이미 알고 있는 사실이다. X-선은 음극선(cathode ray)과는 달리 전자기장의 영향을 받지 않고, 매우 강한 투과력을 가지고 있으며, 원자의 궤도 전자를 전리시킬 수 있을 만큼 충분한 에너지를 가지고 있는 전리 방사선(ionizing radiation)에 속한다.
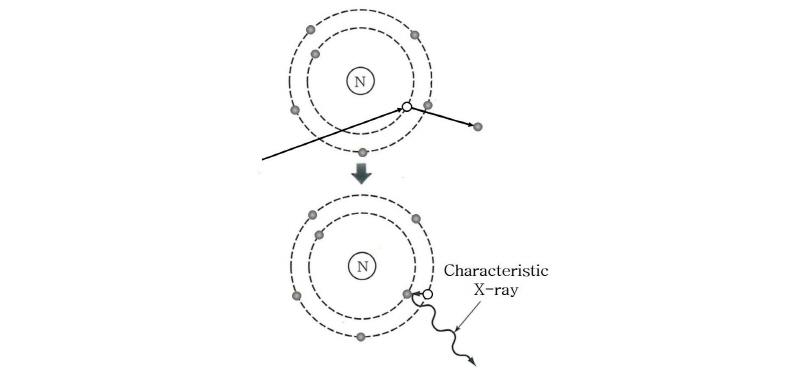
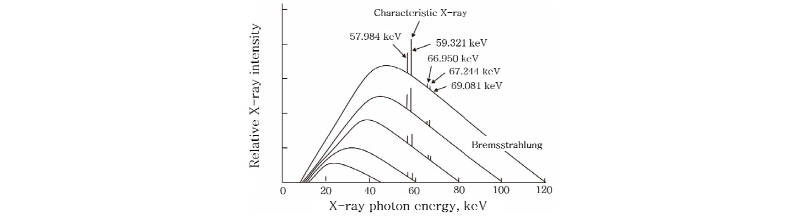
X-선은 가열된 음극(필라멘트)에서 방출되는 열전자(thermal electron)가 음극과 양극 사이에 걸린 높은 전압(30 100 kV)에 의해 가속되어 양극의 금속 표적에 충돌하면서 그 운동에너지가 변환되어 방출되는 전자기파이다. 높은 에너지의 전자가 양극의 표적에 충돌할 때 발생하는 X-선에는 2가지 종류가 있다. 하나는 전하를 띤 전자가 원자나 원자핵에서 받는 쿨롱 힘에 의해 갑자기 진로가 바뀌면서 감속될 때 전자가 가지고 있던 운동 에너지 일부가 빛알(光子)로 바뀌면서 발생되는 전자기파로 제동 복사선(Bremsstrahlung), 즉 제동 X-선(braking X-rays)이라 한다(Fig. 3). 다른 하나는 가속 전자가 표적을 때릴 때 표적 원자의 내부 전자를 전리(ionizing) 또는 여기(excitation)시켜서 그 자리에 빈자리(hole)를 만들게 되고 그 빈자리를 메우려고 바깥 궤도의 전자가 이동하면서 발생하는 특성 방사선(characteristic radiation), 즉 특성 X-선(characteristic X-rays)이다(Fig. 4). 이 중 제동 X-선은 연속적인 스펙트럼 분포를 보이는 반면에, 특성 X-선은 표적 물질에 따라 다르지만, 공통적으로 몇 개의 불연속적인 에너지 스펙트럼을 나타내는 특징을 가지고 있다(Fig. 5).
100 kV)에 의해 가속되어 양극의 금속 표적에 충돌하면서 그 운동에너지가 변환되어 방출되는 전자기파이다. 높은 에너지의 전자가 양극의 표적에 충돌할 때 발생하는 X-선에는 2가지 종류가 있다. 하나는 전하를 띤 전자가 원자나 원자핵에서 받는 쿨롱 힘에 의해 갑자기 진로가 바뀌면서 감속될 때 전자가 가지고 있던 운동 에너지 일부가 빛알(光子)로 바뀌면서 발생되는 전자기파로 제동 복사선(Bremsstrahlung), 즉 제동 X-선(braking X-rays)이라 한다(Fig. 3). 다른 하나는 가속 전자가 표적을 때릴 때 표적 원자의 내부 전자를 전리(ionizing) 또는 여기(excitation)시켜서 그 자리에 빈자리(hole)를 만들게 되고 그 빈자리를 메우려고 바깥 궤도의 전자가 이동하면서 발생하는 특성 방사선(characteristic radiation), 즉 특성 X-선(characteristic X-rays)이다(Fig. 4). 이 중 제동 X-선은 연속적인 스펙트럼 분포를 보이는 반면에, 특성 X-선은 표적 물질에 따라 다르지만, 공통적으로 몇 개의 불연속적인 에너지 스펙트럼을 나타내는 특징을 가지고 있다(Fig. 5).
|
Fig. 3. Bremsstrahlung produced by a high-energy electron deflected in the electric field of an atomic nucleus. |
여기서 전자의 운동에너지와 X-선 스펙트럼의 파장에 대해 살펴보자. X-선관의 음극에서 나온 전자(e)를 일정한 전압(V)으로 가속시켜 X-선을 발생시키는 경우, 전자가 얻는 운동에너지(E)는
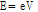
와 같다. 이 운동에너지는 제동 복사선처럼 감속하면서 에너지를 잃거나, 특성 X-선처럼 빈자리를 메우는 과정에서 발생하는 에너지 준위의 차만큼의 에너지가 X-선 에너지로 변환된다.
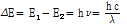
만일 이 운동에너지가 금속판에 충돌할 때 모두 X-선 에너지로 변환된다면
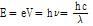
이므로 X-선의 파장은 최단 파장으로서(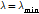 ) 다음과 같이 구할 수 있다.
) 다음과 같이 구할 수 있다.
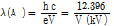
위 식들에서 나타나는 변수들 중, e는 전자의 전하량으로 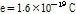 , h는 플랑크 상수로
, h는 플랑크 상수로 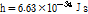 , c는 빛의 속도로
, c는 빛의 속도로 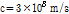 ,
, 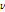 는 진동수이다. 따라서 이와 같은 원리로 발생하는 X-선의 에너지는 가속 전압에 의해 가속된 전자의 운동에너지에 해당하며 높은 가속 전압일수록 짧은 파장의 X-선이 발생한다.
는 진동수이다. 따라서 이와 같은 원리로 발생하는 X-선의 에너지는 가속 전압에 의해 가속된 전자의 운동에너지에 해당하며 높은 가속 전압일수록 짧은 파장의 X-선이 발생한다.
영상 재구성
라돈 변환
토모그래피 영상의 수학적 기초 원리는 라돈 변환으로 Johann Radon에서 그 이름을 따왔다. 라돈 변환을 통하여 투영 자료를 얻게 되며 이를 사이노그램(sinogram)이라 한다. 이는 sin 곡선의 형태로 분포하기 때문에 붙여진 이름이다. 이로부터 원래의 대상체를 구하기 위해서는 역 라돈변환(inverse Radon transform)을 하여 구할 수 있다(Fig. 6).
| ||
Fig. 6. (a) Shepp-Logan phantom (The Shepp–Logan phantom is a standard test image created by Shepp and Logan (1974), (b) Radon transform (sinogram), (c) inverse Radon transform. | ||
그러면 라돈 변환에 대해 알아보자. 영상 처리(image processing)의 목적은 3D 대상체 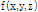 의 절편(slice)
의 절편(slice) 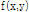 를 재구성하고자 하는 것이며, 목적(대상체) 함수
를 재구성하고자 하는 것이며, 목적(대상체) 함수 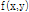 를 재구성하고자 하는 데 필요한 자료는 파선(ray)을 따른 적분 값의 집합으로 구성된다. 여기서 파선이란 단면을 지나는 선을 말하며, 파선을 따라
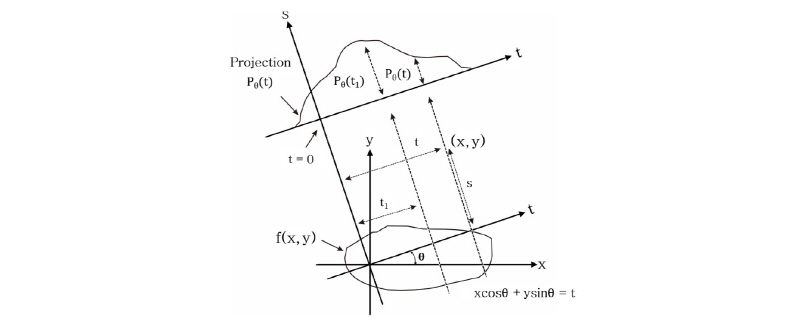
를 재구성하고자 하는 데 필요한 자료는 파선(ray)을 따른 적분 값의 집합으로 구성된다. 여기서 파선이란 단면을 지나는 선을 말하며, 파선을 따라 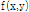 를 적분하는 것을 파선 적분(ray integral)이라 하며, 이들 파선 적분의 집합을 투영이라 한다. Fig. 7과 같이 원점으로부터 임의의 파선까지의 거리를
를 적분하는 것을 파선 적분(ray integral)이라 하며, 이들 파선 적분의 집합을 투영이라 한다. Fig. 7과 같이 원점으로부터 임의의 파선까지의 거리를 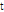 , x축과 이루는 각을
, x축과 이루는 각을 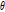 라 하면
라 하면
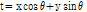
이다. 그러면 평행 투영(parallel projection) 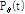 은 파선 적분을 사용하여 다음과 같이 쓸 수 있다.
은 파선 적분을 사용하여 다음과 같이 쓸 수 있다.
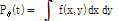
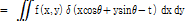 (1)
(1)
|
Fig. 7. Illustration of the variables for parallel projection data. The function |
여기서 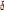 는 디랙 델타 함수(Dirac delta function)이다.
는 디랙 델타 함수(Dirac delta function)이다.
만약 x축을 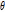 만큼 회전시킨 축을 t축, 이와 수직인 축을 s축이라 하면
만큼 회전시킨 축을 t축, 이와 수직인 축을 s축이라 하면
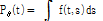
가 된다. 이때 연속적인 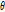 값에 대해 얻어진
값에 대해 얻어진 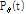 를
를 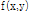 의 라돈 변환이라 한다. 이것이 곧 투영이다. 한 장의 단면도를 얻기 위해서는 여러 각도에서 투영을 얻어야 하고 이들을 각 각도에 따라 쌓아 놓은 것을 사이노그램이라 한다(Fig. 8). 이렇게 얻어진 사이노그램을 역 라돈변환을 하면 다시 원래 영상으로 재구성할 수 있게 된다.
의 라돈 변환이라 한다. 이것이 곧 투영이다. 한 장의 단면도를 얻기 위해서는 여러 각도에서 투영을 얻어야 하고 이들을 각 각도에 따라 쌓아 놓은 것을 사이노그램이라 한다(Fig. 8). 이렇게 얻어진 사이노그램을 역 라돈변환을 하면 다시 원래 영상으로 재구성할 수 있게 된다.
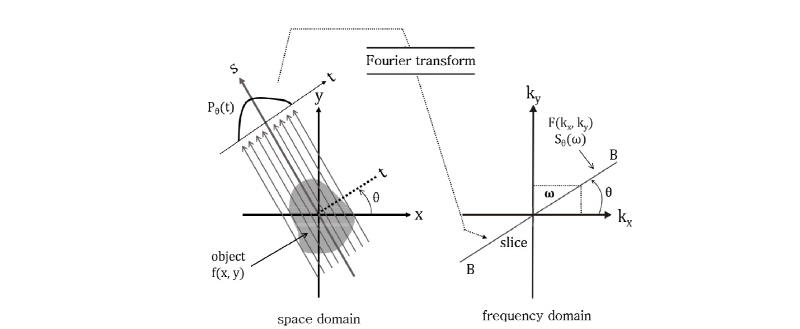
투영 정리
투영 정리(projection slice theorem)란 Fig. 9에서 보는 바와 같이, “각 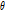 에서 취해진 영상
에서 취해진 영상 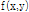 의 평행 투영
의 평행 투영 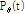 의 푸리에 변환(FT)
의 푸리에 변환(FT) 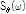 는
는 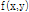 의 2D FT인
의 2D FT인 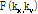 의 절편과 같다.”라는 정리이다(Kak and Roberts, 1986). 이때 절편은
의 절편과 같다.”라는 정리이다(Kak and Roberts, 1986). 이때 절편은 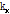 축과
축과 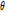 각을 이룬다. 다시 말해
각을 이룬다. 다시 말해 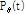 의 FT는 Fig. 9의 BB 직선을 따라
의 FT는 Fig. 9의 BB 직선을 따라 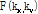 의 값을 주게 된다. 이는 극 좌표계
의 값을 주게 된다. 이는 극 좌표계 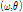 로 일반화시켜 다음과 같이 쓸 수 있다.
로 일반화시켜 다음과 같이 쓸 수 있다.
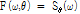 .
.
여기서, 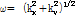 .
.
이 식이 투영 정리를 나타내는 식이다. 이를 수학적으로 살펴보면 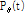 의 1D FT는
의 1D FT는
 (2)
(2)
이다. 식 (1)의 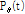 를 식 (2)에 대입하면 다음과 같이 된다.
를 식 (2)에 대입하면 다음과 같이 된다.
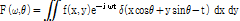
이는 다시 다음과 같이 쓸 수 있다.
 (3)
(3)
그리고 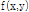 의 2D FT를 다음과 같이 정의하고
의 2D FT를 다음과 같이 정의하고
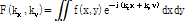 (4)
(4)
식 (3)과 (4)를 비교해보면 식 (3)은 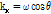 와
와 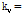
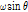 에서의
에서의 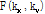 를 계산하는 것과 같다. 즉 x축과
를 계산하는 것과 같다. 즉 x축과 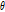 각을 이루는 방향으로의 투영
각을 이루는 방향으로의 투영 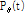 의 1D FT는
의 1D FT는 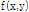 의 2D FT의
의 2D FT의 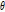 방향의 절편 상의 값에 대응한다. 따라서
방향의 절편 상의 값에 대응한다. 따라서 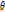 를 0에서
를 0에서 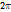 까지 변화시킬 때의
까지 변화시킬 때의 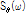 값을
값을 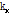 -
-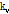 평면에 도시함으로써
평면에 도시함으로써 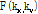 값을 알 수 있으므로, 이것의 2D 역 푸리에변환에 의해 원래 함수
값을 알 수 있으므로, 이것의 2D 역 푸리에변환에 의해 원래 함수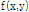 를 구할 수 있다. 이것이 토모그래피에 의한 역산의 기본 원리이다. 이론상 충분히 많은 투영을 얻어 이로부터 직접 역 푸리에변환을 하면 목적 대상체를 영상으로 재구성할 수 있다. X-선 CT 경우 검사 대상체의 X-선 감쇠계수가, 탄성파 토모그래피인 경우는 탄성파의 속도 분포 또는 그 역수인 느리기(slowness)가
를 구할 수 있다. 이것이 토모그래피에 의한 역산의 기본 원리이다. 이론상 충분히 많은 투영을 얻어 이로부터 직접 역 푸리에변환을 하면 목적 대상체를 영상으로 재구성할 수 있다. X-선 CT 경우 검사 대상체의 X-선 감쇠계수가, 탄성파 토모그래피인 경우는 탄성파의 속도 분포 또는 그 역수인 느리기(slowness)가 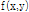 가 된다.
가 된다.
필터 역투영법(FBP)
먼저 2D 역 푸리에변환을 다음과 같이 정의하자.
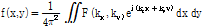
여기서 직교 좌표계인 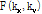 를 극 좌표계
를 극 좌표계 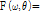
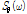 로 좌표 변환을 하면 다음과 같이 쓸 수 있다.
로 좌표 변환을 하면 다음과 같이 쓸 수 있다.

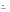
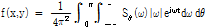 (5)
(5)
여기서, 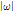 는 좌표 변환에 따른 야코비 행렬식(Jacobian determinant)이다.
는 좌표 변환에 따른 야코비 행렬식(Jacobian determinant)이다.
위 식 (5)는 필터 역투영 형태임을 나타내기 위해서 두 개의 다른 계산 과정으로 분리할 필요가 있다. 즉, 첫 과정이 필터링(filtering)이고 두 번째 과정이 역투영이다. 이를 각각 수학적으로 표현하면 다음과 같다.
① 투사각 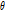 에서의 투영 자료의 필터링 과정
에서의 투영 자료의 필터링 과정
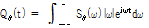
여기서 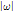 는 진동수 필터로 푸리에 공간의 모양을 따서 램프 필터(ramp filter)라고 한다.
는 진동수 필터로 푸리에 공간의 모양을 따서 램프 필터(ramp filter)라고 한다.
② 원래의 목적 함수(object function)를 얻기 위한 역투영 과정
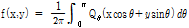
이와 같이 투영 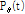 의 푸리에 변환
의 푸리에 변환 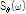 는 진동수 필터(frequency filter)
는 진동수 필터(frequency filter) 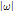 와 곱해진 뒤 역변환 된다. 역변환 후 필터링 된 투영을 거꾸로 투영한다. 이 작업은 t를
와 곱해진 뒤 역변환 된다. 역변환 후 필터링 된 투영을 거꾸로 투영한다. 이 작업은 t를 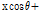
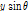 로 대체함으로써 이루어진다. 그 후 필터링 된 역투영 자료를 모두 합산한다. 이러한 재구성 방법을 필터 역투영법이라 한다.
로 대체함으로써 이루어진다. 그 후 필터링 된 역투영 자료를 모두 합산한다. 이러한 재구성 방법을 필터 역투영법이라 한다.
필터 역투영법은 2D 대상체에서 얻은 여러 각도의 투영을 이용하여 목적 함수 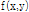 를 알아내는 방법이다. 이때 투영
를 알아내는 방법이다. 이때 투영 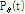 에서 주어진
에서 주어진 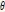 와 t에서 붓으로 긋듯이
와 t에서 붓으로 긋듯이 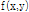 에 동일한 값을 부여하고 이 과정을 모든 각도에 대해 적용하고 나면 원래의
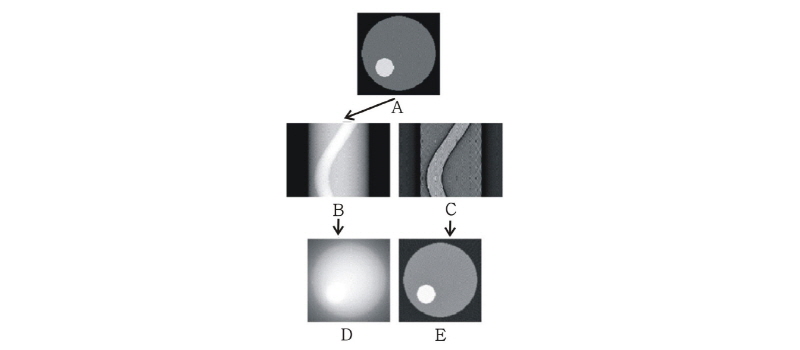
에 동일한 값을 부여하고 이 과정을 모든 각도에 대해 적용하고 나면 원래의 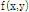 가 퍼져 보이는 효과 즉 성상 효과(star artifact)가 있게 된다. Fig. 10은 필터링하여 얻은 재구성 영상을 필터링 하지 않은 영상과 비교하여 보여주고 있다.
가 퍼져 보이는 효과 즉 성상 효과(star artifact)가 있게 된다. Fig. 10은 필터링하여 얻은 재구성 영상을 필터링 하지 않은 영상과 비교하여 보여주고 있다.
|
Fig. 10. A: object function f(x,y), B: original sinogram, C: filtered sinogram, D: reconstructed image of B, E: reconstructed image of C (Kim, 2010). |
여기서 잠깐 곱말기(convolution)를 이용한 곱말기 역투영법(CBP, convolution backprojection)을 소개하자. 푸리에 변환의 곱말기 정리에 의해 식 (5)는 다음과 같이 쓸 수 있다.
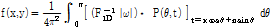
여기서 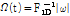 라 하면
라 하면
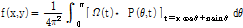
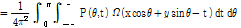
이다. 이를 CBP 방정식이라 한다. 많은 CT 스캐너들이 FBP보다 CBP를 활용하고 있다.
CT와 선형 감쇠계수
CT는 X-선 빔을 인체에 투과시킬 때 감소되는 량을 검출하여(detect) 영상을 구성한다. 이때 통과하는 대상체(여기서는 몸속의 조직)에 따라 단위길이 당 감쇠되는 량이 다른데 이를 선형 감쇠계수(linear attenuation coefficient, 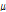 )라고 한다. 균질한 각 조직을 통과한 X-선 빔의 세기(intensity)는 다음과 같이 구할 수 있다.
)라고 한다. 균질한 각 조직을 통과한 X-선 빔의 세기(intensity)는 다음과 같이 구할 수 있다.
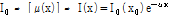 (6)
(6)
여기서, 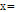 조직의 두께.
조직의 두께. 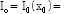 입사 X-선 빔의 세기.
입사 X-선 빔의 세기.
일반적으로, 측정 때 각기 다른 선형 감쇠계수를 가진 여러 조직을 한꺼번에 관통하게 되므로 식 (6)을 다음과 같이 쓸 수 있다.
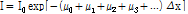
만약 대상체가 균질하지 않다고 생각하면 선형 감쇠계수는 조직의 두께 x에 따라 변하므로 다음과 같은 적분 식으로 나타내어야 한다.
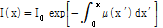
그리고 X-선 빔의 세기가 2차원적으로 감쇠된다면 선형 감쇠계수도 2차원 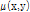 로 나타내며 이는 목적 함수와 같다. 즉,
로 나타내며 이는 목적 함수와 같다. 즉,
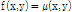
따라서 어떤 좌표 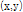 에서 특정 선형 감쇠계수
에서 특정 선형 감쇠계수 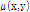 를 가진다고 하면 앞의 식 (1)의 라돈 변환으로 투영을 다음과 같이 쓸 수 있다.
를 가진다고 하면 앞의 식 (1)의 라돈 변환으로 투영을 다음과 같이 쓸 수 있다.
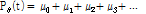
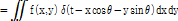
이를 여러 투사각에 대해 계산하여 그려보면 사이노그램을 얻을 수 있다. 이렇게 얻어진 사이노그램을 역 라돈변환을 통하여 우리가 원하는 실제 영상으로 복원하게 된다(Fig. 11).
머리말
방사성 동위원소를 이용한 진단 및 치료 분야를 핵의학(nuclear medicine)이라 한다. 핵의학 분야는 동위원소를 이용하여 각종 혈액 및 체액에 존재하는 미량 물질의 농도를 측정하는 체외 검사(in vitro)와 방사선 의약품을 몸속에 주사한 후 방사성 원소의 방사성 붕괴에 의해 방출되는 전리 방사선으로 인체 분자의 분포를 결정하는 체내 검사(in vivo)로 나누어 볼 수 있다.
핵의학 영상법은 다양한 생리학적, 생화학적 기능을 알아 볼 수 있도록 해 주는 방사성 추적자(radio tracer)를 환자에게 투여한 후 이들의 분포를 영상화함으로써 생체의 생화학적 변화나 기능상의 문제를 평가하는 기능성 영상 진단법이다. 방사성 핵종에서 방출된  선이 탈륨활성요드화나트륨[NaI(Tl)] 결정과 반응하여 생성된 빛은 광전음극(photocathode)을 통과하면서 전자로 바뀌고 이어 광전자 증배관(photomultiplier)을 거쳐 증폭되어 영상을 얻는다. 이러한 영상을 얻기 위하여 단일 광자를 내는 동위원소를 이용하느냐 또는 양전자를 내는 동위원소를 이용하느냐에 따라 단일광자 방출 컴퓨터 단층촬영(SPECT, single photon emission computed tomography)과 양전자 방출 단층촬영(PET, positron emission tomography)으로 나눌 수 있다. SPECT는 몸속에 투여된 99mTc로 대표되는 단일 광자(
선이 탈륨활성요드화나트륨[NaI(Tl)] 결정과 반응하여 생성된 빛은 광전음극(photocathode)을 통과하면서 전자로 바뀌고 이어 광전자 증배관(photomultiplier)을 거쳐 증폭되어 영상을 얻는다. 이러한 영상을 얻기 위하여 단일 광자를 내는 동위원소를 이용하느냐 또는 양전자를 내는 동위원소를 이용하느냐에 따라 단일광자 방출 컴퓨터 단층촬영(SPECT, single photon emission computed tomography)과 양전자 방출 단층촬영(PET, positron emission tomography)으로 나눌 수 있다. SPECT는 몸속에 투여된 99mTc로 대표되는 단일 광자( 선) 방출핵종으로부터 방출되는
선) 방출핵종으로부터 방출되는  선을 검출하는 장치이며, PET는 양전자 방출 핵종으로부터 방출된 양전자가 전자와 만나 쌍소멸하면서 방출되는 한 쌍의 511 keV
선을 검출하는 장치이며, PET는 양전자 방출 핵종으로부터 방출된 양전자가 전자와 만나 쌍소멸하면서 방출되는 한 쌍의 511 keV 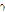 선을 이용하는 장치이다. 이들 장치들은 평면 영상뿐만 아니라 목적에 따라서는 해당하는 방사성 의약품을 환자에게 투여한 후 감마카메라(gamma camera)를 인체 주위로 회전시키며 여러 방향의 2차원 투영을 얻고, 이를 사이노그램 형태로 변환한 후 영상 재구성 기법을 적용하면 CT나 MRI와 마찬가지로 체내 단층영상(tomogram)이나 3차원 영상을 얻을 수 있다.
선을 이용하는 장치이다. 이들 장치들은 평면 영상뿐만 아니라 목적에 따라서는 해당하는 방사성 의약품을 환자에게 투여한 후 감마카메라(gamma camera)를 인체 주위로 회전시키며 여러 방향의 2차원 투영을 얻고, 이를 사이노그램 형태로 변환한 후 영상 재구성 기법을 적용하면 CT나 MRI와 마찬가지로 체내 단층영상(tomogram)이나 3차원 영상을 얻을 수 있다.
핵의학 영상 속의 물리
방사성 붕괴
원자를 구성하는 양성자, 중성자, 전자들의 각 질량의 합은 원자의 실제 질량보다 크다. 그 차이를 질량 결손(mass defect)이라 한다. 예를 들어, 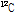 는 6개의 양성자와 중성자 그리고 전자들을 가지고 있다. 원자의 질량은 원자질량 단위(unified atomic mass unit) u로 표현되며, 1 u는 정확히
는 6개의 양성자와 중성자 그리고 전자들을 가지고 있다. 원자의 질량은 원자질량 단위(unified atomic mass unit) u로 표현되며, 1 u는 정확히 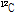 원자 질량의 1/12이다. 양성자는 1.007276 u, 중성자는 1.008665 u, 전자는 0.000548 u이므로
원자 질량의 1/12이다. 양성자는 1.007276 u, 중성자는 1.008665 u, 전자는 0.000548 u이므로 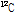 의 질량 결손은 6x(1.008665+1.007276+0.000548)-12=0.098934 u이다. 그리고 Einstein의 질량-에너지 등가원리
의 질량 결손은 6x(1.008665+1.007276+0.000548)-12=0.098934 u이다. 그리고 Einstein의 질량-에너지 등가원리 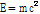 으로부터 원자로부터의 질량 결손과 동일한 양의 에너지 손실이 생긴다. 이 식에 따르면 1 u=931 MeV이다. 여기서 전자볼트(eV)는 진공에서 전자 1개가 1 V의 전압에 의해 가속되어 움직일 때 얻게 되는 운동 에너지의 양으로 정의된다.
으로부터 원자로부터의 질량 결손과 동일한 양의 에너지 손실이 생긴다. 이 식에 따르면 1 u=931 MeV이다. 여기서 전자볼트(eV)는 진공에서 전자 1개가 1 V의 전압에 의해 가속되어 움직일 때 얻게 되는 운동 에너지의 양으로 정의된다.
한편 원자핵으로부터 그 구성단위인 핵자(양성자와 중성자)를 분리하려면 외부로부터 상당한 에너지를 가해야 하는데 이를 결합 에너지(binding energy)라 한다. 일반적으로 무거운 핵종은 더 많은 질량 결손을 보이고 그 결과 더 큰 결합 에너지를 가지지만 핵자 1개에 대한 평균 결합에너지를 고려하면 질량수가 큰 원자핵이 반드시 큰 것은 아니다. 질량수가 중간 정도인 철(Fe)의 원자핵(질량수 56)이 가장 크고, 철보다 무거운 원자핵은 무거워질수록, 철보다 가벼운 원자핵은 가벼워질수록 평균 결합 에너지가 작아지게 된다.
결국 방사성 붕괴(radiation decay)라는 것은 불안정한 원자가 안정화되기 위해 핵 내의 핵자를 재배열하는 자발적 과정으로서, 원자가 핵자 당 결합 에너지를 증가시키면서 안정화되는 과정으로 볼 수 있다.
전리 방사선
방사성 붕괴 과정에서 전리 방사선(이온화 방사선, ionizing radiation)이 방출되는데, 전리 방사선에는 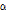 ,
, 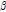 입자, 양전자(positron) 등의 입자 방사선(particulate radiation)과 X선,
입자, 양전자(positron) 등의 입자 방사선(particulate radiation)과 X선, 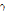 선 등의 전자기파 방사선(EM radiation)이 있다. 의학 영상에서는 양전자와 X선,
선 등의 전자기파 방사선(EM radiation)이 있다. 의학 영상에서는 양전자와 X선, 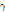 선을 이용한다. 이중 X-선에 대해서는 앞에서 기술한 바가 있으므로 여기서는 양전자 방출과 관련된
선을 이용한다. 이중 X-선에 대해서는 앞에서 기술한 바가 있으므로 여기서는 양전자 방출과 관련된 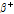 붕괴(
붕괴(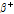 -decay)와
-decay)와 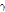 선 방출과 관련된 핵이성체 전이(isomeric transition)에 대해 알아보도록 하자.
선 방출과 관련된 핵이성체 전이(isomeric transition)에 대해 알아보도록 하자.
① 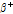 붕괴: 양성자 대 중성자 비율이 작은 핵종은 불안정하여 안정된 상태로 변하기 위해서 전자 포획(electron capture) 또는
붕괴: 양성자 대 중성자 비율이 작은 핵종은 불안정하여 안정된 상태로 변하기 위해서 전자 포획(electron capture) 또는 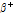 붕괴 과정을 거쳐 양성자가 중성자로 변환하면서 핵종이 안정화된다.
붕괴 과정을 거쳐 양성자가 중성자로 변환하면서 핵종이 안정화된다. 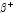 붕괴는 다음과 같이 쓸 수 있다.
붕괴는 다음과 같이 쓸 수 있다.
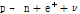
여기서 볼 수 있듯이 양성자(p)가 중성자(n)로 바뀌면서 양전자(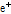 )와 중성미자(neutrino,
)와 중성미자(neutrino, 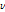 )를 방출한다.
)를 방출한다.
② 핵이성체 전이: 원자번호와 질량수는 같으나 에너지 준위가 다른 방사성 핵종(핵이성체, nuclear isomer)은 원자번호와 질량수가 같은 더 안정적인 핵종으로 붕괴될 수 있다. 이러한 경우 일반적으로 에너지 준위가 높은 준안정 상태(metastable state)에서 보다 낮은 에너지 상태로 전이하면서 여분의 에너지는 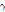 선의 형태로 방출한다. 이를 핵이성체 전이라 한다. SPECT에 자주 사용되는 동위원소 Tc-99m (technetium)의 핵이성체 전이 예를 살펴보자.
선의 형태로 방출한다. 이를 핵이성체 전이라 한다. SPECT에 자주 사용되는 동위원소 Tc-99m (technetium)의 핵이성체 전이 예를 살펴보자.
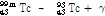
여기서 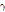 는
는 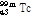 이
이 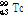 로 붕괴될 때 방출되는
로 붕괴될 때 방출되는 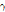 선 빛알을 나타내고
선 빛알을 나타내고 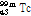 에서 ‘m’은 준안정 상태를 나타낸다.
에서 ‘m’은 준안정 상태를 나타낸다.
SPECT
개요
동위원소의 의학적 이용을 위한 동위원소 분포도의 영상화는 1951년 Benedict 등이 개발한 갑상선의 아이오딘(I) 분포를 검사하는 섬광 검출기(scintillation detector)를 자동화하면서부터였다. 그 후 Anger에 의한 감마카메라의 탄생과 Kuhl에 의한 방출 단층촬영 장치 개념이 소개되면서 SPECT와 PET로 발전한다. 오늘날과 같은 SPECT는 1976년 Keys에 의해 처음으로 개발되었고, 오늘날에 이르기까지 계속 발전하고 있다(Kim, 2010).
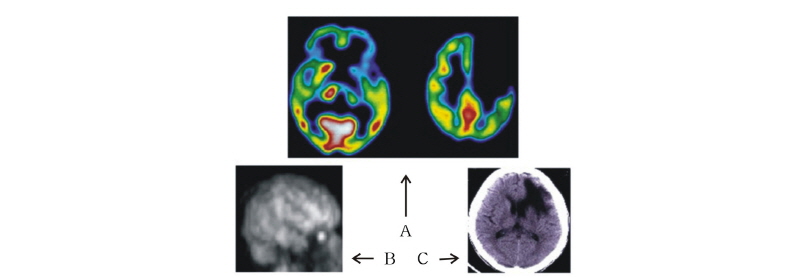
SPECT는 인체 내 기관의 기능을 검사하기 위하여 Tc-99m과 같은 방사성 동위원소를 주사한 다음 체내에서 방출되는 방사선을 감마카메라로 수집하여 컴퓨터를 통해 2D 또는 3D 영상을 얻는다. 기존의 CT 또는 MRI와 가장 큰 차이는 이들이 해부학적인 정보를 제공하는 반면에 SPECT는 기능적 정보를 제공한다는 것이다. 최근엔 SPECT를 CT와 MRI와 결합한 시스템에 대한 연구가 활발하게 진행되고 있다(예: SPECT/CT).
Fig. 12는 [Tc-99m] ECD를 환자에게 주사한 뒤 뇌에 혈류 공급이 제대로 되고 있는가를 검사한 대표적인 SPECT 뇌 영상이다. 이 그림으로부터 CT (C)는 해부학적 정보를 제공하고, SPECT (A와 B)는 혈류 공급이 많은 부위(밝은 색)와 혈류 공급이 전혀 없는 어두운 색 부위를 구분하여 뇌의 기능에 대한 정보를 제공함을 볼 수 있다.
투영 자료 획득과 영상 재구성
체내에 방사성 동위원소가 분포된 곳에서는 입체각(solid angle)  방향으로 전리 방사선(
방향으로 전리 방사선(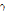 선 또는 X선)이 방출된다. SPECT는 검출기를 이용하여 여러 각도에서 투영을 얻어 2D 또는 3D로 동위원소의 분포도를 나타낸다. 주어진 각도에서 투영을 얻을 때 전리 방사선의 위치와 에너지 정보를 알아내기 위해 조준기(collimator)를 이용한다. 이때 전리 방사선을 검출 가능한 신호로 바꾸어주기 위해 흔히 NaI(Tl)과 같은 섬광체(scintillator)를 이용한다. 섬광체는 전리 방사선과 작용하여 가시광선을 발생시키며, 이들 가시광선은 광전자 증배관을 통하여 전기적인 신호인 광전자로 바뀌고 검출 가능한 신호의 크기로 커진다. 이들 신호를 신호처리한 뒤 컴퓨터 모니터에 영상으로 표시한다.
선 또는 X선)이 방출된다. SPECT는 검출기를 이용하여 여러 각도에서 투영을 얻어 2D 또는 3D로 동위원소의 분포도를 나타낸다. 주어진 각도에서 투영을 얻을 때 전리 방사선의 위치와 에너지 정보를 알아내기 위해 조준기(collimator)를 이용한다. 이때 전리 방사선을 검출 가능한 신호로 바꾸어주기 위해 흔히 NaI(Tl)과 같은 섬광체(scintillator)를 이용한다. 섬광체는 전리 방사선과 작용하여 가시광선을 발생시키며, 이들 가시광선은 광전자 증배관을 통하여 전기적인 신호인 광전자로 바뀌고 검출 가능한 신호의 크기로 커진다. 이들 신호를 신호처리한 뒤 컴퓨터 모니터에 영상으로 표시한다.
SPECT의 영상 원리는 CT와 마찬가지로 라돈 변환으로부터 출발한다. 따라서 이 부분은 CT를 참조해주기 바란다. SPECT에서는 될수록 많은 각도에서 그리고 좁은 간격으로 투영을 얻는다면, 인체에 아무런 고통이나 상처를 내지 않는(noninvasive) 방법으로 살아있는 부위의 동위원소 분포를 잘 알아낼 수 있다. 그러나 너무 많은 각도에서 너무 좁은 간격으로 투영을 얻는다면 충분한 크기의 신호를 얻기 어렵고, 영상 재구성할 때 시간이 너무 오래 걸리는 단점이 있다. 따라서 최적의 각도와 간격을 정하는 것이 필요하며 대개 뇌 영상의 경우 128×128 행렬(matrix)에 120개의 각도, 심장 영상의 경우 64×64 행렬에 60∼120개의 각도에서 투영을 얻는다.
PET
개요
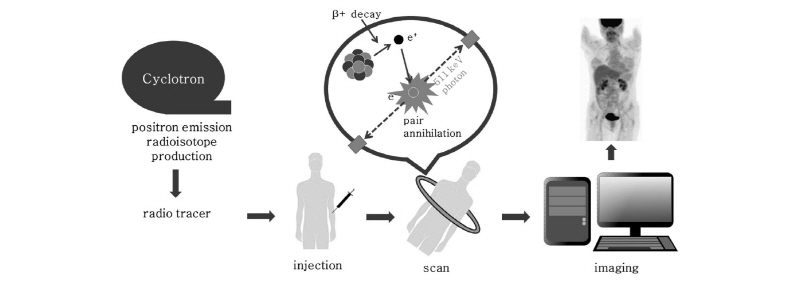
양전자 단층촬영(PET)은 양전자(positron)를 방출하는 방사성 의약품을 이용하여 인체에 대한 생리적, 화학적, 기능적 영상을 3차원으로 나타낼 수 있는 핵의학 영상법 중 하나이다.
PET 과정을 잠깐 살펴보자(Fig. 13). PET에 사용되는 중요한 양전자 방출 동위원소로서 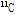 ,
, 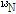 ,
, 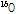 ,
, 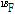 등이 있는데, 이러한 원소들은 생체 물질의 주요 구성 성분이기 때문에 이들을 이용하여 특정 생화학적, 기능적 변화를 반영하는 추적자인 방사성 의약품을 만들 수 있다. 한 예로, 가장 흔히 쓰이는 방사성 의약품이 불화디옥시 포도당(18F-FDG, fluorodeoxyglucose)이다. 이러한 양전자를 방출하는 동위원소가 붙은 방사성 의약품을 몸속에 주입하면 방사성 의약품이 신체의 생화학적, 기능적 변화에 의해 몸속 특정 부위에 축적이 된다. 예를 들면 앞의 18F-FDG는 포도당 유사 물질이어서, 이를 주사하면 세포가 포도당을 에너지원으로 흡수한다. 특히 암세포는 정상의 조직보다 에너지를 많이 소비하기 때문에 포도당을 많이 흡수한다. 따라서 암과 같이 포도당 대사가 항진된 부위에 많이 모이게 된다. 반대로 뇌의 혈류량이 감소된 부분에서는 당연히 흡수량이 적어진다. 그 다음 PET 장비를 이용하여 몸속에서 방출되는
등이 있는데, 이러한 원소들은 생체 물질의 주요 구성 성분이기 때문에 이들을 이용하여 특정 생화학적, 기능적 변화를 반영하는 추적자인 방사성 의약품을 만들 수 있다. 한 예로, 가장 흔히 쓰이는 방사성 의약품이 불화디옥시 포도당(18F-FDG, fluorodeoxyglucose)이다. 이러한 양전자를 방출하는 동위원소가 붙은 방사성 의약품을 몸속에 주입하면 방사성 의약품이 신체의 생화학적, 기능적 변화에 의해 몸속 특정 부위에 축적이 된다. 예를 들면 앞의 18F-FDG는 포도당 유사 물질이어서, 이를 주사하면 세포가 포도당을 에너지원으로 흡수한다. 특히 암세포는 정상의 조직보다 에너지를 많이 소비하기 때문에 포도당을 많이 흡수한다. 따라서 암과 같이 포도당 대사가 항진된 부위에 많이 모이게 된다. 반대로 뇌의 혈류량이 감소된 부분에서는 당연히 흡수량이 적어진다. 그 다음 PET 장비를 이용하여 몸속에서 방출되는 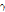 선을 검출하고, 영상 재구성 기법을 이용하여 단면 영상을 얻게 된다.
선을 검출하고, 영상 재구성 기법을 이용하여 단면 영상을 얻게 된다.
PET 영상 원리
양전자는 음(-) 전하를 가지고 있는 전자의 반입자(anti-particle)이다. 이러한 양전자는 방사선의 한 종류로서 방사성 동위원소(radioisotope)에서 방출된다. 예를 들면, 질량수 11의 탄소(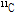 )는 자연계에는 존재하지 않지만, 사이클로트론(cyclotron)을 이용해 인공적으로 만들 수가 있는 동위원소이다.
)는 자연계에는 존재하지 않지만, 사이클로트론(cyclotron)을 이용해 인공적으로 만들 수가 있는 동위원소이다. 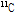 은 불안정하여
은 불안정하여 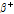 붕괴를 통하여 양전자(
붕괴를 통하여 양전자(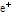 )를 방출하고, 안정된 원소인 붕소(
)를 방출하고, 안정된 원소인 붕소(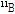 )로 변한다. 이를 화학식으로 나타내면 아래와 같다.
)로 변한다. 이를 화학식으로 나타내면 아래와 같다.
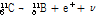 (여기서,
(여기서, 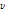 는 중성미자)
는 중성미자)
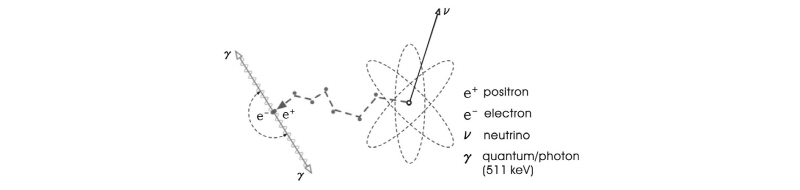
방출된 양전자(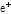 )가 전자(
)가 전자(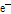 )와 충돌하면 양전자는 전자를 만나 쌍소멸(pair annihilation)하고 에너지 보존 법칙에 의해 511 keV의 에너지를 갖는 한 쌍의 빛알(광자, photon) 즉,
)와 충돌하면 양전자는 전자를 만나 쌍소멸(pair annihilation)하고 에너지 보존 법칙에 의해 511 keV의 에너지를 갖는 한 쌍의 빛알(광자, photon) 즉, 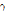 선을 방출한다(Fig. 14). 511 keV의 에너지는
선을 방출한다(Fig. 14). 511 keV의 에너지는 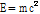 으로부터 구할 수 있는 전자 또는 양전자의 정지질량 에너지이다. 또한 운동량 보존 법칙에 의해 2개의 빛알은 서로 180° 방향으로 방출된다. 이 한 쌍의
으로부터 구할 수 있는 전자 또는 양전자의 정지질량 에너지이다. 또한 운동량 보존 법칙에 의해 2개의 빛알은 서로 180° 방향으로 방출된다. 이 한 쌍의 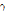 선을 검출해서 측정하는 장치가 PET인데, 몸속에 투여된 양전자 방출핵종의 정확한 분포를 영상으로 만들 수가 있다.
선을 검출해서 측정하는 장치가 PET인데, 몸속에 투여된 양전자 방출핵종의 정확한 분포를 영상으로 만들 수가 있다.
PET 장비는 인체의 주위를 둘러싸도록 배열된 다수의 감마선 검출기와 2개의 빛알 신호의 동시성을 판별하는 회로로 구성된다. 검출기 중 두 개가 동시에 감마선을 감지하면, 그 두 검출기를 잇는 직선 위에서 쌍소멸이 일어났다는 것을 알 수 있다. 따라서 이 정보를 모아 컴퓨터로 입체 영상을 재구성한다.
PET 역시 SPECT와 마찬가지로 몸속의 기능적인 변화를 찾는 데 뛰어나나 해부학적 정보를 구하는 것은 CT보다 떨어진다. 이를 보완하기 위해 최근에는 PET와 CT를 하나로 결합시킨 PET/CT 장비가 널리 보급되고 있다. 일반적으로 PET는 대조도(contrast)가 너무 높은 반면 해상도(resolution)가 낮다는 단점이 있다. 대조도가 너무 높다는 것은, 대낮에도 하늘에 별이 떠 있지만 밝은 해 때문에 우리가 별을 볼 수 없는 것처럼 질병이 있는 곳에는 방사성 의약품이 많이 모여 사진으로 뚜렷이 보이기는 하지만 주변 장기가 잘 보이지 않는다는 것을 뜻한다. 따라서 병이 있는 것을 알 수는 있지만 그 위치가 정확하게 어디인지 알기 어렵다. 이러한 단점을 보완하기 위하여 해상도가 뛰어난 CT나 MRI의 영상을 PET 영상과 합치는 방법을 찾게 되었다. 그리하여 PET/CT는 CT 영상의 해부학적 정보를 제공받음으로써 보다 더 정확한 영상 보정이 가능하여 기존 PET에 비해 영상 화질이 한층 우수하다.
Fig. 15는 PET/CT 영상의 예이다. 이러한 시스템에서는 PET 또는 SPECT와 CT가 일치된 단층들을 얻게 되는데 방출 방사능은 색상으로, CT는 회색 음영으로 묘사되어 중첩된다. 이러한 유형의 디스플레이로 방사능이 증가 또는 감소된 범위에 대한 해부학적 위치를 쉽게 알 수 있다.
자기공명 영상
머리말
자기공명 영상(MRI)은 핵자기공명 현상을 영상에 이용한 것이다. 핵자기공명은 1937년 독일인 과학자 라비(Isidor Isaac Rabi)가 공명 신호(nuclear resonance signal)가 존재함을 보임으로써 시작되었다. 그 후 퍼셀(Edward Purcell)과 블로흐(Felix Bloch)가 처음으로 실제적인 핵자기공명 신호를 검출하는 데 성공하였다. 블로흐는 이 신호를 수학적으로 분석하여 이른바 블로흐 방정식(Bloch Equation)을 만들어 오늘날 핵자기공명을 이해할 수 있는 중요한 토대를 마련하였다. 1973년에 로터버(Paul C. Lau-terbur)는 핵자기공명 현상을 이용하여 영상을 만드는 데 성공하였고, 맨스필드(Peter Mansfield)는 수학적인 방법을 이용해 사람의 몸속 물 분자에서 나오는 핵자기공명 신호를 분석하여 2차원적인 단면 영상으로 나타냄으로써 오늘날의 자기공명 영상이 태동하게 되었다.
자기공명 영상의 기본 원리
자기공명 영상 원리 개요
자기공명 영상은 핵자기 공명 신호를 만들어 영상을 구성하는 것이다. 즉 물 분자의 수소 원자핵은 양전하를 띠고 있고, 이것이 회전하여 전자기력을 갖게 되면 핵이 작은 막대자석처럼 된다. 이것이 강한 자기장 속에 들어가면 자기 힘의 크기가 커지면서 정렬하고(자화, magnetization), 축이 흔들리는 세차 운동(precession)을 계속한다. 이 상태에서 수소 원자핵의 진동수와 같은 고주파(RF, radio frequency) 에너지를 주면 공명으로 회전이 커진다. 그 후 고주파를 끊은 상태에서 원래의 방향으로 서서히 회전하면서 다시 정렬(이완, relaxation)하게 되는데, 이때 수소 원자핵으로부터 자기공명 신호(MR signal)가 발생하며 이를 수신 코일로 포착한다. 발생하는 자기공명 신호의 크기는 조직의 양성자 밀도(PD, proton density), 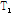 이완시간(relaxation time),
이완시간(relaxation time), 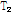 이완시간 그리고 혈류 등에 의해 좌우되는데, 수소 원자를 함유하는 조직은 물리적, 화학적 성질에 따라
이완시간 그리고 혈류 등에 의해 좌우되는데, 수소 원자를 함유하는 조직은 물리적, 화학적 성질에 따라 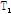 과
과 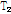 이완시간이 달라 자기공명 영상은 이러한
이완시간이 달라 자기공명 영상은 이러한 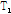 과
과 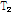 이완시간의 차이를 영상으로 나타낸 것이다.
이완시간의 차이를 영상으로 나타낸 것이다.
수소 원자핵 자기장
인체를 구성하는 성분 중 70% 이상은 물이며, 이 물 분자(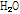 )를 구성하고 있는 수소 원자핵은 중성자는 없고 단지 1개의 양성자만 있기 때문에 수소 원자핵을 단순히 양성자라고도 하며 또한 (+) 전하를 가지고 있는 입자로서 스스로 자전하기 때문에 스핀(spin)이라고도 부른다. 지구가 지축을 중심으로 자전함으로써 지구 자기장이 생기듯이 수소 원자핵 또한 자전 운동의 결과로 핵 자기장(nuclear magnetic field)을 형성한다. 이 핵 자기장이 곧 핵자기 공명의 이론적인 배경이 된다.
)를 구성하고 있는 수소 원자핵은 중성자는 없고 단지 1개의 양성자만 있기 때문에 수소 원자핵을 단순히 양성자라고도 하며 또한 (+) 전하를 가지고 있는 입자로서 스스로 자전하기 때문에 스핀(spin)이라고도 부른다. 지구가 지축을 중심으로 자전함으로써 지구 자기장이 생기듯이 수소 원자핵 또한 자전 운동의 결과로 핵 자기장(nuclear magnetic field)을 형성한다. 이 핵 자기장이 곧 핵자기 공명의 이론적인 배경이 된다.
양성자의 세차 운동
Fig. 16과 같이 인체 안의 수소 원자핵(양성자)이 자기공명 스캐너(MR scanner) 속, 즉 외부 자기장 속에 위치하면 양성자는 자전하면서 외부 자기장(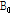 )의 방향(z축 방향)을 기준으로 하여 세차 운동을 한다. 이 세차 운동의 속도는 외부 자기장의 크기에 비례한다. 이는 다음의 라모 공식(Larmor formula)으로 나타낼 수 있다.
)의 방향(z축 방향)을 기준으로 하여 세차 운동을 한다. 이 세차 운동의 속도는 외부 자기장의 크기에 비례한다. 이는 다음의 라모 공식(Larmor formula)으로 나타낼 수 있다.
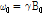
여기서 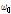 는 세차 진동수이고,
는 세차 진동수이고, 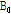 는 외부 자기장의 세기이다.
는 외부 자기장의 세기이다. 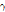 는 자기 회전비(gyromagnetic ratio)를 나타내고, 이 비는 각운동량 J에 대한 자기모멘트
는 자기 회전비(gyromagnetic ratio)를 나타내고, 이 비는 각운동량 J에 대한 자기모멘트 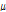 의 비로(
의 비로(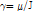 ), 특정한 세기의 자기장에서는 모든 원자에서 일정하다. 예를 들어 외부 자기장이 1.5 T인 자기공명 스캐너 안에 환자가 있다면 몸속의 양성자는 1초에 약 6400만 번의 세차 운동을 하게 되는데, 이를 진동수로 바꾸면 64 MHz가 된다. 이 진동수를 양성자의 세차 진동수라고 하며, 발견자의 이름을 따서 라모 진동수(Larmor frequency)라고도 부른다. 만일 양성자의 세차 진동수와 같은 고주파 펄스, 즉 고주파 영역의 전자기파가 접속된 에너지를 인체에 주입하면 양성자는 더 높은 에너지 상태로 들뜨게(excited) 되는데, 이러한 현상을 양성자의 자기공명 현상이라고 한다. 그리고 고주파 펄스를 꺼버리면 이 양성자는 다시 원래의 에너지가 낮은 바닥상태(ground state)로 되돌아가는데 이러한 현상을 이완(relaxation)이라고 한다.
), 특정한 세기의 자기장에서는 모든 원자에서 일정하다. 예를 들어 외부 자기장이 1.5 T인 자기공명 스캐너 안에 환자가 있다면 몸속의 양성자는 1초에 약 6400만 번의 세차 운동을 하게 되는데, 이를 진동수로 바꾸면 64 MHz가 된다. 이 진동수를 양성자의 세차 진동수라고 하며, 발견자의 이름을 따서 라모 진동수(Larmor frequency)라고도 부른다. 만일 양성자의 세차 진동수와 같은 고주파 펄스, 즉 고주파 영역의 전자기파가 접속된 에너지를 인체에 주입하면 양성자는 더 높은 에너지 상태로 들뜨게(excited) 되는데, 이러한 현상을 양성자의 자기공명 현상이라고 한다. 그리고 고주파 펄스를 꺼버리면 이 양성자는 다시 원래의 에너지가 낮은 바닥상태(ground state)로 되돌아가는데 이러한 현상을 이완(relaxation)이라고 한다.
자기 공명
양성자의 알짜 자화
자기공명 현상을 보이는 원자들로는 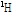 ,
, 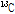 ,
, 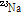 ,
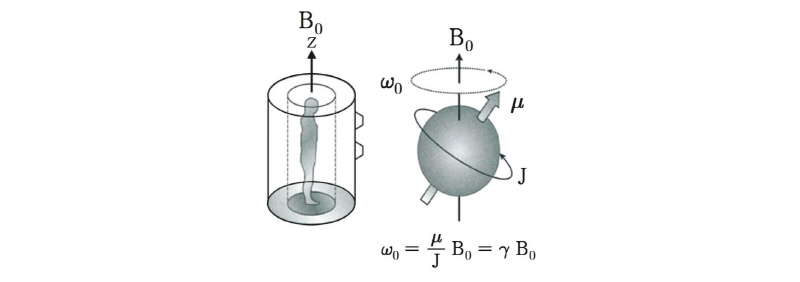
, 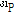 등이 있는데 이 중 자기공명 영상에 주로 이용되는 것은 인체에 많이 있고 신호가 큰 수소 원자이다. 이러한 수소 원자는 자기쌍극자 모멘트(magnetic dipole moment)를 가지는데, 외부 자기장이 없을 때에는 자기모멘트는 일정한 방향성이 없이 무질서하게 배열되어 있다. 따라서 알짜 자화(순자화, net magnetization)는 0이 된다. 즉, 전체적인 자기모멘트가 0인 상태에 있다. 그러나 인체가 스캐너에 들어가 외부 자기장(
등이 있는데 이 중 자기공명 영상에 주로 이용되는 것은 인체에 많이 있고 신호가 큰 수소 원자이다. 이러한 수소 원자는 자기쌍극자 모멘트(magnetic dipole moment)를 가지는데, 외부 자기장이 없을 때에는 자기모멘트는 일정한 방향성이 없이 무질서하게 배열되어 있다. 따라서 알짜 자화(순자화, net magnetization)는 0이 된다. 즉, 전체적인 자기모멘트가 0인 상태에 있다. 그러나 인체가 스캐너에 들어가 외부 자기장(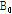 )을 받게 되면 수많은 양성자들은 세차 운동을 하면서 동시에 각각 외부 자기장의 방향과 같은 방향(+1/2 스핀) 또는 반대 방향(-1/2 스핀)으로 배열하게 된다. 이들 스핀들의 벡터 합을 구하면 전체적인 하나의 벡터 성분을 얻을 수 있는데 이것이 바로 알짜 자화(M)이다(Fig. 17).
)을 받게 되면 수많은 양성자들은 세차 운동을 하면서 동시에 각각 외부 자기장의 방향과 같은 방향(+1/2 스핀) 또는 반대 방향(-1/2 스핀)으로 배열하게 된다. 이들 스핀들의 벡터 합을 구하면 전체적인 하나의 벡터 성분을 얻을 수 있는데 이것이 바로 알짜 자화(M)이다(Fig. 17).
|
Fig. 17. Randomly oriented magnetic moments aligning with an applied magnetic field (B0) to form a net magnetization (M). |
예를 들어 25oC 실온에서 1.5 T 자기공명 스캐너를 사용할 경우, 대부분의 양성자들은 z축을 기준으로 서로 반대 방향으로 배열되기 때문에 자기력은 서로 상쇄되어 합 벡터가 0이 되고, 외부 자기장과 같은 방향인 +z축으로 배열하게 되는 약 0.001%의 양성자들만이 최종적으로 남게 된다. 이때 자화된 양의 총합을 알짜 자화라고 하며 외부 자기장 방향인 z축을 향하고 있기 때문에 세로(종축) 자화(lon-gitudinal magnetization, Mz)라고 한다. 이와 같이 약 0.001% 양성자들의 자기장의 합 벡터인 Mz의 크기가 자기공명 신호의 크기를 결정하는 중요한 요소로서 작용한다. 이 때문에 자기공명 영상 기법들에서 얻을 수 있는 기본적인 신호 세기(signal intensity)는 다른 영상기법과 비교하여 낮다. 이를 보완하기 위하여 같은 신호를 여러 번 얻어 겹쌓기(stacking)하는 기법을 사용하기 때문에 영상 촬영시간이 상대적으로 길다. 일반적으로 자기공명 스캐너의 자기장이 셀수록 Mz의 크기는 선형적으로 증가하고, 자기공명 신호의 세기 역시 커지게 된다.
자기 공명과 이완
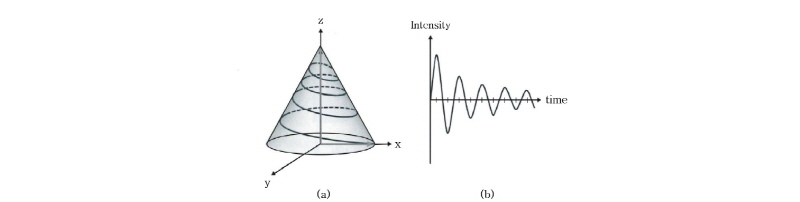
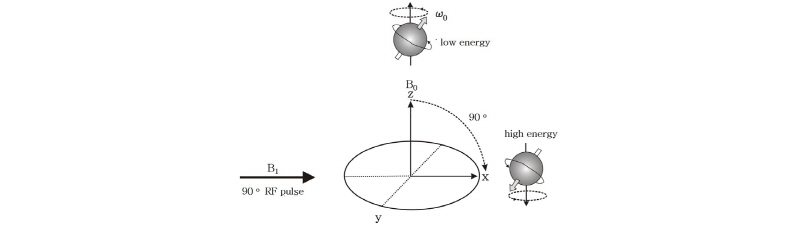
알짜 자화는 외부 자기장 방향인 z축을 향하고 있는 세로 자화(Mz)이다. Fig. 18과 같이 외부 자기장(B0)과 직각 방향에서 라모 진동수(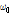 )로 진동하는 자기장(B1), 즉 고주파 펄스(90° RF pulse)를 걸어주면 윗 방향으로 모여 있던 스핀(양성자)들이 점점 아랫 방향으로 기울고 마침내 같은 위상(in phase)의 90°옆으로 기울어진 가로(횡축) 자화(transverse magnetization, Mxy)를 만들게 된다. 이러한 자기공명 현상은 마치 소리굽쇠가 자신이 가지고 있는 고유 진동수의 소리에만 소리를 내는 공명 현상과 같다.
)로 진동하는 자기장(B1), 즉 고주파 펄스(90° RF pulse)를 걸어주면 윗 방향으로 모여 있던 스핀(양성자)들이 점점 아랫 방향으로 기울고 마침내 같은 위상(in phase)의 90°옆으로 기울어진 가로(횡축) 자화(transverse magnetization, Mxy)를 만들게 된다. 이러한 자기공명 현상은 마치 소리굽쇠가 자신이 가지고 있는 고유 진동수의 소리에만 소리를 내는 공명 현상과 같다.
x-y평면상의 Mxy는 평형 상태(Mz)로부터 이탈된 상태이므로 B1이 끝난 후에는 z축으로(평형 상태로) 복귀하려는 경향이 있다. 이런 현상을 이완이라 한다. 여기에는 가로 이완(transverse relaxation) 또는 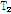 이완과 세로 이완(longi-tudinal relaxation) 또는
이완과 세로 이완(longi-tudinal relaxation) 또는 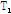 이완 두 가지가 있다.
이완 두 가지가 있다.
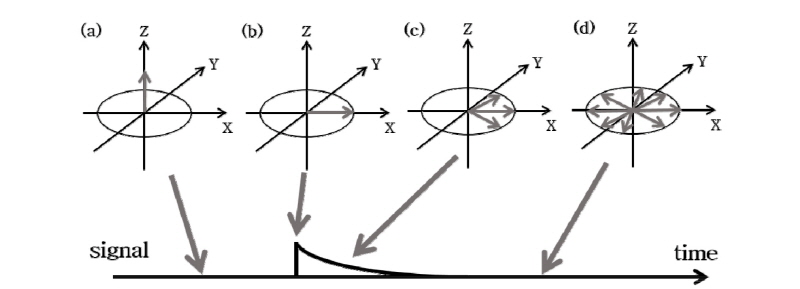
첫 번째, 가로 이완은 Fig. 19를 통해 알 수 있다. x-y평면에 위치하는 모든 스핀은 90° 펄스 바로 후에는 같은 속도로 회전을 하고 같은 위상(in phase)을 가지므로 신호의 크기는 최대가 된다(Fig. 19(b)). 그러나 점점 시간이 지나면 성분들마다 세차 운동의 주기가 빠르거나 또는 늦음에 따라 각 성분들이 x-y평면상에 퍼지면서 위상이 흩트려진다(탈위상, dephasing). 따라서 신호의 크기는 점점 줄어들어 마침내 0이 된다(Fig. 19(c), (d)). 이를 그림으로 나타낸 것이 Fig. 19의 아래 곡선이다. 그리고 이 신호의 크기를 식으로 나타내면 다음과 같다.
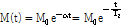 (7)
(7)
식 (7)에서 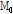 의 세기가 초기 값에서 1/e(37%)로 줄어드는 시간을
의 세기가 초기 값에서 1/e(37%)로 줄어드는 시간을 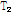 또는 가로 이완 시간(transverse relaxation time)이라고 부른다. 가로 이완은 스핀과 스핀 상호간의 에너지 교환이나 전달 과정이므로 이를 스핀스핀 이완(spin-spin relaxation)이라고도 부른다.
또는 가로 이완 시간(transverse relaxation time)이라고 부른다. 가로 이완은 스핀과 스핀 상호간의 에너지 교환이나 전달 과정이므로 이를 스핀스핀 이완(spin-spin relaxation)이라고도 부른다.
두 번째, 세로 이완은 Fig. 20과 같이 자화가 평형 상태로 복귀하려는 현상이다. Fig. 20(d)는 평형 상태의 값으로 돌아온 것을 표현한 것이다. 이를 식으로 표현하면 다음과 같다.
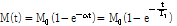 (8)
(8)
식 (8)로부터 자화가 평형 상태 값의 63%(1-1/e)까지 회복되는 시간을 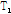 또는 세로 이완시간(longitudinal relaxation time)이라 한다. 세로 이완은 고주파 펄스로부터 받았던 에너지를 주변의 분자 격자(lattice)로 전달하는 것으로 스핀격자 이완(spin-lattice relaxation)이라고도 한다.
또는 세로 이완시간(longitudinal relaxation time)이라 한다. 세로 이완은 고주파 펄스로부터 받았던 에너지를 주변의 분자 격자(lattice)로 전달하는 것으로 스핀격자 이완(spin-lattice relaxation)이라고도 한다.
이러한 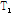 이완과
이완과 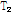 이완의 두 과정은 서로 독립적이면서 동시에 일어난다. Fig. 21에서는 이완하는 동안의 세로 자화(↑)와 가로 자화(→)를 합 벡터로 나타낸 것이다. 이때 자화 벡터들은 모두 세차 운동을 하고 있기 때문에 합 벡터는 나선형 운동을 하면서(Fig. 21(a)) 그 크기가 계속 줄어드는데 이러한 변화를 외부의 수신기로 받아보면 일정한 진동수(세차 진동수)를 가진 자유유도감쇠(FID, Free Induction Decay) 신호를 얻을 수 있다(Fig. 21b). 이 FID 신호는 매우 빨리 소멸되므로 획득 시간이 짧은 자기공명 스펙트럼을 얻을 경우에 많이 사용되며 양성자 밀도(PD)가 낮은 인체 조직에서 자기공명 영상을 얻을 경우에는 90° 고주파 펄스와 함께 일련의 180° 고주파 펄스들을 사용하여 얻은 스핀 에코(spin echo) 신호나, 경사자기장을 이용하여 얻은 경사 에코(gradient echo) 신호와 같은 에코 신호를 사용하여 자기공명 영상을 얻는다.
이완의 두 과정은 서로 독립적이면서 동시에 일어난다. Fig. 21에서는 이완하는 동안의 세로 자화(↑)와 가로 자화(→)를 합 벡터로 나타낸 것이다. 이때 자화 벡터들은 모두 세차 운동을 하고 있기 때문에 합 벡터는 나선형 운동을 하면서(Fig. 21(a)) 그 크기가 계속 줄어드는데 이러한 변화를 외부의 수신기로 받아보면 일정한 진동수(세차 진동수)를 가진 자유유도감쇠(FID, Free Induction Decay) 신호를 얻을 수 있다(Fig. 21b). 이 FID 신호는 매우 빨리 소멸되므로 획득 시간이 짧은 자기공명 스펙트럼을 얻을 경우에 많이 사용되며 양성자 밀도(PD)가 낮은 인체 조직에서 자기공명 영상을 얻을 경우에는 90° 고주파 펄스와 함께 일련의 180° 고주파 펄스들을 사용하여 얻은 스핀 에코(spin echo) 신호나, 경사자기장을 이용하여 얻은 경사 에코(gradient echo) 신호와 같은 에코 신호를 사용하여 자기공명 영상을 얻는다.
|
Fig. 21. FID (Free Induction Decay) signal. (a) sum of longitudinal and transverse magnetization vector. (b) FID (KSMRM, 2008). |
자기공명 신호의 획득 과정
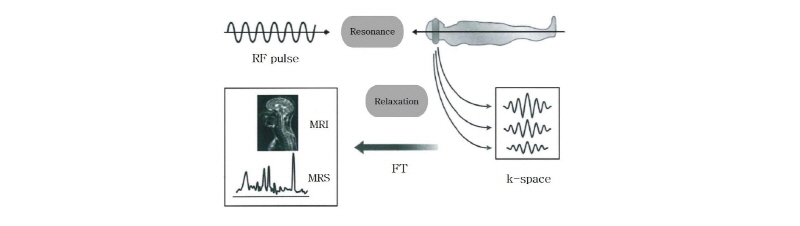
자기공명 신호를 얻는 과정은 Fig. 22에 나타내었다. 고주파 펄스를 몸속으로 보내면 인체 안의 스핀들이 공명 현상을 일으키면서 더 높은 에너지 준위로 들뜨게 된다. 고주파 펄스를 차단하면 스핀들은 낮은 에너지 준위의 초기 상태로 이완한다. 이 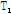 과
과  이완 현상을 통하여 인체의 해당 부위에서 시간 함수의 전기적 신호 즉, 자기공명 신호인 스핀 에코, 경사 에코, 자유유도감쇠 등의 신호가 발생한다. 이 신호들은 자기공명 영상의 기초 자료로 이용되며, 규칙에 따라 k-공간(k-space)에 모은 후 푸리에 변환을 통하여 자기공명 영상과 자기공명 스펙트럼(MRS)을 얻는다. 자기공명 영상의 음영도는 주로 자화된 양성자의 밀도와 함께
이완 현상을 통하여 인체의 해당 부위에서 시간 함수의 전기적 신호 즉, 자기공명 신호인 스핀 에코, 경사 에코, 자유유도감쇠 등의 신호가 발생한다. 이 신호들은 자기공명 영상의 기초 자료로 이용되며, 규칙에 따라 k-공간(k-space)에 모은 후 푸리에 변환을 통하여 자기공명 영상과 자기공명 스펙트럼(MRS)을 얻는다. 자기공명 영상의 음영도는 주로 자화된 양성자의 밀도와 함께 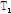 이완,
이완, 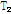 이완의 특성에 따라 결정되므로 양성자 밀도와
이완의 특성에 따라 결정되므로 양성자 밀도와 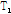 이완,
이완, 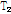 이완을 영상 변수(imaging parameter)라 부른다. 한편 자기공명 스펙트럼의 신호는 수소 원자핵이 처해있는 분자의 환경에 따라 달라지는 공명 진동수별로 표시되며, 신호 세기는 수소 원자핵의 밀도에 비례한다.
이완을 영상 변수(imaging parameter)라 부른다. 한편 자기공명 스펙트럼의 신호는 수소 원자핵이 처해있는 분자의 환경에 따라 달라지는 공명 진동수별로 표시되며, 신호 세기는 수소 원자핵의 밀도에 비례한다.
자기공명 영상 생성 기법
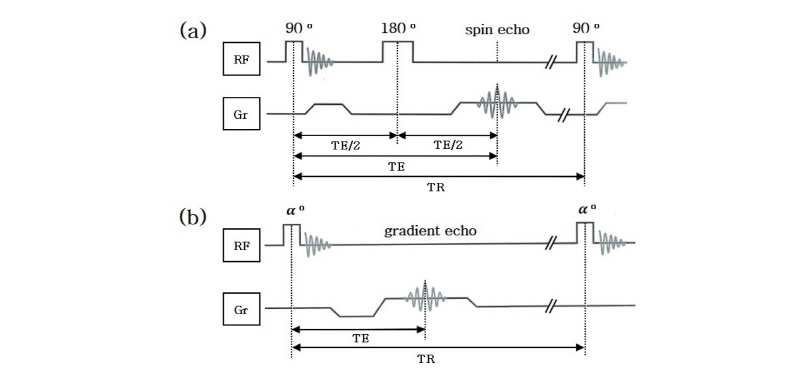
스핀에코 영상 기법
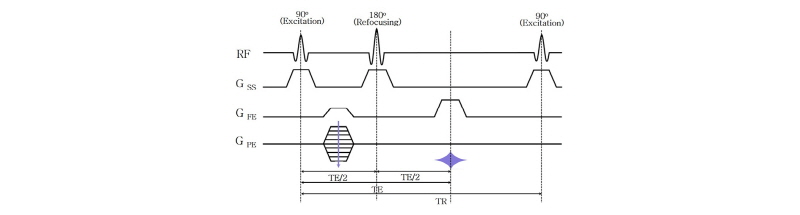
스핀 에코(spin echo)는 MRI에서 가장 기본적인 영상 기법으로 90° 여기 펄스를 내보낸 뒤 180° 펄스를 이용하여 탈위상(dephasing)하는 스핀들을 다시 모아(refocusing) 자기공명 신호를 얻는 기법이다. 스핀 에코에서는 2개의 고주파(RF) 펄스를 이용하는데, 첫 번째 90° 펄스는 양성자 스핀을 들뜨게 하기 위한 것이고, 두 번째 180° 펄스는 들뜬 스핀들이 흩어지는 것을 다시 모아주어 에코 신호(echo signal)를 만들기 위한 것이다. Fig. 23은 대표적인 스핀 에코의 펄스열 다이어그램(pulse sequence diagram)이다.
|
Fig. 23. Spin echo pulse sequence diagram. GSS: slice selection, GFE: frequency encoding (readout), GPE: phase encoding) (KSMRM, 2015). |
처음 90° 펄스에서 다음 90° 여기 펄스(excitation pulse)를 내보낼 때까지 걸린 시간을 반복 시간(repetition time, TR)이라 하고, 처음 90° 펄스로부터 스핀 에코가 생길 때까지의 시간을 에코 시간(echo time, TE)이라 부른다. 그리고 자기공명 영상을 얻기 위하여 설계된 일련의 고주파 펄스와 경사자기장 펄스(gradient pulse) 그리고 펄스 사이의 시간 간격들의 조합을 펄스열이라 한다. Fig. 23에서 알 수 있듯이 90° 펄스로 들뜨게 한 후 180° 펄스를 내보낼 때까지의 시간이 TE/2이고, 그 이후 다시 TE/2가 흐른 뒤 자기공명 신호(스핀 에코)를 얻게 된다. 90° 여기 펄스와 180° 재초점화 펄스(refocusing pulse)를 내보낼 때 특정 절편만을 들뜨게 위하여 기울기(gradient)를 가진 자기장을 가해주는데 이를 절편선택(slice selection) 경사자기장(GSS)이라고 한다. z축에 위치하던 자화는 여기 펄스와 절편선택 경사자기장에 의해서 선택적으로 들뜨게 되어 z축에서 90°가 되는 x-y평면에 놓이게 되는데, x-y평면에 도달한 양성자 스핀은 여기 펄스를 끊음과 동시에 주변 환경의 차이로 인해 탈위상 상태가 된다. 영상 신호를 얻으려면 흩어진 스핀을 다시 모아주어야 하므로 180° 펄스를 그 절편에 가한다. 이렇게 위상을 다시 모으면서 2차원 영상을 얻기 위하여 위상 부호화(phase encoding) 경사자기장(GPE)과 진동수 부호화(frequency encoding) 또는 판독(readout) 경사자기장(GFE)을 이용하여 k-공간을 채운다. 이와 같이 자기공명 영상에서는 공간적 위치 정보를 세 방향의 경사 자기장(gradient magnetic field)을 이용해서 얻게 되는데 이때 3차원 공간좌표는 푸리에 변환한 k-공간에서의 값으로 저장된다. 보통 이렇게 저장된 2차원 또는 3차원 자료를 역 푸리에 변환하여 영상을 구한다.
고속 스핀에코 영상 기법
고속 스핀에코(fast spin echo)는 스핀에코 기법으로부터 촬영 시간을 줄이기 위하여 한번의 90° 여기 펄스 후에 180° 재초점화 펄스를 여러 번 내보내면서 신호를 얻는 기법이다. 이 기법은 일반적으로 사용하는 스핀에코 영상법과 같은 개념으로 처음의 90° 펄스와 180° 펄스는 스핀 에코와 동일하게 사용된다. 들뜬 스핀에 탈위상이 발생할 때 첫 번째 180° 펄스를 이용하여 분산된 스핀의 위상을 반대 방향으로 모아준다. 이때 첫 번째 신호가 발생한다. 다시 같은 방향으로 탈위상이 일어나면 두 번째 180° 펄스를 이용하여 반대 방향으로 위상을 모아주어 두 번째 신호를 발생시킨다. 이를 여러 번 반복하여 k-공간에 여러 개의 자기공명 신호를 채우는 방법이 고속 스핀에코 영상법이다. 이때 스핀에코 영상법과 달리 위상부호화 경사자기장의 세기가 각각의 신호에 따라 다르게 적용되어 k-공간을 채운다.
경사에코 영상 기법
스핀에코 영상법이 주로 숙임각(flip angle)이 90°와 180°인 고주파 펄스를 짝으로 이용하여 영상을 획득하는 반면, 경사에코 방법은 숙임각(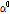 )이 일반적으로 90°보다 작은 고주파 펄스와 (재초점화 고주파 펄스인 180° 펄스 없이) 경사 자기장만을 사용하여 경사 에코 신호를 얻는다(Fig. 24). 경사 에코를 얻는 과정은 먼저 90° 고주파 펄스에 의해서 x-y평면상에 가로 자화를 형성하고 그 후 (-) 기울기를 가하여 강제적으로 x-y평면상의 스핀들을 탈위상시키고 나서 다시 (+) 기울기를 가하여 스핀들을 다시 한곳으로 모아(재초점화) 경사 에코를 발생시킨다. 이와 같이 경사 자기장을 이용하여 강제로 스핀들의 위상을 다르게 하여 자화를 사라지게 한 후에 반대 방향의 경사 자기장을 걸어 위상을 모아서 자화를 되돌려 만든 에코가 경사 에코이다.
)이 일반적으로 90°보다 작은 고주파 펄스와 (재초점화 고주파 펄스인 180° 펄스 없이) 경사 자기장만을 사용하여 경사 에코 신호를 얻는다(Fig. 24). 경사 에코를 얻는 과정은 먼저 90° 고주파 펄스에 의해서 x-y평면상에 가로 자화를 형성하고 그 후 (-) 기울기를 가하여 강제적으로 x-y평면상의 스핀들을 탈위상시키고 나서 다시 (+) 기울기를 가하여 스핀들을 다시 한곳으로 모아(재초점화) 경사 에코를 발생시킨다. 이와 같이 경사 자기장을 이용하여 강제로 스핀들의 위상을 다르게 하여 자화를 사라지게 한 후에 반대 방향의 경사 자기장을 걸어 위상을 모아서 자화를 되돌려 만든 에코가 경사 에코이다.
초음파 영상
머리말
초음파란 인간이 감지할 수 있는 영역(20 Hz∼20 kHz)보다 높은 진동수, 즉 20 kHz 이상의 음파로서, 의료용 초음파 시스템은 1∼10 MHz를 사용하나 경우에 따라서는 70 MHz까지 활용한다. 초음파 영상 기술은 1910년경에 초음파의 생물학적인 작용을 연구하기 시작한 것이 초음파를 의학 분야에 응용한 시초이며, 2차 세계대전 중 미군이 상대방 잠수함의 위치를 파악하는 데 사용한 소나(sonar) 기술을 기본으로 한다.
초음파 신호는 프로브(탐촉자, probe) 또는 음파변환기(transducer)라고 하는 장비에 의해 생성된다. 프로브의 앞부분에는 압전 효과(piezoelectric effect)를 일으키는 티탄산지르콘산납(PZT, lead zirconate titanate)이나 PVDF (polyvinylidene fluoride) 등의 압전 물질로 구성되어 있다. 압전 물질은 기하학적 형태로 배열된 수많은 쌍극자로 형성되어 있는데, 이러한 압전 물질에 순간적인 전압을 가하면 압전 물질의 두께가 수축과 팽창을 하면서 진동함으로써 초음파를 발생시킨다. 거꾸로 초음파와 같은 파동(wave motion) 에너지로 압전 물질에 압력을 가하면 전기 쌍극자의 분극 현상에 의해 전기적 신호가 발생한다. 이를 압전 효과라 한다. 따라서 프로브는 초음파 펄스를 발생시켜 몸속으로 보내기도 하고, 반사된 에코(echo)를 수신하여 전기 신호로 바꾸어주는 역할을 한다. 프로브에서 나오는 초음파 빔(beam)을 몸속으로 보내게 되면 서로 성질이 다른 조직 사이의 경계면에서 초음파 빔의 일부는 음원 쪽으로 반사되어 되돌아오는데 이것이 에코이다. 반사에 의한 에코가 프로브에 도달하면 압전 물질에 의해 전기적 신호로 변환되어 감지되고, 아울러 되돌아오는 데 걸린 시간을 거리로 환산하여 위치 정보를 얻게 된다. 이와 같이 초음파 영상 시스템은 이렇게 되돌아 온 초음파 신호의 세기(intensity) 차이를 분석하고 처리하여 인체의 해부학적 정보를 명암(grey scale) 기반(점의 밝기)으로 나타낸 것으로, 구현된 영상에서 각 점의 밝기는 그 위치에 해당하는 해부학적 구조체에서 반사된 초음파의 세기를 보여준다.
초음파 물리
파동 방정식
음파는 매질을 구성하는 미세한 입자들이 음파의 진행 방향과 같은 방향으로 수축과 팽창을 함으로써 생성되는 세로파(종파)이며 의료용 초음파 역시 이에 속한다. 음파는 입자의 변위를 시간으로 미분한 입자의 속도로 표현하지만, 국소 부위에서의 부피의 수축과 팽창은 실질적으로 해당 부위 매질에 인가되는 압력과 관련이 있다. 따라서 음파는 시간과 공간의 함수인 압력(P)으로도 표현할 수 있다. 이때 이를 음향 압력(acoustic pressure)이라 한다(Prince and Links, 2016). 음향 압력은 음파가 존재하지 않는 경우 0이며 이미 존재하는 대기압을 배제한 변동된 양만을 의미한다.
세로파에서는 음향 압력 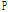 와 입자의 속도
와 입자의 속도 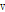 는 다음의 선형적 관계를 가진다.
는 다음의 선형적 관계를 가진다.
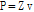 (9)
(9)
여기서, 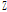 는 음향 임피던스(acoustic impedance)로 음파에 대한 매질의 저항을 뜻하며, 매질의 밀도(
는 음향 임피던스(acoustic impedance)로 음파에 대한 매질의 저항을 뜻하며, 매질의 밀도(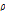 ,
, 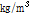 )와 음파의 속도(
)와 음파의 속도(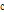 ,
, 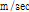 )의 곱으로 나타낸다.
)의 곱으로 나타낸다.
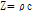 (10)
(10)
음향 임피던스의 단위는 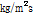 또는
또는 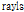 (Rayleigh에서 따옴)이며,
(Rayleigh에서 따옴)이며, 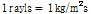 이다.
이다.
일반적으로 음향 압력  는 다음의 3차원 파동 방정식을 만족한다.
는 다음의 3차원 파동 방정식을 만족한다.
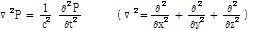
만약 음파가 공간상에서 y와 z에 대하여 일정한 값을 갖고 +x 또는 -x 방향으로 이동하는 평면파(plane wave)의 경우 다음과 같은 1D 파동방정식이 된다.
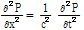
이 식의 일반해는 다음과 같이 구할 수 있다.
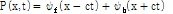
여기서 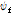 는 +x 방향의 진행파(forward traveling wave),
는 +x 방향의 진행파(forward traveling wave), 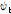 는 -x 방향의 진행파(backward traveling wave)이다.
는 -x 방향의 진행파(backward traveling wave)이다.
여기서 1D 파동방정식을 만족하는 중요한 함수들 중 하나는 다음의 사인파 함수(sinusoidal function)이다.
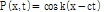 여기서, k는 파수(wave number)
여기서, k는 파수(wave number)
사인파의 조건을 충족시키려면 무한 공간에서 무한 시간 동안의 음파가 요구되므로 실제 존재가 불가능하다. 그러나 의료용 초음파 시스템에서는 사인파로 근사하는데 이는 매우 짧은 시간 동안 국소적인 부분만을 관측하기 때문이다.
또 하나의 1D 파동 방정식의 해로서 다음과 같은 임펄스 함수(impulse function, delta function)가 있다.
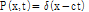
임펄스 평면파는 진행 방향에 수직이며 무한히 큰 진폭과 무한히 짧은 파의 길이를 가진다고 간주한다. 이러한 가정은 일반적으로 충족될 수 없으나 의료 초음파 시스템의 특성을 이해하기 위하여 짧은 펄스들을 임펄스 평면파로 근사하여 사용한다.
구면파(spherical wave)인 경우는 시간 t와 거리 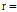
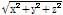 의 두 변수로 결정된다. 따라서 음파의 압력
의 두 변수로 결정된다. 따라서 음파의 압력 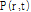 의 구면파에 대한 파동방정식은 다음과 같다.
의 구면파에 대한 파동방정식은 다음과 같다.
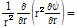
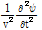
이 식의 일반해는 다음과 같이 주어진다.
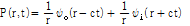
여기서 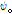 는 바깥쪽으로 진행하는 파(outward traveling wave)이고,
는 바깥쪽으로 진행하는 파(outward traveling wave)이고, 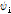 는 안쪽으로 진행하는 파(inward traveling wave)이다. 일반적으로 안쪽으로 진행하는 파를 생성하는 음원은 존재하지 않으므로 대부분의 경우 일반해는 다음과 같이 된다.
는 안쪽으로 진행하는 파(inward traveling wave)이다. 일반적으로 안쪽으로 진행하는 파를 생성하는 음원은 존재하지 않으므로 대부분의 경우 일반해는 다음과 같이 된다.
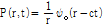
여기서 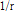 은 거리에 따라 진폭이 감소함을 나타내는 요소로, 음원에서 바깥으로 음파가 진행할 때 음파가 지나가는 구의 표면적(
은 거리에 따라 진폭이 감소함을 나타내는 요소로, 음원에서 바깥으로 음파가 진행할 때 음파가 지나가는 구의 표면적(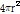 )이 증가함에 따라 나타나는 자연 현상이다.
)이 증가함에 따라 나타나는 자연 현상이다.
압력 반사율과 압력 투과율
Fig. 25와 같은 경계면에서는 입사파에 의해 유도된 입자속도 성분과 반사파 및 투과파에 의해 유도된 입자속도 성분이 일치한다(Prince and Links, 2016).
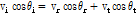
이 식에 식 (9)와 (10)을 대입하면 다음과 같이 쓸 수 있다.
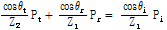
또한 경계면에서 압력은 연속적이어야 하므로
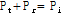
이다. 이 식들로부터 압력 반사율(pressure reflectivity) 또는 반사계수(reflection coefficient) 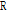 과 압력 투과율(pressure transmittivity) 또는 투과계수(transmission coefficient)
과 압력 투과율(pressure transmittivity) 또는 투과계수(transmission coefficient) 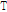 를 다음과 같이 정의할 수 있다.
를 다음과 같이 정의할 수 있다.
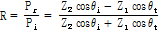
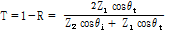
그리고 세기(intensity) 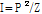 를 이용하면 음파의 세기 반사율(intensity reflectivity)
를 이용하면 음파의 세기 반사율(intensity reflectivity) 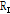 는
는
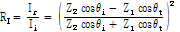
이 되며, 세기 투과율(intensity transmittivity) 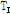 는 다음과 같이 된다.
는 다음과 같이 된다.
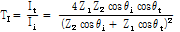
감쇠
감쇠란 흡수(음파 에너지가 열에너지로 변환되는 것), 산란 및 모드변환(mode conversion) 등을 포함한 모든 형태의 작용에 의하여 진폭이 감소하는 것을 말한다.
거리 r 지점에서의 실제 진폭 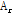 은 다음과 같이 쓸 수 있다.
은 다음과 같이 쓸 수 있다.
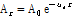
여기서, 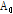 는 초기 진폭,
는 초기 진폭, 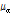 는 진폭 감쇠인자(attenuation factor)로서 단위는 nepers/cm (Np/cm)이다. 흔히
는 진폭 감쇠인자(attenuation factor)로서 단위는 nepers/cm (Np/cm)이다. 흔히 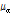 보다는 다음과 같이 감쇠계수
보다는 다음과 같이 감쇠계수 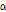 를 정의하여 사용하는 것이 유용할 때가 많다.
를 정의하여 사용하는 것이 유용할 때가 많다.
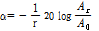
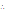
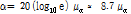
이때 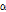 의 단위는 dB/cm이며 1 Np = 8.686 dB이다.
의 단위는 dB/cm이며 1 Np = 8.686 dB이다.
매질에서의 감쇠계수는 진동수에 따라 달라지며 일반적으로 진동수가 높을수록 증가한다. 또한 진동수가 증가하면 투과 깊이(depth of penetration)는 감소하게 된다. 따라서 감쇠로 인하여 초음파 영상 시스템에서 깊이 방향으로의 정보를 얻는 데에도 한계를 가지게 된다.
산란
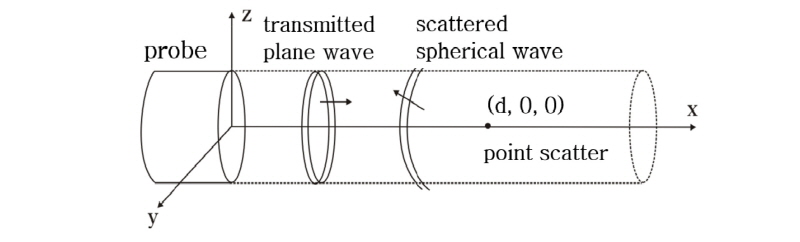
몸속 많은 반사체들은 음파의 파장에 비해 아주 작다. 이러한 반사체는 입사된 평면파에 의하여 작은 구면체로 진동한다. 따라서 작은 진폭의 산란된 구면파를 생성한다. Fig. 26에서 감쇠를 고려한 평면파
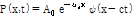
가 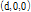 에 위치한 작은 점과 같은 반사체에 입사한다고 가정하자(Prince and Links, 2016). 이때 파는 +x 방향으로 진행한다. 작은 반사체는 입사된 음파의 반사계수
에 위치한 작은 점과 같은 반사체에 입사한다고 가정하자(Prince and Links, 2016). 이때 파는 +x 방향으로 진행한다. 작은 반사체는 입사된 음파의 반사계수  배만큼의 진폭으로 구면파를 생성하는 음원으로 작용한다. 따라서 반사체 위치
배만큼의 진폭으로 구면파를 생성하는 음원으로 작용한다. 따라서 반사체 위치 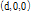 를 새로운 시작점으로 하는 산란된 파의 방정식은 다음과 같이 쓸 수 있다.
를 새로운 시작점으로 하는 산란된 파의 방정식은 다음과 같이 쓸 수 있다.
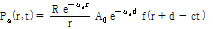 (11)
(11)
이 식은 반사계수, 구면파 위치에 따른 감소 고려 및 입사된 음파의 감쇠 및 산란된 음파의 감쇠를 포함하고 있다. 또한 음원으로부터  로 전달되는 지연시간
로 전달되는 지연시간  도 함께 내포하고 있다. 따라서 이 식 (11)이 초음파 영상 방정식의 핵심이라 할 수 있다.
도 함께 내포하고 있다. 따라서 이 식 (11)이 초음파 영상 방정식의 핵심이라 할 수 있다.
초음파 영상 시스템
초음파 영상은 필름 방사선 영상 다음으로 세계에서 가장 많이 사용되는 의학 영상이다. 대부분의 의료용 초음파 영상 시스템에서는 초음파를 생성하고 수신하는 프로브가 동일한데 이를 펄스-에코 모드((pulse-echo mode)라 한다. 초음파 영상을 만드는 과정을 간단히 살펴보면 먼저 신체 피부와 공기와의 직접적인 접촉을 피하기 위해 젤(gel)을 프로브에 바른다. 그 다음 프로브를 신체 부위와 접촉시키고 펄스 형태의 짧은 음파를 발생시킨다. 몸속으로 전달된 음파는 조직 표면이나 작은 산란체들에서 반사된다. 이렇게 산란되거나 반사되어 프로브로 되돌아온 음파는 다시 전기 신호로 변환, 증폭, 저장되며 이를 화면을 통해 영상으로 보여주게 된다.
초음파 영상은 이를 표시하는 방법에 따라 진폭 표시법(amplitude mode)인 A-모드(A mode), 밝기 표시법(brightness mode)인 B-모드(B-mode), 움직임 표시법(motion mode)인 M-모드(M-mode) 그리고 도플러 모드(Doppler mode, D-mode)로 나눌 수 있다.
진폭(A) 모드
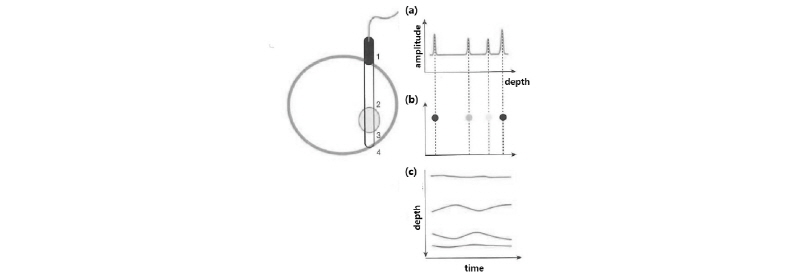
A-모드(Fig. 27(a))는 초음파 영상 표시 방법 중 가장 기초적인 형태로 가로축에 시간, 세로축에 반사파의 진폭을 나타낸다. 펄스-에코의 반사 신호의 시간은 반사체까지의 거리 즉, 깊이를 의미하고, 반사파의 진폭은 반사파의 세기를 나타낸다. 따라서 액체나 반고체 내용물이 들어있는 낭종(cyst) 같은 경우 진폭이 아주 낮게 나타나며, 고형성 종양(solid mass)인 경우 진폭이 높게 나타나므로 낭성과 고형성을 구별하는 데 유용하다.
|
Fig. 27. Ultrasound imaging. (a) A-mode (b) B-mode (c) M-mode. 1=skin surface, 2,3=blood vessel, 4=body (Shim, 2011). |
밝기(B) 모드
B-모드(Fig. 27(b))는 진폭의 크기로 표시되는 A-모드의 에코 세기를 점의 밝기로 나타내는 방법이다. 각 점들의 밝기는 진폭이 클수록 밝게 나타난다. 현재 대부분의 초음파 진단 장비에서는 B-모드가 사용되고 있다. 1개의 초음파 빔은 1차원 영상밖에 구성할 수 없지만, 여러 초음파 빔을 발생시키면 2차원 단면 영상을 얻을 수 있다. 그리고 이러한 2차원 단면을 모아 입체적으로 관찰하면 3차원의 초음파 영상을 얻을 수 있으며, 여기에 시간 요소를 더하면 3차원 초음파 영상을 실시간 영상으로 내부의 해부학적 움직임을 볼 수 있는 4차원 영상이 된다.
움직임(M) 모드
A-모드는 반사파의 위치에 따른 진폭의 변화를 나타내지만, M-모드(Fig. 27(c))는 움직이는 반사체의 거리를 시간에 따라 표시하는 방법으로, 세로축에는 반사체의 깊이를, 가로축에는 시간을 표시한다. 이와 같이 M-모드는 초음파 반사 신호로부터 반사체의 깊이와 속도 정보를 알 수 있으므로 심장이나 혈관 등의 운동 상태를 파악하는 데 적합하다.
Fig. 27은 초음파 빔이 피부 표면(skin surface) (1), 혈관(blood vessel) 앞쪽 벽 (2), 혈관 뒤쪽 벽 (3) 그리고 신체(body) 벽 (4)에 전달되면서 맥동성 혈관을 통과하는 것을 초음파 모드로 나타낸 것이다. A-모드 (a)는 4개 반사체의 진폭을, B-모드 (b)는 진폭의 밝기를, M-모드 (c)는 앞쪽 벽 (2)와 뒤쪽 벽 (3) 사이의 주기적인 변화를 보이는 혈관의 맥동을 보여준다.
도플러(D) 모드
도플러 효과(Doppler effect)에 의해 반사된 음파의 진동수가 변화하는 것을 이용하여 물체가 프로브에 접근하고 있는지 멀어지고 있는지를 판정해 영상으로 나타낼 수 있다. 의료용 기기에서는 혈류의 방향이 프로브를 향해 흐르면 빨간색, 프로브에서 멀어지면 파란색을 나타내도록 설정되어 있다. 여기서 도플러 효과를 잠깐 설명하자. 음원이 소리를 관측하는 프로브로부터 멀어지고 있다면 도플러 효과에 의해 다음의 식을 얻을 수 있다(Prince and Links, 2016).
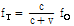 (12)
(12)
여기서, 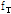 는 프로브에서 측정되는 수신 진동수,
는 프로브에서 측정되는 수신 진동수, 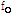 음원에서의 진동수,
음원에서의 진동수, 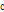 는 매질의 음파 속도(예: 음속은 연부조직(soft tissue)에서 1540 m/sec이다),
는 매질의 음파 속도(예: 음속은 연부조직(soft tissue)에서 1540 m/sec이다), 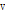 는 반사체(예: 혈관 내 적혈구)의 속도이다.
는 반사체(예: 혈관 내 적혈구)의 속도이다.
관측자와 음원의 이동 방향 사이의 각도 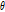 를 고려하면 식(12)는 다음과 같이 쓸 수 있다.
를 고려하면 식(12)는 다음과 같이 쓸 수 있다.
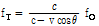
도플러 변위 진동수(Doppler shift frequency) 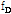 는 음원의 진동수와 관측된 진동수 사이의 차이(
는 음원의 진동수와 관측된 진동수 사이의 차이(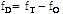 )로 정의하므로 다음과 같이 된다.
)로 정의하므로 다음과 같이 된다.
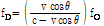 (13)
(13)
일반적으로 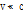 이므로 식 (13)은 다음과 같이 간략하게 쓸 수 있다.
이므로 식 (13)은 다음과 같이 간략하게 쓸 수 있다.
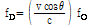
펄스-에코 모드에서는 프로브가 음원이면서 동시에 도플러 효과에 의해 변형되어 오는 반사 음파의 관측자이기도 하다. 따라서 도플러 변위 진동수는 개개의 경우 2배로 나타난다.
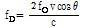 (14)
(14)
이 식 (14)로부터 알 수 있듯이 도플러 효과는 입사각  에 영향을 받는데 입사각이 클수록 도플러 변위는 작아지고 민감도는 떨어지므로 일반적으로 30°
에 영향을 받는데 입사각이 클수록 도플러 변위는 작아지고 민감도는 떨어지므로 일반적으로 30° 60° 사이에서 검사가 가능하다.
60° 사이에서 검사가 가능하다.
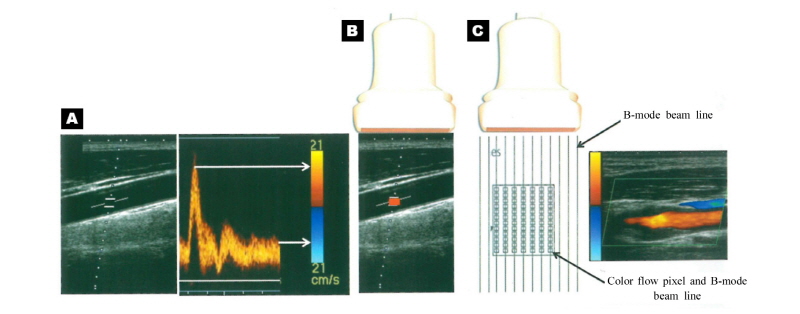
이러한 도플러 모드에는 색 도플러(color Doppler, C-mode), 출력 도플러(power Doppler), 분음 도플러(spectral Doppler) 모드 등이 있다. 여기서는 가장 공통적으로 사용되고 있는 색 도플러 모드로부터 혈류 흐름을 나타내는 영상을 구성하는 과정에 대해 Fig. 28을 통해 살펴보도록 하자(Shim, 2011). (A) 먼저 프로브에서 내보낸 초음파 빔(beam)의 샘플 체적(또는 샘플 게이트)으로부터 수신된 신호는 움직이는 혈류로부터 반사되어 온 것으로 도플러 효과에 의해 각각 다른 변위(Doppler shift)를 가지는데 이를 스펙트럼으로 나타내고, 스펙트럼의 높낮이를 색으로 표시한다. (B) 스펙트럼을 실시간으로 움직이는 색상자(color box)로 표시하고 각각의 체적에 대한 혈류 속도를 색으로 부호화(coding)시킨다. (C) 이렇게 해서 일정한 크기의 상자 안에 모든 샘플 게이트를 열어 놓고 각각의 스펙트럼의 도플러 변위를 색으로 변환하여 실시간으로 표시한다.




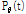 is a parallel projection of the function
is a parallel projection of the function  (Kak, 1979).
(Kak, 1979).
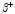 decay.
decay.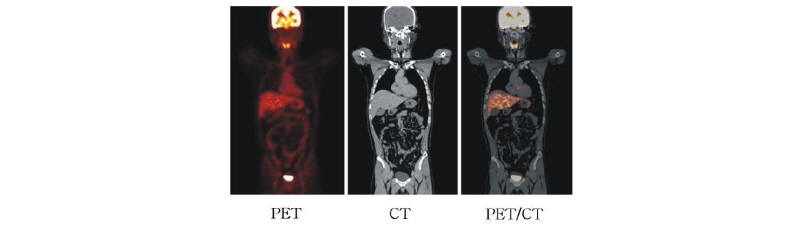
 ) relaxation (Lee, 2014).
) relaxation (Lee, 2014).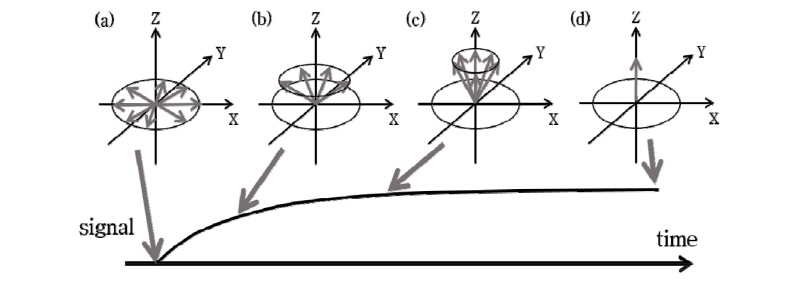
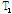 ) relaxation (Lee, 2014).
) relaxation (Lee, 2014).