서 론
원자번호 23번의 전이금속인 바나듐(V)은 철강에 소량만 첨가하여도 강도를 높여주므로 철강산업 분야에서 다양하게 사용되며, 타이타늄과의 합금은 강도와 열안정성이 높아 제트엔진과 항공기 동체 등에 사용된다(Lee, 2009; Lmtiaz et al., 2015; Ju et al., 2018). 이러한 특성으로 인하여 현재 바나듐의 용도별 사용량은 철강제의 첨가제 84%, 타이타늄 등 기타 금속 및 합금용 9%, 촉매제 및 배터리용 등 비금속용 5%가 사용되고 있다(Kim and Jeon, 2019). 최근 바나듐은 바나듐 레독스 흐름전지(VRFB; vanadium redox flow battery)의 전해질로서 많은 주목을 받고 있으며 이에 따라 바나듐의 수요가 증가하고 가격이 폭등하였다(Skyllas‐Kazacos and Grossmith, 1987; Cunha et al., 2015; Choi and Lim, 2016; Choi et al., 2017). 이에 따라 국내에서도 바나듐의 안정적 확보를 위한 효과적 선별기술 등에 대한 관심이 증가하고 있다(Kim and Jeon, 2019).
바나듐은 해수 중 두 번째로 높은 농도(평균 30 nM)로 존재하는 금속이며(Butler, 1998), 타이타늄 자철석 광상(Evans and White, 1987), 함우라늄 광물(Crans et al., 1998) 등에 존재한다. 특히 원유, 석탄 등 화석연료에 고농도로 존재하여(Rehder, 1995), 화석 연료 연소 등 인위적 산업활동에 의한 원인이 대기 중 바나듐의 53%를 차지한다(Hope, 1994).
미량의 바나듐은 생물체에 영양소로 작용하고 당뇨병의 일부 증상을 완화하는 것으로 알려졌으나(Rehder, 2013), 포유류 및 인체에 대한 유해성에 관한 연구 역시 지속적으로 이루어지고 있다. 필수 영양분인 인산이온(PO3-)과의 유사성으로 인해 일부 미생물이 VO3-를 흡수함으로써 인산 대사작용이 저해되기도 하며(Mannazzu et al., 1997), 포유류의 생식 및 발달, 행동에 독성을 미치는 것으로 나타났다(Domingo, 2000). 바나듐의 독성은 전자가와 용해도에 크게 좌우되며 쉽게 녹는 V(V)가 비용해성인 V(IV)에 비하여 독성이 큰 것으로 알려져 있다(Patel et al., 1989; Crans et al., 1998). 이러한 바나듐의 특성은 물 속에 용존되어 있는 V(V)를 4가 이하의 바나듐으로 환원하여 침전물로 제거하는 방식을 통해 처리할 수 있는 가능성을 나타낸다(Ortiz-Bernad et al., 2004; Zhang et al., 2014).
철, 망가니즈, 비소, 크로뮴, 우라늄, 안티모니 등 두 개 이상의 산화상태로 존재하는 산화환원전위 민감원소(RSE, redox-sensitive elements)는 그 산화수에 따라 이동도 및 독성에 큰 차이를 보인다. 예를 들어, 크로뮴은 산화상태(Cr(VI))일 때 이동도 및 독성이 크나 Cr(III)로 환원되면 침전하여 이동도 및 독성이 감소한다. 일부 미생물이 이들 RSE의 산화환원전위 변화에 지대한 영향을 미침은 널리 알려진 사실이며, RSE의 화학종을 변화시킬 수 있는 박테리아의 역할을 규명하면 토양, 퇴적물, 지하수 등 지질 매체 내 존재하는 이들 원소들의 거동 및 순환을 보다 정확히 예측하고 오염 정화 기술개발에 효과적으로 적용할 수 있다.
최근에는 이러한 미생물학적 원소 환원 결과 생성된 물질들을 산업적으로도 매우 유용하게 사용할 수 있다는 결과가 보고되고 있다. 예를 들어, Sb(V)를 이화적(dissimilatory)으로 환원하는 신종 박테리아를 찾으려는 과정 중 Sb(V) 환원 결과 삼산화안티모니(Sb2O3) 나노입자가 생성됨을 발견하였다(Abin and Hollibaugh, 2013; Nguyen and Lee, 2014; Joo et al., 2016). 삼산화안티모니 나노입자는 각종 첨단산업에 유용하게 사용되는 재료로서 현재 공업적으로 용매열합성 또는 수열합성 방식으로만 제조하고 있다. 이 방법은 투입되는 에너지와 설비가 많아 고가이고 유독한 화학 부산물을 생성한다는 단점이 있는데, 미생물에 의한 저온 합성이 실용화되면 기존의 삼산화안티모니 생산 공정에 효율성․경제성․친환경성의 개선을 가져올 수 있다.
미생물에 의한 바나듐 환원에 대하여 일부 연구가 수행된 바 있다. 대표적으로 Pseudomonas vanadiumreductans (Lyalikova and Yurkova, 1992), Shewanella oneidensis (Carpentier et al., 2003, 2005), Geobacter metallireducens (Ortiz-Bernad et al., 2004) 등의 박테리아를 비롯하여, 고세균(aechaea)인 Methanosarcina mazei와 Methanothermobacter thermautotrophicus(Zhang et al., 2014) 및 진핵생물인 Saccharomyces cerevisiae(Bisconti et al., 1997)에 의한 바나듐 환원이 보고되었다.
Shewanella 속(genus) 중, S. oneidensis를 이용한 바나듐 환원 연구는 수행된 바 있으나(Carpentier et al., 2003, 2005) 다양한 RSE를 환원시키는 것으로 알려진 S. putrefaciens를 이용한 연구는 아직 수행된 바 없다. 이 연구에서는 V(V) 용액에 S. putrefaciens를 접종하여 배양하였을 때 용존 바나듐의 거동에 어떠한 변화가 발생하는지 관찰하고자 하였다. 또한 미생물학적 원소 환원의 또 다른 산업적 활용 가능성을 확인하기 위하여, VRFB 전해질 제조에 적용할 수 있는 가능성을 살펴보려 하였다. 현재 VRFB의 총 비용에서 V(IV) 전해질 제조에 소모되는 비용이 큰 부분을 차지하므로(Han et al., 2014), 미생물을 이용하여 보다 저렴하게 V(V)를 환원할 수 있으면 경제적인 VRFB 기술 개발에 기여할 것으로 생각한다.
실험방법
바나듐 용액은 순도 99% 오산화바나듐(V2O5)(주성교역)을 탈이온수에 용해하여 제조하였다. 박테리아는 대표적인 금속환원균인 S. putrefaciens를 한국생물자원센터(KCTC, Korean Collection for Type Cultures)에서 구입하여 사용하였다. 구입한 S. putrefaciens는 아래 조성을 갖는 조정된 marine broth 배양액을 이용하여 농화 배양한 후 실험에 사용하였다(단위: g/L): 펩톤(peptone) 5.0, 효모추출물(yeast extract) 1.0, NaCl 19.5, CaCl2 1.8, KBr 0.08, MgCl2 5.9, KCl 0.55, NaHCO3 0.16. 또한 원활한 생장을 위하여 다음 조성의 미량원소를 배지에 공급하였다(단위: mg/L): SrCl2 34, H3BO3 22, NaF 2.4, NH4NO3 1.6, Na2HPO4 8, Na2SiO3 4.
미생물에 의한 바나듐 환원 여부를 확인하기 위하여 호기 및 혐기조건에서 7일간 1차 실험을 수행하였다. 이를 위해 200 mg/L 농도의 V(V)와 500 mg/L의 젖산염(lactate)을 함유한 marine broth 배양액 145 mL에 지수성장기까지 생장한 S. putrefaciens 5 mL(1.65 × 107 CFU/mL)을 접종하였다. 용액 pH는 HEPES를 이용하여 7을 유지하였으며, Orion 3-Star(Thermo Fisher)로 측정하였다. S. putrefaciens를 접종하지 않은 비교시료(control)는 혐기성 비교시료만 제조하였으며, marine broth 배양액에 V(V)과 젖산염 만을 공급하여 구성하였다. 호기성 조건은 300 mL 세럼병에 실리 스토퍼로 입구를 막아 유지하였고, 혐기성 조건의 실험은 300 mL 세럼병을 Al 캡과 고무마개로 밀봉한 후 N2 가스로 30분간 purging하여 병 내 O2를 제거한 후 수행하였다. 모든 과정에서 고압멸균기(autoclave)를 사용하여 용액과 실험 도구를 멸균하고, 젖산염은 0.2 µm 필터를 통하여 제균하였다. 0, 1, 2, 3, 5, 7일에 용액을 채취하여 산화환원전위(Orion 3-Star, Thermo Fisher)를 측정하였다. 혐기 실험은 용액 시료 채취 후 30분 동안 N2로 다시 purging하였다. 바나듐 용액은 산화수에 따라 V(V), V(IV), V(III), V(II)의 색(color)이 각각 노란색, 푸른색, 초록색, 보라색을 띠므로 용액 색 변화를 관찰하여 V(V)의 환원상태를 파악하였다. 반응 중 시간이 경과하며 침전물이 형성된 시료가 나타났으며, 실험 후 혐기성 침전물을 수거하여 XRD 분석(Miniflex 600, Rigaku)을 실시하였다.
1차 실험을 통해 미생물에 의한 바나듐 환원 가능성을 확인한 후 2차 실험에서는 부피를 제외한 동일한 조건에서 0, 1, 2, 4, 8, 12, 16, 20일에 용액 시료를 채취하여 총 용존 바나듐 함량을 측정하였다. 시료 채취로 인한 용액 부피 감소의 영향을 최소화하기 위하여 300 mL인 플라스크와 세럼병을 500 mL 크기로 교체하였으며, 용액의 부피 또한 150 mL에서 300 mL로 증가시켰다. 총 용존 바나듐은 ICP-OES (Genesis, Spectro, Germany)를 이용하여 분석하였다.
결과 및 해석
1차 실험의 결과, 시간에 따른 시료별(호기성 미생물 시료, 혐기성 미생물 시료, 혐기성 비교시료) 산화환원전위 값은 서로 유사한 결과를 보였다. 0일 0.25~0.32 V에서 1일 경과 후 0.09~0.16 V로 감소한 후 거의 유지되어 7일 경과 후 0.08~0.15 V를 보였다.
바나듐의 산화수 변화를 나타내는 색 변화는 미생물 시료와 비교시료 간에 뚜렷한 차이를 보였다. 0일과 7일 경과 후 시료의 색 변화를 관찰한 결과, 호기 및 혐기성 환경에서 미생물 접종시료는 모두 0일에 노란색을 띄었다가 7일 경과 후에는 진한 초록색으로 동일한 색 변화를 보였다(Fig. 1). 이는 주입한 미생물에 의해 V(V)가 환원되었음을 나타낸다(Bisconti et al., 1997). 또한 시간이 경과하며 용액 시료 내에 침전물이 생성되었는데, 이는 용존 상태로 존재하던 V(V)가 중성 pH에서 용해도가 낮은 V(IV)로 환원되어 침전한 것으로 보였다.
미생물을 접종하지 않은 혐기성 비교시료의 경우 0일에 노란색으로 나타나던 용액이 7일에는 투명하게 색이 변화된 것을 확인하였다. 비교시료의 경우도 7일 경과 후 침전물이 형성되었으며 이는 혐기환경 조성에 의한 바나듐의 화학적 환원에 기인한 것으로 판단하였다.
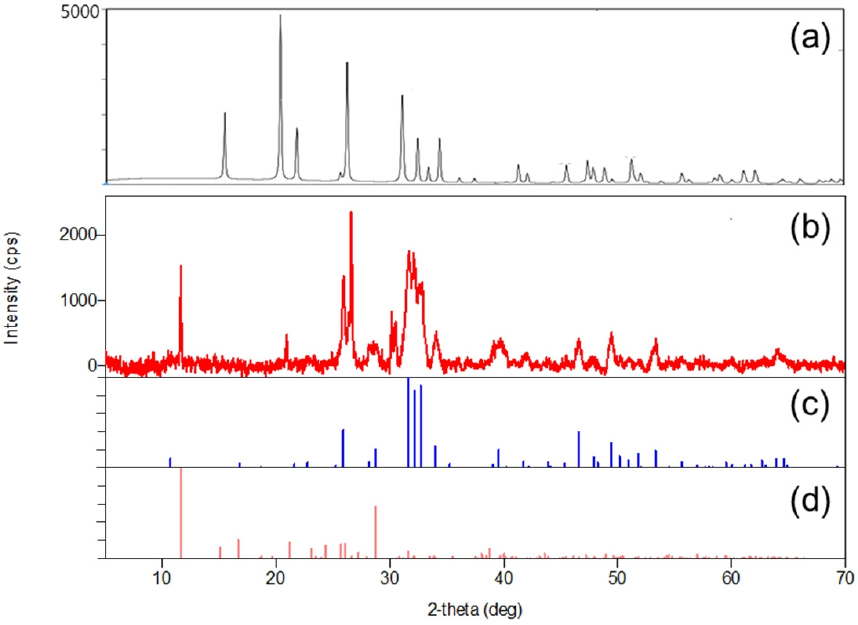
혐기성 미생물 시료에서 나타난 침전물을 회수하여 XRD로 분석한 결과(Fig. 2(b)), 일부 V2O5(Fig. 2(a))와 carbonate- hydroxyapatite(Fig. 2(c))의 위치로 추정되는 피크가 나타나고 oxovanadium(IV) hydrogen phosphate dihydrates(Fig. 2(d)) 피크도 관찰되어 침전된 물질이 V(IV)를 포함하고 있음을 확인하였다.
혐기성 조건에서 박테리아에 의한 V(V) 환원 및 이에 따른 바나듐 침전물 형성은 수 회 보고된 바 있다. Shewanella oneidensis는 포름산, 젖산, 피루브산을 공급하였을 때 용존 V(V) 함량을 크게 감소시켰으며 감소된 V(IV)은 침전물 형태로 관찰되었다(Carpentier et al., 2003). Zhang et al.(2014)은 박테리아뿐만 아니라 고세균 역시 V(V)를 환원하고 침전물을 형성함을 보고하였다. 각각 중온성 및 고온성 메탄생성균인 Methanosarcina mazei와 Methanothermobacter thermautotrophicus는 V(V)-환원성 침전물을 생성하였고 전자에너지손실분광법(electron energy loss spectroscopy)으로 분석한 결과, 이 바나듐 침전물의 산화수는 약 4.3이었다.
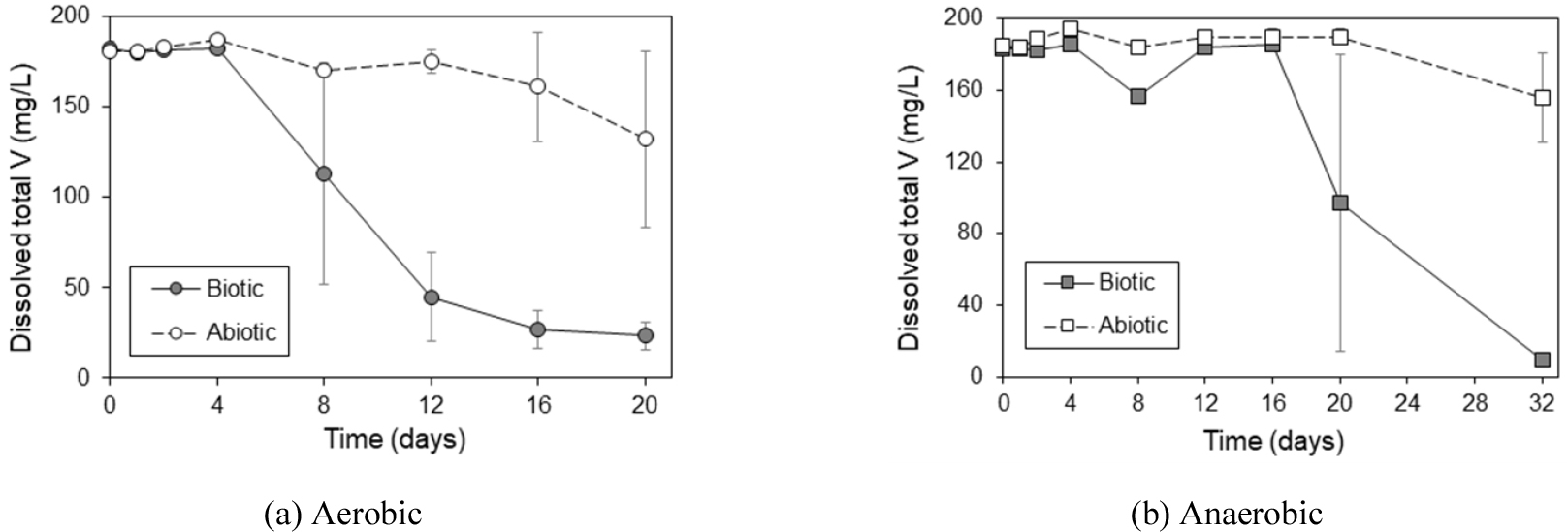
동일한 조건에서 수행한 2차 실험에서는 시간에 따른 총 용존 바나듐 함량을 측정하였다. 분석 결과, 호기성 및 혐기성 환경 모두 미생물 비접종 시료에 비하여 접종시료에서 총 용존 바나듐 함량이 급격히 감소하는 것으로 나타났다(Fig. 3). 같은 미생물 속인 S. oneidensis를 이용한 연구에서 바나듐의 2~9% 만이 박테리아 세포에 의해 흡착 또는 집적(accumulation)된 것으로 나타난 바 있어(Carpentier et al., 2003), Fig. 3에서 관찰된 용존 바나듐 감소는 세포외(extracellular) 침전을 통하여 용액으로부터 제거된 것으로 보였다. 미생물의 집락수를 관찰한 결과(자료 미기재), 호기성 환경에서는 4~8일에 급격히 증가하다 이후 감소한 것을 확인하였다. 혐기성 조건에서는 초기 미생물의 성장이 매우 더디게 나타났으나 16일을 기점으로 크게 증가하는 것을 확인하였으며 이는 용존 바나듐 함량의 감소 시기와 일치하였다.
이 연구에서 수행한 방법으로는 명확한 메커니즘을 알기 어려우나, 호기성 환경에서의 V(V) 환원 원인은 아마도 S. putrefaciens의 V(V) 해독(detoxification)인 것으로 보인다. 효모인 S. cerevisiae에 의한 V(V) 환원을 연구한 Bisconti et al.(1997)은 인산염운반시스템(phosphate transport system; Bowman, 1983)에 의해 세포 내로 들어온 V(V)를 미생물이 세포 내에서 V(IV)로 환원한 후 세포 밖으로 배출하였을 가능성을 제시하였다. 소량의 O2가 존재할 경우에도 S. putrefaciens에 의한 Fe(III) 환원이 보고된 바도 있으나(Arnold et al., 1990), 호기성 조건에서 수행한 이 연구에서는 O2가 더욱 강력한 전자수용체(electron acceptor)로 작용하였을 것이므로 박테리아에 의한 이화적 V(V) 환원 가능성은 낮다.
한편, 혐기성 조건에서의 V(V) 환원은 위에서 말한 해독성 메커니즘 이외에도 V(V)를 전자수용체로 하여 호흡한 결과 V(IV)로 환원되었을 가능성도 있다(Carpentier et al., 2003; van Marwijk et al., 2009; Zhang et al., 2014).
기존의 연구는 미생물에 의한 V(V) 환원을 호기성 또는 혐기성 단일조건에서만 수행한 것에 비하여, 이 연구에서는 두 조건에서 모두 생존 가능한 S. putrefaciens가 호기성 및 혐기성 조건 모두에서 V(V)를 환원할 수 있다는 결과를 얻은 것이 특징적이다. 이러한 S. putrefaciens의 능력은 VRFB의 전해질로서 필수적인 4가 이하의 바나듐을 얻는데 경제적으로 유용하게 사용될 가능성이 있다. Zhang et al.(2014)은 미생물에 의해 얻어진 V(V) 환원 침전물을 2 M H2SO4로 용해하여 분석한 결과 용존 바나듐이 V(IV) 상태로 존재함을 밝힌 바 있다.
바나듐 레독스 흐름전지 적용 가능성
화석 연료 연소가 환경오염 및 지구온난화의 주원인으로 밝혀짐에 따라 다양한 종류의 신재생에너지가 새로운 에너지원으로 각광받고 있다. 그러나 신재생에너지는 운전 조건의 제약에 영향을 받는 관계로 전력 공급이 안정적이지 못한 단점을 가지고 있다. 이러한 한계점을 극복하기 위해 최근 잉여 에너지의 저장 및 적시 공급이 가능하여 전력 운영을 최적화할 수 있는 에너지 저장장치(ESS, energy storage system)의 중요성이 주목받고 있다. ESS에는 납축전지 및 리튬 이차전지 등의 범용 ESS 이외에도 플라이휠(flywheel), 슈퍼 커패시터(super capacitor) 등의 단주기 ESS, 압축공기 에너지저장(CAES, compressed air energy storage), 나트륨-황 전지(NaS battery), 레독스 흐름전지(RFB, redox flow battery) 등의 장주기 ESS가 있는데(Choi and Lim, 2016), 이 중 긴 수명과 안정성, 대형화 설비, 투자비용 절감 등의 장점으로 인하여 최근 VRFB가 가장 주목받고 있다(Sum et al., 1985; Skyllas-Kazacos and Grossmith, 1987; Rychcik and Skyllas-Kazacos, 1988).
VRFB는 특히 대용량 에너지 저장장치의 필요성이 증가함에 따라 전 세계적으로 활발한 연구가 진행되고 있다. 일본은 2013년부터 대규모 ESS 시스템의 실증을 마친 후 현재 Hokkaido 지역에 세계 최대 규모인 15 MW/60 MWh VRFB ESS를 설치 중이다. 중국은 2011년 Zhangbei 지역에서 4 MW/8 MWh의 VRFB를 실증하였으며, 독일은 2013년 Pellworm 지역에 200 kW/1.6 MWh 용량의 VRFB ESS를 설치하여 운영하고 있다(Han et al., 2014).
RFB는 전해액 내의 활성물질(active materials)이 산화·환원되어 충·방전되는 시스템으로 전기에너지를 전해액의 화학적 에너지로 저장시키는 전기화학적 축전장치이다(Skyllas-Kazacos et al., 2016). VRFB 운전시 양극과 음극에서는 아래 식 (1), (2), (3)의 전기화학적 반응이 발생하여 1.25 V의 표준전압이 발생한다(Choi et al., 2017).
전기화학적 반응은 펌프를 통해 전해액을 스택(stack) 내부에 지속적으로 순환시켜 발생하므로, VRFB의 정상적인 운전을 위해 우선적으로 V(V)O2+, V(IV)O2+, V(III), V(II) 등 다양한 전자가를 갖는 바나듐 전해액이 만들어져야 한다. 특히 V(IV)O2+의 제조가 중요한데 이는 상대적으로 저렴한 V(V)2O5로부터 V(IV)OSO4를 제조한 후 용해하여 만들거나 또는 V(V)2O5를 직접 전기분해하거나 환원제를 투입하여 제조한다(Skyllas-Kazacos et al., 1987).
VRFB는 다른 2차전지와 비교해 보았을 때 대용량에서 매우 높은 가격 경쟁력을 가진다. 그러나 VRFB의 총 비용만으로 보았을 때 V(IV)O2+의 제조에는 많은 에너지가 소요될 뿐만 아니라 상당한 비용이 들어가며 현재 VRFB의 총 비용에서 전해질 제조에 소모되는 비용이 약 50% 가량을 차지한다(Han et al., 2014). 따라서 효과적이면서도 경제적인 바나듐 전해질 제조기술이 VRFB 대중화에 매우 핵심적인 부분을 차지한다. 이 연구에서 나타난 것처럼 미생물을 이용하여 중온 조건에서 V(V) 환원산물을 저렴하게 제조하는 것이 실용화될 경우 VRFB의 국내 기술 개발에 혁신적인 기여를 할 것으로 생각한다.